IF=20.8|源井点突变细胞助力揭示乙酸参与肿瘤代谢重编程与免疫逃逸新机制

乙酸是乙酰辅酶A的前体,在能量产生、脂质合成和蛋白质乙酰化中起重要作用。然而,乙酸是否重新编程肿瘤代谢并在肿瘤免疫逃逸中发挥作用仍不清楚。
近日,浙江大学吕志民及中国医学科学院/北京协和医学院赫捷共同通讯在Nature Metabolism(IF: 20.8)上,发表了题为“Acetate reprogrammes tumour metabolism and promotes PD-L1 expression
and immune evasion by upregulating
c-Myc”的研究论文。该研究表明乙酸是人类非小细胞肺癌组织中最丰富的短链脂肪酸,随着肿瘤富集的乙酸摄取增加。该研究采用源井生物构建MYC(p.K148R)点突变的A549细胞,MYC(p.K148Q)点突变的A549细胞,模拟乙酰化和非乙酰化的c-Myc状态,并研究这些改变对肿瘤细胞行为的影响。
乙酸衍生的乙酰辅酶A诱导c-Myc乙酰化,这是由代谢酶二氢脂酰胺S-乙酰转移酶的月光功能介导的。为了深入理解c-Myc乙酰化的功能和机制,采用源井构建MYC(p.K148R)A549细胞和MYC(p.K148Q)A549细胞,模拟乙酰化和非乙酰化的c-Myc状态,并研究这些改变对肿瘤细胞行为的影响。研究发现乙酰化的c-Myc增加了其稳定性和随后编码程序性死亡配体1、糖酵解酶、单羧酸转运体1和细胞周期加速因子的基因的转录。膳食中补充乙酸可促进肿瘤生长并抑制CD8+
T细胞浸润,而破坏乙酸摄取可抑制免疫逃逸,从而提高抗PD-1治疗的疗效。
血液循环中的乙酸可以来自饮食(例如,乳制品、加工肉类和面包、乙醇和不易消化的碳水化合物)、肠道微生物群对膳食纤维的分解以及体内乙酰化的代谢物。人血浆中乙酸浓度在50
μM ~ 200 μM之间,慢性饮酒者血浆中可高达800
μM以上。乙酸是人类肿瘤中的生物能底物。使用11C-乙酸的正电子发射断层扫描(PET)成像研究显示,前列腺、肺、肝和脑肿瘤患者大量摄取乙酸,与18F-氟脱氧葡萄糖PET成像相比,在准确性和灵敏度方面具有优势。
在核磁共振促进的13C-乙酸代谢示踪剂研究中,在手术切除期间,胶质母细胞瘤、乳腺癌和非小细胞肺癌(NSCLC)患者输注13C-乙酸以依赖于乙酰辅酶A合成酶2(ACSS2)的方式显示出强大的乙酸盐氧化,ACSS2将乙酸和辅酶A转化为乙酰辅酶A(acetyl-CoA4)。此外,ACSS2在乙酸依赖性脂肪生成和组蛋白乙酰化中发挥重要作用,并在代谢应激下维持肿瘤细胞生长。尽管乙酸作为一种能量来源和组蛋白修饰依赖性基因表达的调节剂已被广泛研究,但它是否通过直接调节致癌蛋白介导肿瘤生长仍不清楚。
该研究证明了NSCLC细胞以单羧酸转运体1
(MCT1)依赖的方式摄取乙酸。乙酸衍生和ACSS介导的乙酰辅酶A产生诱导二氢脂酰胺S-乙酰基转移酶(DLAT)介导的c-Myc
Lys148乙酰化,从而募集泛素特异性肽酶10
(USP10)去泛素化和稳定c-Myc,导致程序性死亡配体1
(PD-L1)表达增强,促进肿瘤免疫逃逸,糖酵解和细胞周期进展基因的表达,加速细胞增殖。
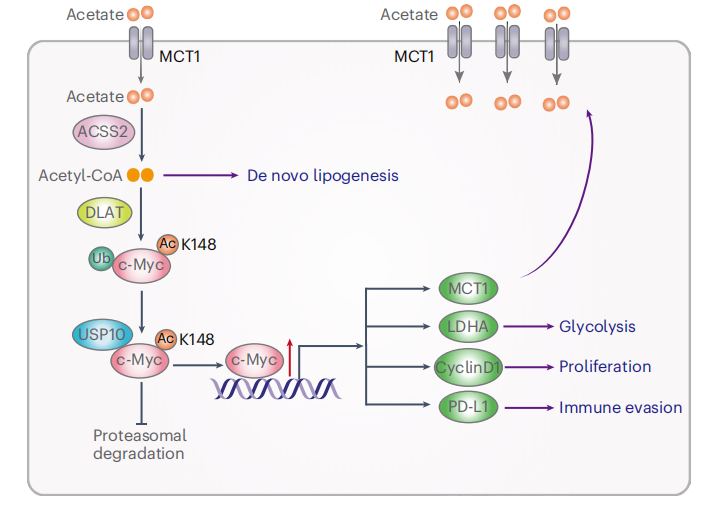
图1 机理模式图
总之,这些发现强调了乙酸促进肿瘤生长的关键作用,而不仅仅是作为碳源的代谢作用,通过重编程肿瘤代谢和免疫逃逸,并强调了控制乙酸代谢抑制肿瘤生长和改善免疫检查点阻断治疗反应的潜力。
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划