IF=16.6 | 独立于p53信号通路的非小细胞肺癌药物治疗策略开发


IF=16.6 | 独立于p53信号通路的非小细胞肺癌药物治疗策略开发

非小细胞肺癌由于TP53高突变水平表现出高耐药性,导致治疗效果差、生存率低。顺铂作为非小细胞肺癌的一线治疗药物,却也存在引起突变的风险。如果顺铂化疗期间p53突变累积,将进一步影响患者化疗后的生存率。因此,开发一种独立于p53通路的肿瘤药物治疗方案非常重要。
近日,中国药科大学姜虎林课题组在Nature子刊《自然通讯》(Nature Communications, IF: 16.6)上,发表了题为“Nanoparticles targeting mutant p53 overcome chemoresistance and tumor recurrence in non-small cell lung cancer”的原创性研究论文。该研究采用源井生物构建突变型p53质粒,通过考察转染质粒的H1299细胞的顺铂耐药性,深入阐明了以p53突变作为出发点以改良顺铂临床应用的局限性的必要性。
本项研究中,首先验证了肿瘤治疗期间顺铂进行性化疗耐药的一些可能机制,包括伴随着TP53突变风险增加,顺铂耐药性也增加。为解决这一问题,研究人员合成了由顺铂与氟伐他汀组成的Fluplatin并构建了最终制剂FP NPs。FP NPs不受p53突变的限制,靶向内质网后降解突变p53,并高效引发内质网应激,从而独立于p53途径发挥了有效的抗肿瘤作用。FP NPs减缓肿瘤进展,并体现出大幅度改善p53突变所带来的不良预后的潜力。
图文导读
在这项工作中,作者验证了一些可能的机制,在非小细胞肺癌治疗过程中对顺铂进行性耐药。顺铂的抗肿瘤作用伴随着增加的TP53突变,进一步导致顺铂耐药。氟伐他汀的联用可以缓解顺铂治疗的瓶颈(图1)。
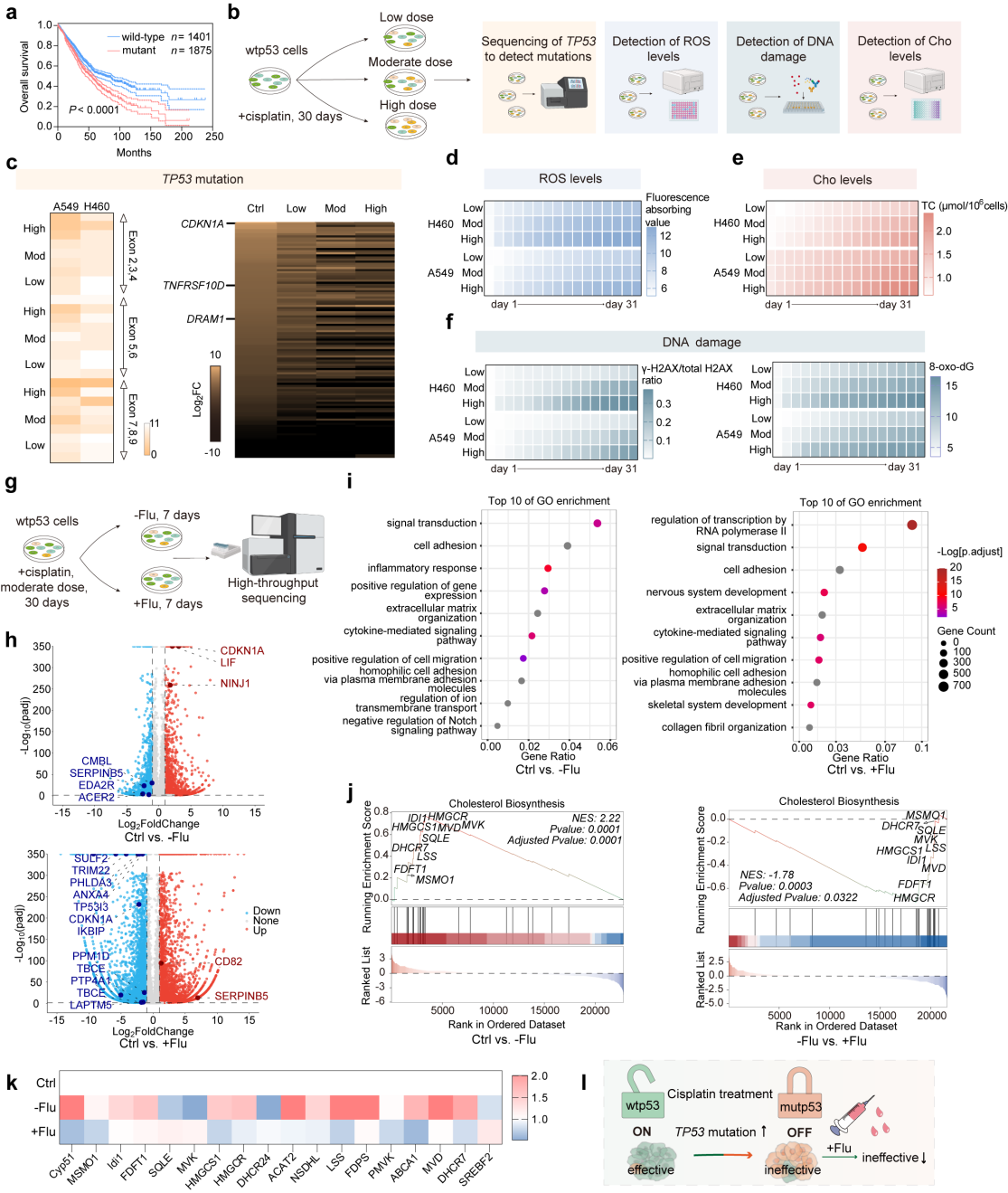
图1 顺铂与 p53 之间恶性累积的机制验证
作者通过配位反应合成一种由顺铂和氟伐他汀组成的前药Fluplatin并得到最终制剂FP NPs。同时,构建了FITC-Dil@FP NPs,并使用CLSM观察它们在细胞中的分布。结果如图所示。当Dil进入细胞时,PEG-PE插入细胞膜,并且在2小时观察到明显的分离。最后,通过ICP-MS对每个细胞器中的铂含量进行定量。FP NPs主要分布在内质网,各细胞器中Pt含量显著高于顺铂或Fluplatin。
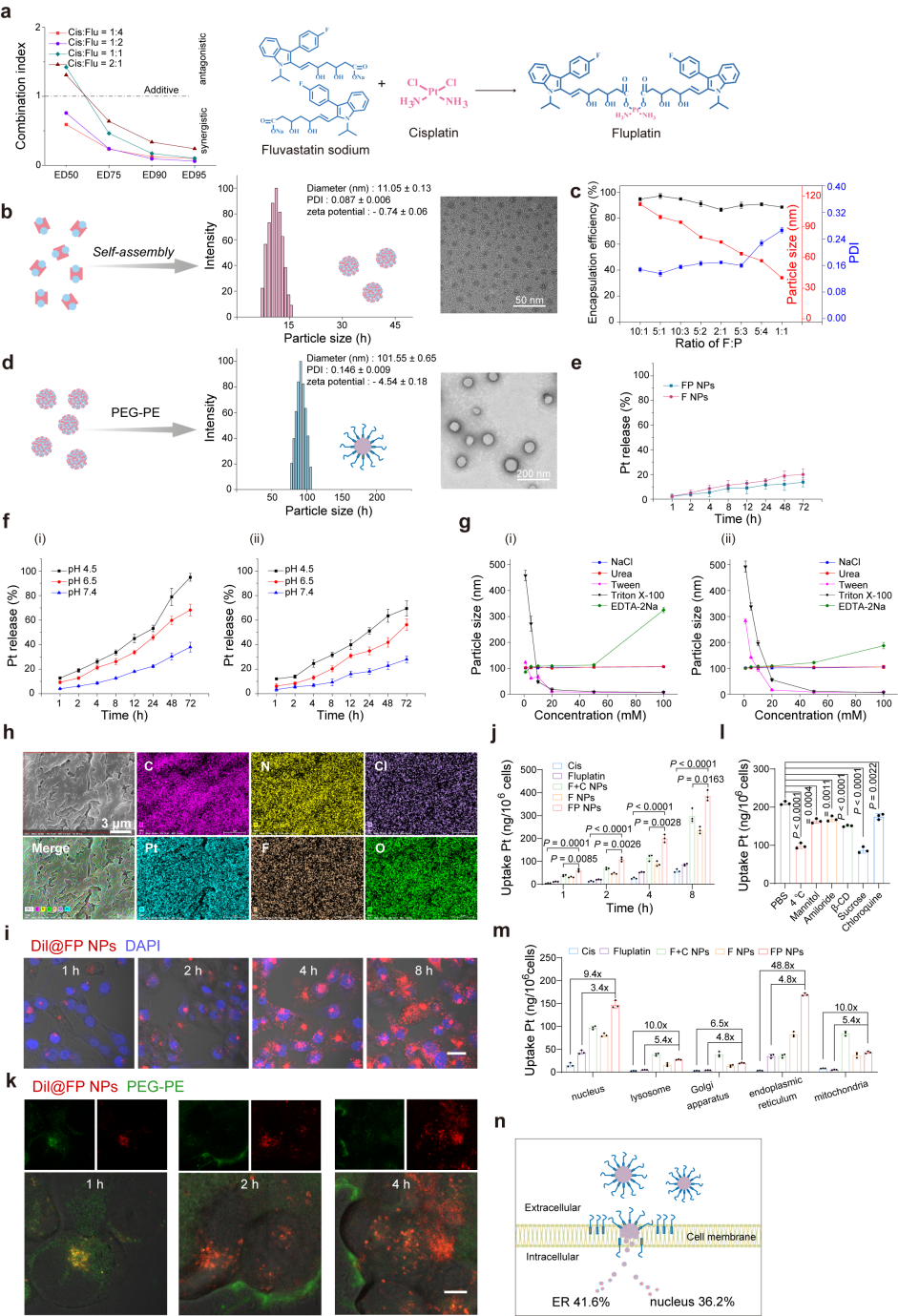
图2 FP NPs的设计和表征
由于FP NPs的ER靶向能力,我们研究了它们的内质网应激诱导能力和相关机制。首先,我们使用CLSM对ER-Tracker Green 进行了共定位分析(图3)。结果表明,Dil@FP NPs在ER上持续积累,线粒体形态逐渐从最初的丝状转变为球形。与我们之前获得的结果一致,直到Dil@FP NPs处理后8小时才观察到线粒体中 Dil@FP NP 的显着积累,表明线粒体损伤是由内质网应激引起的。此外,我们用JC-1检查了线粒体的膜电位,FP NPs诱导的膜电位最低。
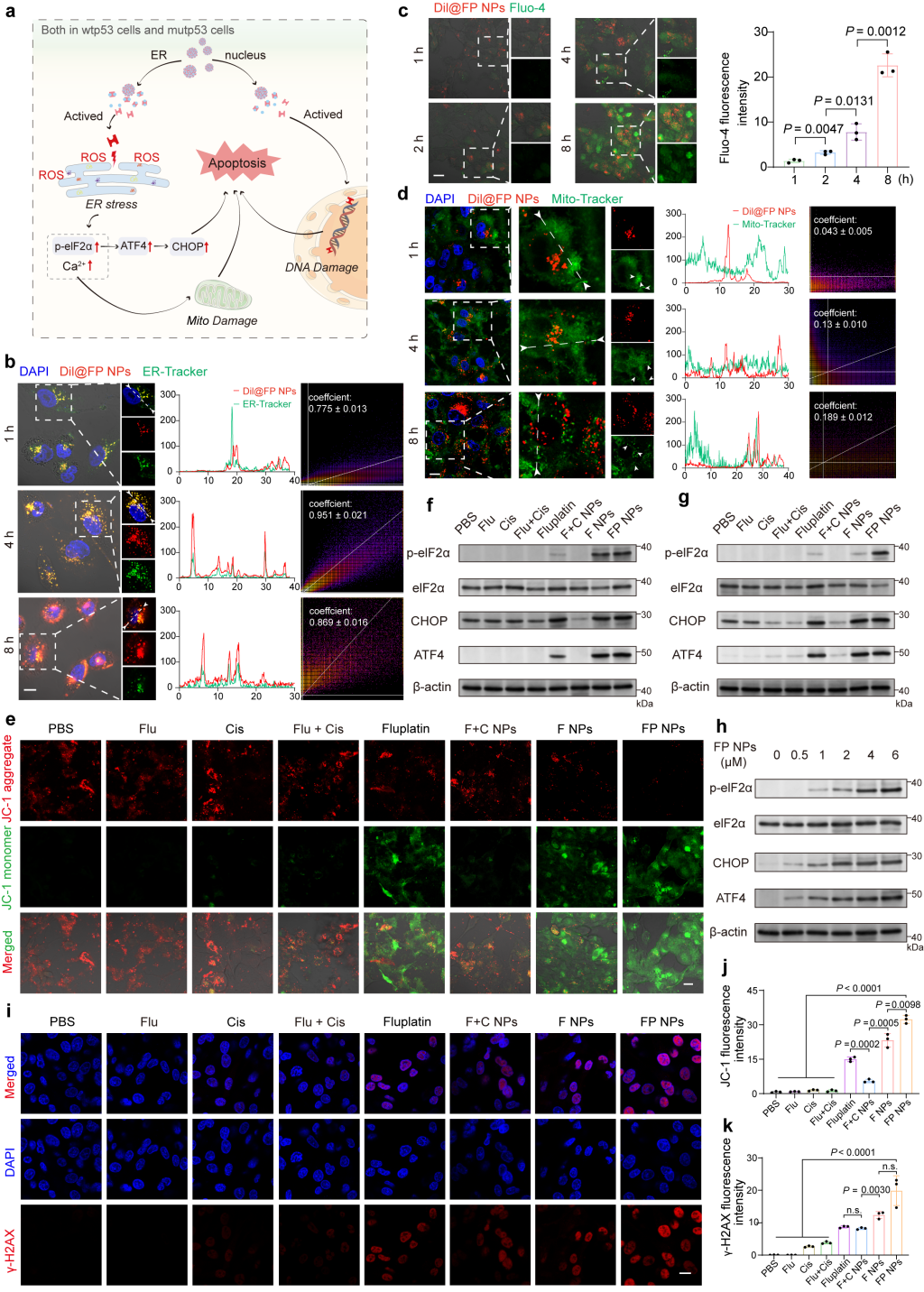
图3 FP NPs的作用机制的研究










