【文献解读】促进EPCs转分化,Kir2.1通道或是血管重塑疾病治疗新靶点!


【文献解读】促进EPCs转分化,Kir2.1通道或是血管重塑疾病治疗新靶点!
背景
在血管修复过程中,骨髓源性内皮祖细胞(endothelial progenitor cells,EPCs)被动员定位至局部血管损伤部位,并分化为血管内皮细胞。因此,EPCs是新生儿新生血管形成和血管生成的关键细胞。越来越多的证据和以往的报道表明,EPCs移植在颈动脉损伤、后肢和心肌缺血动物模型中具有治疗的潜力。有文献表明,在一定的生理或病理生理条件下,EPCs可以发生内皮-间充质转化(EndoMT),这意味着它们的功能可能会改变,但是这个转变过程的潜在机制尚未明确。最近的研究还表明,Kir2.1通道与EPCs的分化密切相关。然而,Kir2.1通道表达的改变是否影响EPCs分化(转分化)或随后的细胞学功能也尚未被讨论。
针对这个问题,来自青岛大学医学院干细胞与再生医学研究所的Xiaodong Cui等研究人员在JOURNAL OF CELLULAR AND MOLECULAR MEDICINE上发表了名为“Slight up-regulation of Kir2.1 channel promotes endothelial progenitor cells to transdifferentiate into a pericyte phenotype by Akt/mTOR/Snail pathway”的文章。文章中报道了他们对Kir2.1的轻微上调促进了通道超极化,促进了EPC间充质转化,这一过程在血管生成和血管稳定中具有重要的功能。

在这个研究中,研究人员发现Kir2.1表达的轻微上调促进了干细胞特性因子ZFX和NS的表达,抑制了与衰老相关的β-半乳糖苷酶的表达。进一步的研究表明,Kir2.1的轻微表达也可以提高周细胞分子标记物NG2、PDGFR β和Desmin的表达。此外,腺病毒介导的Kir2.1过表达会增强EPCs对去甲肾上腺素的收缩反应。这些结果表明,上调Kir2.1通道的表达可促进EPCs转分化为周细胞表型。此外,发现EPCs向间充质细胞(周细胞)转分化的机制与Kir2.1通道功能活性密切相关,该通道可通过激活Akt/mTOR/Snail信号通路促进EPCs内皮-间充质转化。
EPCs来源的周细胞表达标记蛋白Desmin,促进新生血管的成熟和稳定
Desmin是周细胞的一种结构和功能蛋白,它对维持血管稳定和周细胞牵拉非常重要。免疫荧光检测结果显示,经pAV-Kir2.1转染EPCs后Desmin蛋白表达显著增加(图1A)。为观察转分化的EPCs对血管内皮细胞稳定性的影响,将转化后的EPCs与大鼠大动脉内皮细胞(RAECs)(由源井生物提供)在基质中共培养。与对照组相比,体外转分化的EPCs表现出更长的血管(图1B和C)和更高的毛细血管样结构维持率(图2),这表明在EPCs中过表达Kir2.1可促进血管生成,稳定新生血管形成。在这个实验中,源井提供了CM-Dil-labelled RAECs有助于在荧光显微镜下观察和分析血管的形成情况。
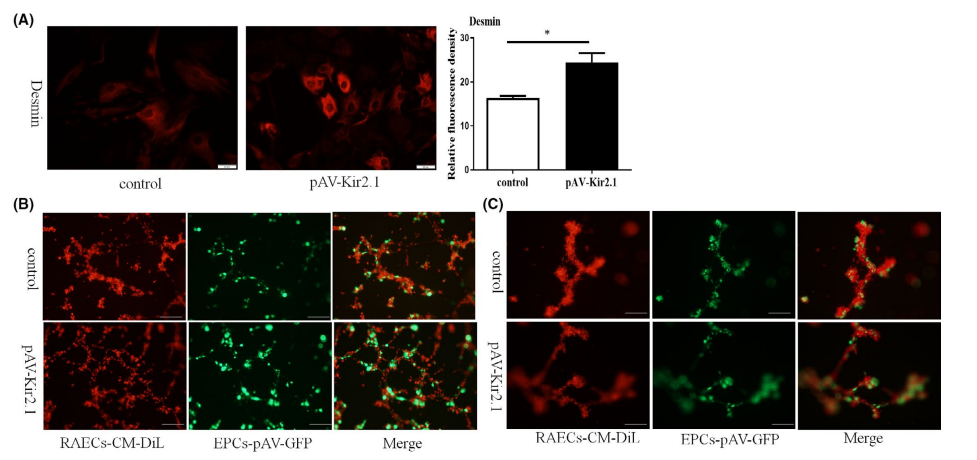
图1
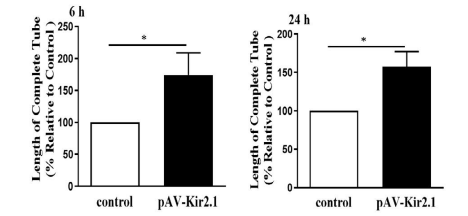
图2
Kir2.1表达的轻微上调通过Akt/mTOR/Snail信号通路促进EPCs转分化为周细胞表型
他们进一步研究了潜在的分子信号通路在Kir2.1介导的EPCs转分化中的作用。研究发现,增加Kir2.1的表达可以提高细胞内Akt和mTOR的磷酸化水平,促进Snail蛋白的表达。使用Kir2.1通道阻滞剂ML133处理消除了这些效应(图3A)。然后使用Akt磷酸化阻滞剂MK2206、p-mTOR抑制剂RAD001和Snail siRNA抑制或干扰相应信号分子的表达。然后检测这些变化对标记分子NG2和PDGFR β以及干细胞特性因子ZFX和NS表达的影响。结果显示,MK2206、RAD001和Snail siRNA可减弱Kir2.1促进的NG2、PDGFR β、NS和ZFX的上调表达(图3B),表明Akt/mTOR/Snail在Kir2.1诱导的EPCs的EndoMT中起核心作用。MK2206可以显著抑制Akt的磷酸化。结合实验其他结果表明,轻微过表达Kir2.1可以通过Akt/mTOR/Snail途径促进EPCs转分化。
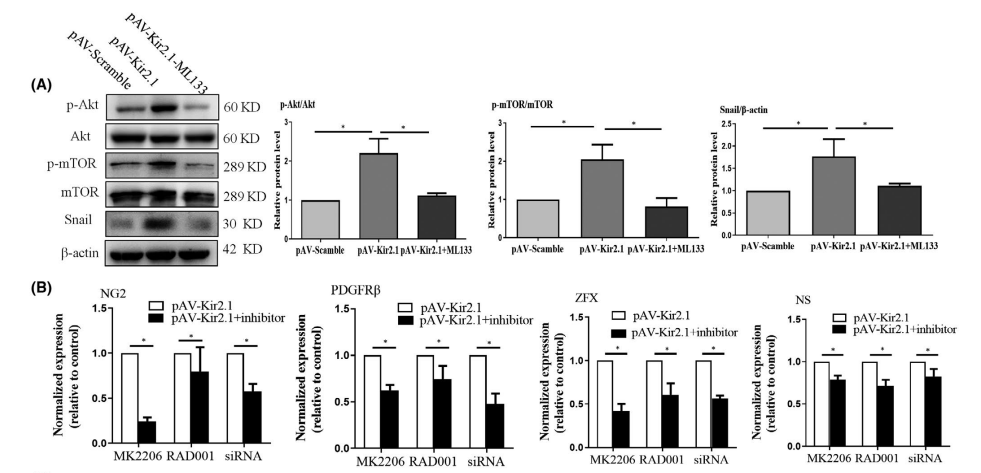
图3
综上所述,本研究揭示了在炎症反应的早期,调节Kir2.1通道的表达会影响EPCs的生物学功能,从而决定新生血管的成熟和稳定。并且研究人员推测Kir2.1通道可能是EPCs感知干细胞微环境的开关分子,以此确定其分化或转分化的方向,而Kir2.1可能成为血管重塑疾病新的治疗靶点。
源井生物是一家专注于细胞基因编辑的企业,可在全球范围内提供优质的基因编辑细胞、稳转细胞株、病毒包装等相关服务,以及近2000种KO细胞现货库,除此之外还有野生型细胞现货等。了解更多详情欢迎咨询我们!










