IF=18.9|源井KO细胞系助力HER2阳性肺癌治疗新策略开发

引言
肺癌是最致命的癌症之一,全球每年约有近160万例确诊病例,但患者的五年生存率不到15%。目前,治疗肺癌主要依赖放疗和化疗,尽管这些技术已经有了很大的进步,但患者的五年生存率仍然很低,并伴随着严重的不良反应。特别是CT药物可能会引起全身毒性反应。因此,为了实现药物精准输送至目标肿瘤组织,迫切需要一种新型的药物载体。
摘要
近日,美国得克萨斯大学阿灵顿分校和德克萨斯大学西南医学中心的研究人员在Bioactive
Materials杂志(IF=18.9)上发表了题为“Targeted chemotherapy via HER2-based chimeric antigen receptor (CAR)
engineered T-cell membrane coated polymeric nanoparticles”的研究论文。该研究采用了源井生物构建的敲除HER2基因的A549细胞系,开发了一种新型靶向HER2阳性肺癌细胞的抗癌药物递送策略,并验证了该策略的有效性和安全性。
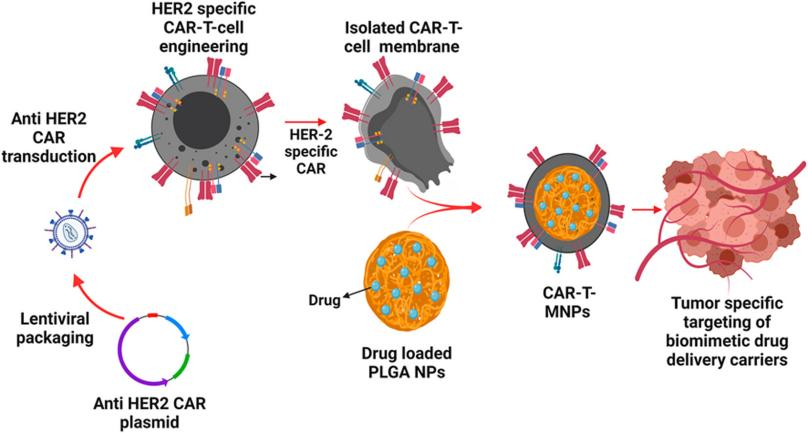
图1 靶向HER2阳性肺癌细胞的抗癌药物递送策略示意图
研究方法及结果
CAR-T-MNPs的理化表征
首先,作者成功构建了在细胞膜表面表达抗HER2 CAR-scFV的Jurkat T细胞,接着分离其细胞膜,将其覆盖在装载抗癌药物“顺铂”的药物载体PLGA纳米颗粒(nanoparticles,NPs),从而获得表面覆盖抗HER2 CAR-scFV的Jurkat T细胞膜且内部装载顺铂的纳米颗粒CAR-T-MNPs。对CAR-T-MNPs的理化特性进行测定,结果显示CAR-T-MNPs是平均直径为~195nm的球形,药物装载效率约为61%,可持续4天的药物释放。
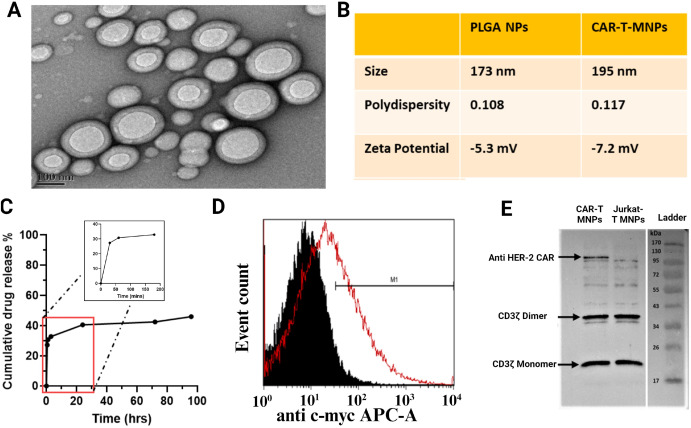
图2 CAR-T-MNPs的理化表征
CAR-T-MNPs的血液相容性和细胞相容性
考虑到体内材料的安全性和适用性,作者评估了CAR-T-MNPs的血液相容性和细胞相容性。结果表明,CAR-T-MNPs不会引起与血液凝固相关过程的任何显着改变。使用0至1000μg/mL浓度范围的CAR-T-MNPs处理AT1健康肺细胞48小时,发现在浓度≤250 μg/mL时表现出非常小的毒性。这表明CAR-T-MNPs在潜在医疗应用中具有安全性和适用性。
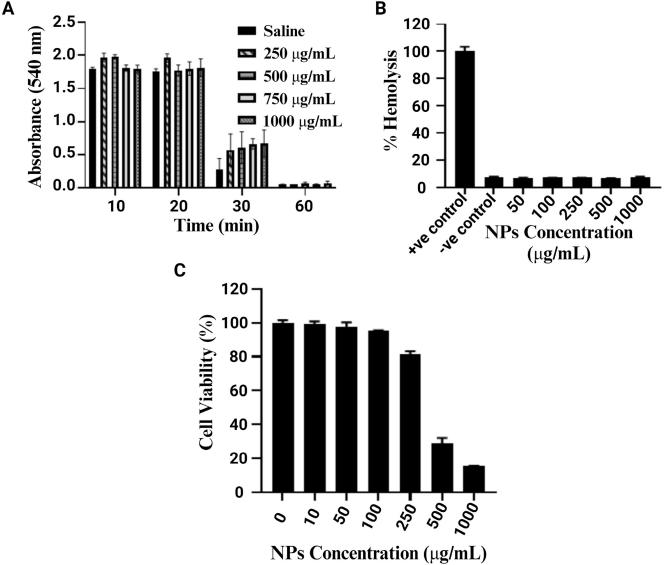
图3 CAR-T-MNPs在体外的血液和细胞相容性
CAR-T-MNPs体外细胞摄取和治疗效果
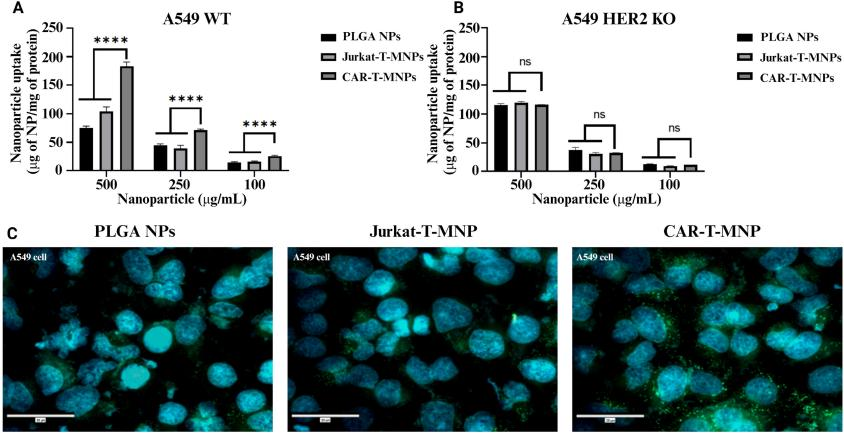
为了研究NPs的细胞摄取情况,将香豆素-6标记的CAR-T-MNPs与A549 WT细胞和A549 HER2 KO细胞(由源井构建)共同孵育,使用荧光显微镜进行观察。荧光显微镜图像表明,在A549
WT细胞中CAR-T-MNPs的摄取显著高于非靶向性的Jurkat-T-MNPs和PLGA纳米颗粒。而在A549
HER2
KO细胞中,CAR-T-MNPs、Jurkat-T-MNPs和PLGA纳米颗粒之间的摄取无显著差异。这一结果证明了CAR-T-MNPs的靶向性是基于HER2抗原的表达。
图4 不同NP组的细胞摄取情况
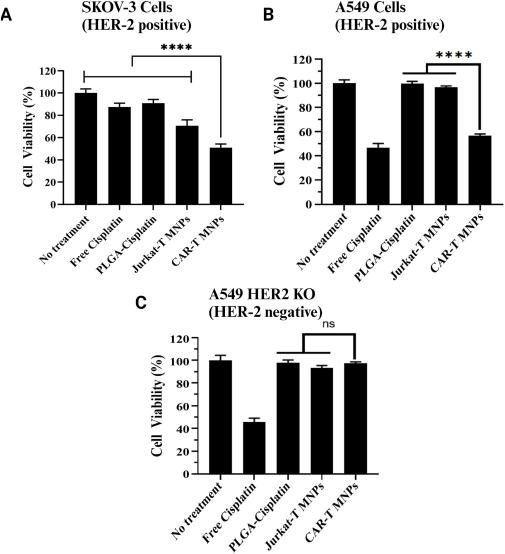
此外,作者还通过细胞活力MTS实验评价了CAR-T-MNPs对HER2阳性和阴性细胞系的癌症杀伤效果。在A549
WT和SKOV-3细胞系中,CAR-T-MNPs显示出了显著的抗癌效果,而在A549 HER2 KO细胞系中,CAR-T-MNPs的杀伤效果与Jurkat-T-MNPs相似,表明其抗癌效果与HER2抗原的表达密切相关。这些结果表明,CAR-T-MNPs作为一种靶向HER2阳性肺癌细胞的潜在治疗策略,可有效治疗肺癌。
图5 CAR-T-MNPs的体外癌症杀伤效果
CAR-T-MNPs的体内靶向性评价
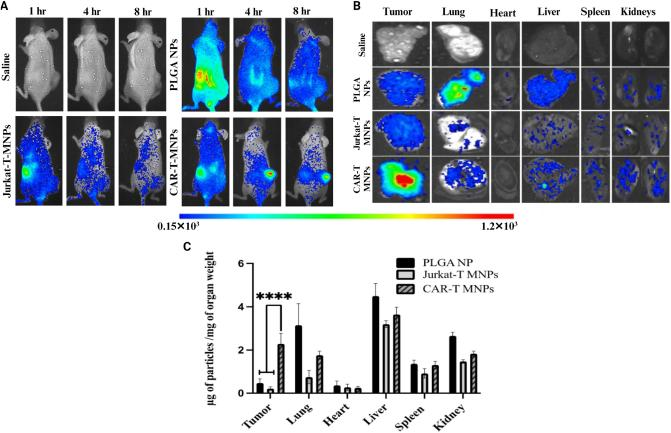
为了进一步确认CAR-T-MNPs是否能够有效地靶向且在肿瘤部位积聚,利用荧光成像技术监测了NPs在A549荷瘤小鼠模型体内的分布情况。结果显示,与Jurkat-T-MNPs和PLGA NPs组(分别为0.21和0.46 μg/mg)相比,CAR-T-MNPs(2.3 μg/mg)在肿瘤组织中的积累量明显更高,表明CAR-T-MNPs在肿瘤靶向和积累方面具有显着增强作用。
图6 体内靶向性评价
CAR-T-MNPs的体内治疗效果
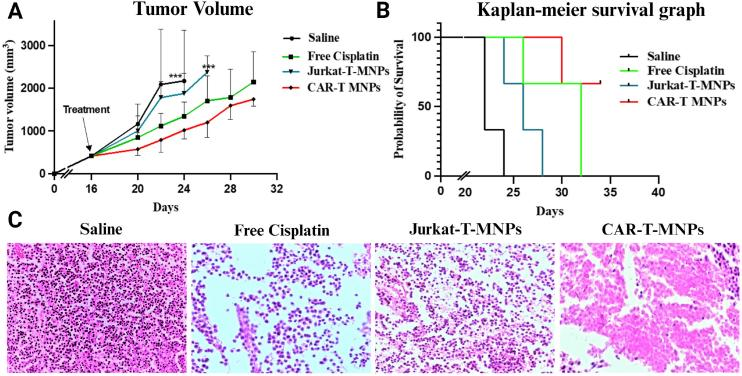
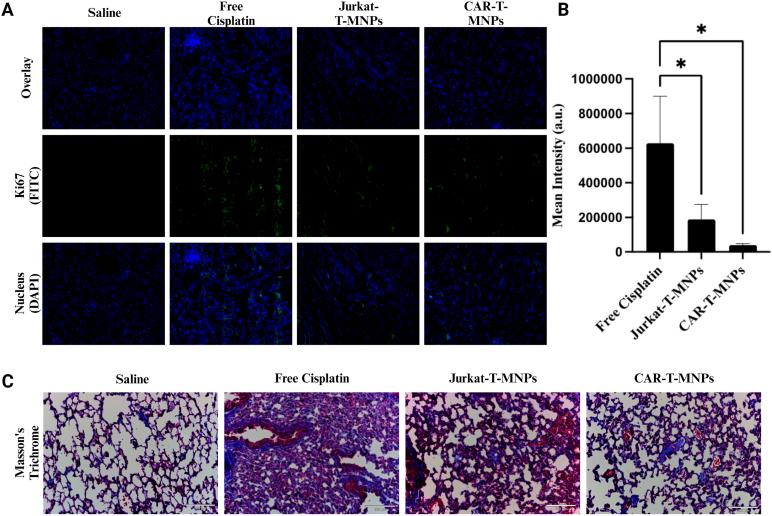
作者通过A549裸鼠移植瘤模型比较CAR-T-MNPs与Jurkat-T-MNPs、游离顺铂和生理盐水的抗肿瘤效果,治疗两周后,CAR-T-MNPs组的小鼠存活率显着更高,肿瘤生长明显减少。接着对治疗后的小鼠进行了组织学分析,以评估CAR-T-MNPs的潜在毒性。结果显示,CAR-T-MNPs治疗组的肿瘤细胞死亡显著增加,细胞排列松散,核溶解,细胞碎片增多。这些结果表明CAR-T-MNPs能够有效抑制肺癌肿瘤的生长,并提高小鼠的生存率。同样证实了CAR-T-MNPs作为肺癌治疗药物载体具有巨大潜力,尤其是在提高治疗效果和减少副作用方面。
图7 CAR-T-MNPs的体内治疗效果
结论
在本项研究中,作者成功开发了一种靶向HER2阳性肺癌的仿生NP平台,并通过体外和体内研究证实,CAR-T-MNPs具有主动靶向性、肿瘤积累性和治疗功效。因此,CAR工程的膜包被NP系统可能是一种很有前途的细胞模拟药物载体,可以改善肺癌治疗的效果。
参考文献
Yaman, Serkan, et al. "Targeted chemotherapy via HER2-based chimeric antigen receptor (CAR)
engineered T-cell membrane coated polymeric nanoparticles." Bioactive Materials 34 (2024): 422-435.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划