Nature|CRISPR文库前沿应用——脑癌研究


Nature | CRISPR文库前沿应用——脑癌研究

脑癌,尤其是胶质母细胞瘤(GBM),一直是医学领域的棘手难题。目前的靶向治疗和免疫疗法对患者生存率的改善效果有限,迫切需要新疗法。近日,通过高通量筛选发现Gliocidin这一化合物,可以为脑癌治疗带来了新的曙光。它能靶向杀死胶质母细胞瘤细胞,同时对正常细胞的毒性较低,且能穿透血脑屏障。这一研究成果有望为脑癌患者带来新希望,开启脑癌治疗新篇章。
在研究该化合物的作用机制时,作者选用了CRISPR文库锁定关键基因,为什么会选择这个方法而不是组学呢?带着问题,和小源一起来看看这个研究是如何进行的吧~
目录
研究方法
- 高通量筛选:研究者通过高通量筛选超过200,000种化合物,发现了Gliocidin。
- 基因组CRISPR-Cas9筛选:通过CRISPR-Cas9文库筛选,确定了Gliocidin作用的关键基因。
- 体内外实验:在体外细胞实验和体内动物模型中验证了Gliocidin的效果。
Gliocidin的发现与初步验证
研究人员前期进行了高通量化合物筛选,从已有化学库中鉴定出Gliocidin(N-(pyridin-3-yl)thiophene-2-carboxamide)。在细胞实验中,Gliocidin对原发性GBM细胞具有毒性(IC₅₀约为200nM),但对正常的小鼠胚胎成纤维细胞(MEF)无影响。
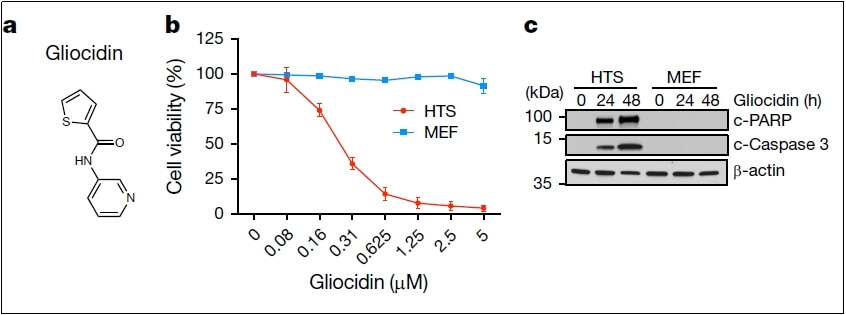
Gliocidin杀伤HTS(hGFAP-cre;Nf1–/–;Trp53–/–;Pten+/–)而不影响MEF细胞
CRISPR-Cas9文库筛选寻找靶点
转录组分析发现大量非特异性的基因表达变化,无法确定Gliocidin细胞内作用靶点。为深入研究Gliocidin靶点和机制,研究人员通过全基因组CRISPR–Cas9文库筛选的方法来寻找潜在靶点。
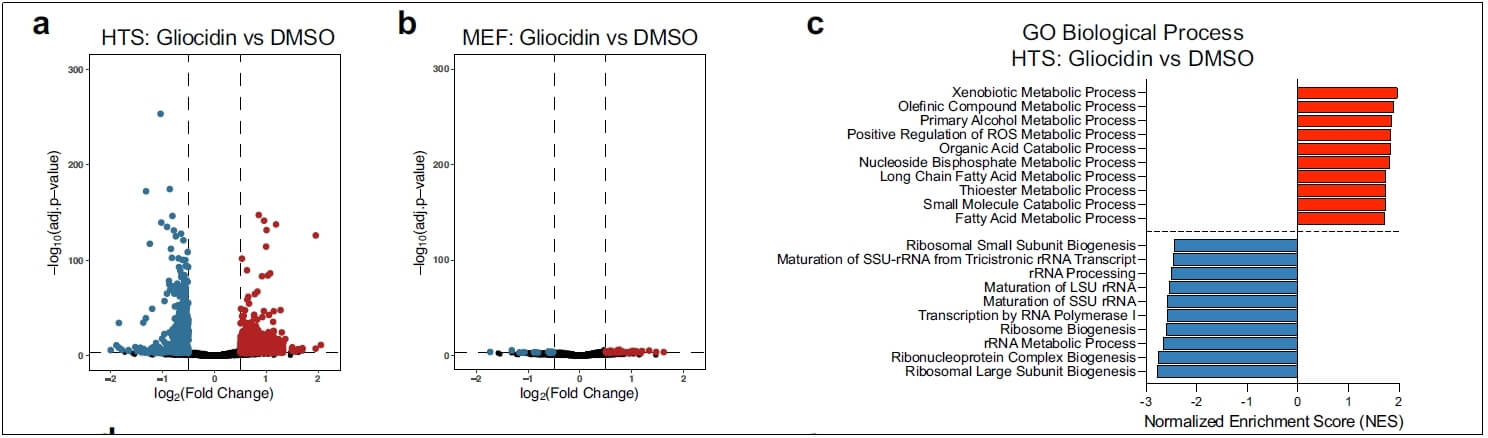
转录组学分析无法确定Gliocidin细胞内靶点
CRISPR文库筛选
CRISPR文库:小鼠全基因组CRISPR敲除文库(Brie)
转导细胞:NG2-3112细胞
筛选方式:构建全基因组文库敲除的NG2-3112细胞系。将NG2-3112文库细胞分为DMSO和不同浓度的gliocidin处理组(IC50和IC80),并在给药后第0天(收集了2.274×10^8个细胞)和14天收集细胞(7.7441×10^8个细胞),确保每组收集的细胞实现1000X覆盖率。提取基因组DNA,扩增sgRNA构建测序文库,然后使用IlluminaHiSeq平台进行测序。最后,使用MAGeCK-MLE软件包分析测序数据。
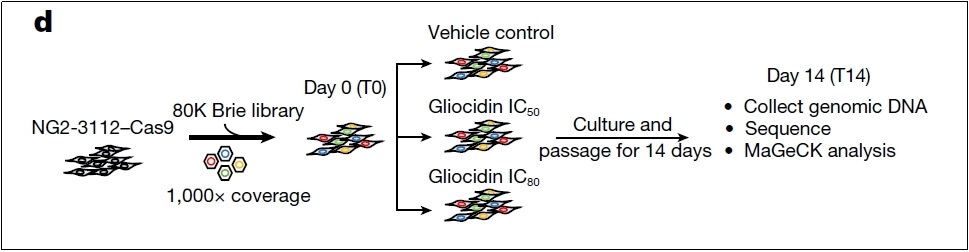
CRISPR-Cas9筛选策略
Gliocidin的作用机制探究
mTORC1的调节作用:通过CRISPR-Cas9筛选发现,Gliocidin处理后,mTORC1活性与对Gliocidin的抗性呈负相关,且与从头嘌呤合成(DNPS)途径酶的富集相关。敲除mTORC1的正调节因子或负调节因子分别导致肿瘤细胞对Gliocidin的敏感性一定程度的降低或增加,抑制mTORC1可减弱Gliocidin诱导的细胞死亡,表明mTORC1虽对Gliocidin有调节作用,但不是其直接靶点。
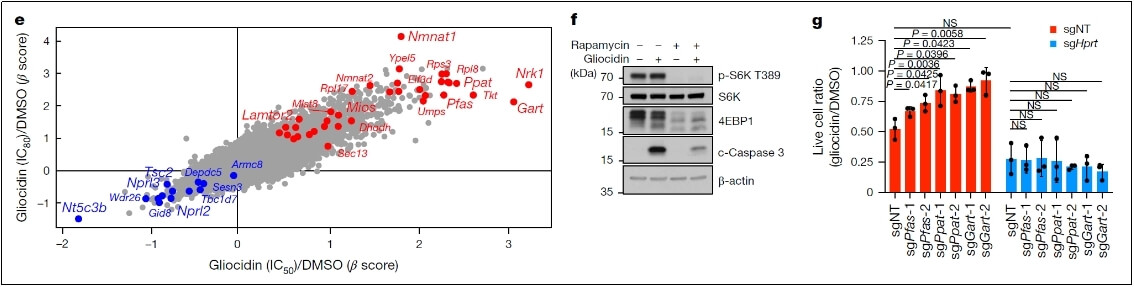
mTORC1活性与对Gliocidin的抗性呈负相关
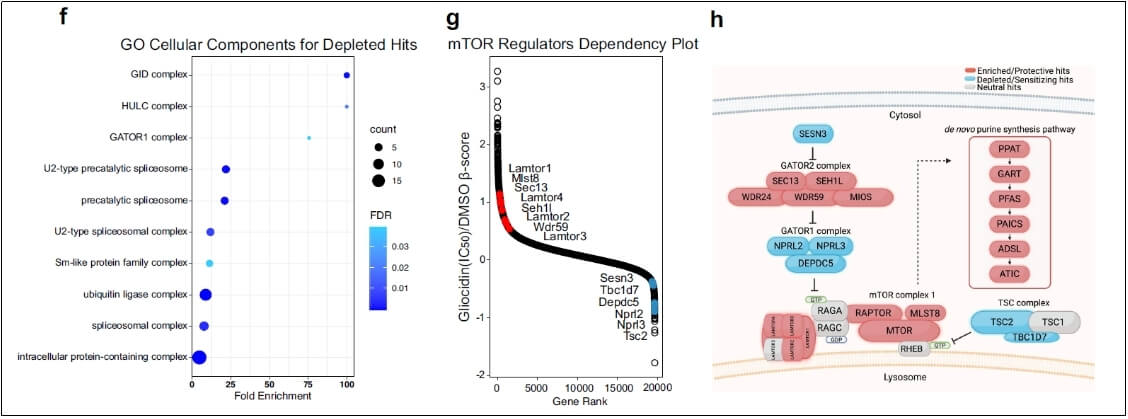
mTORC1活性与嘌呤从头合成(DNPS)途径酶正相关
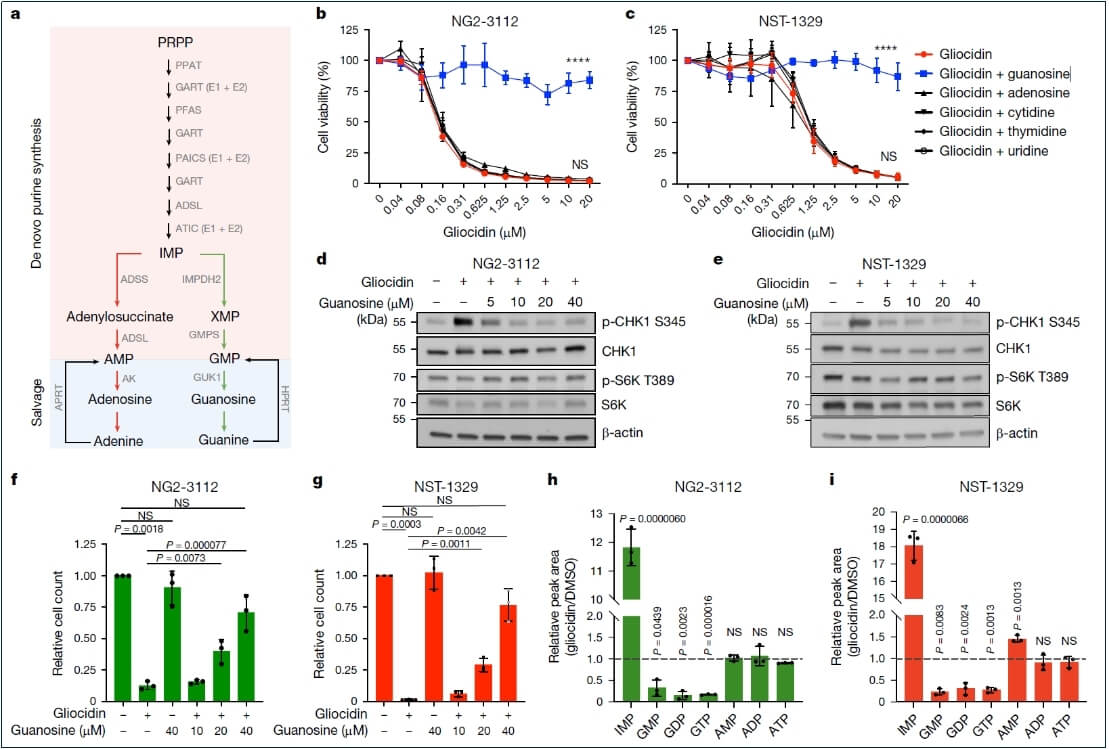
抑制从头鸟嘌呤合成:Gliocidin处理导致复制应激标记物磷酸化CHK1(p-CHK1)水平增加,而mTORC1活性标记物磷酸化S6激酶(p-S6)水平不受影响。补充鸟苷可挽救Gliocidin诱导的细胞死亡,并且这种挽救依赖于嘌呤补救途径。液相色谱-串联质谱(LC-MS/MS)分析表明,Gliocidin处理后,IMPDH2上游的IMP积累,其下游产物鸟嘌呤核苷酸GMP、GDP和GTP减少,表明Gliocidin可能阻碍从头鸟嘌呤核苷酸合成。
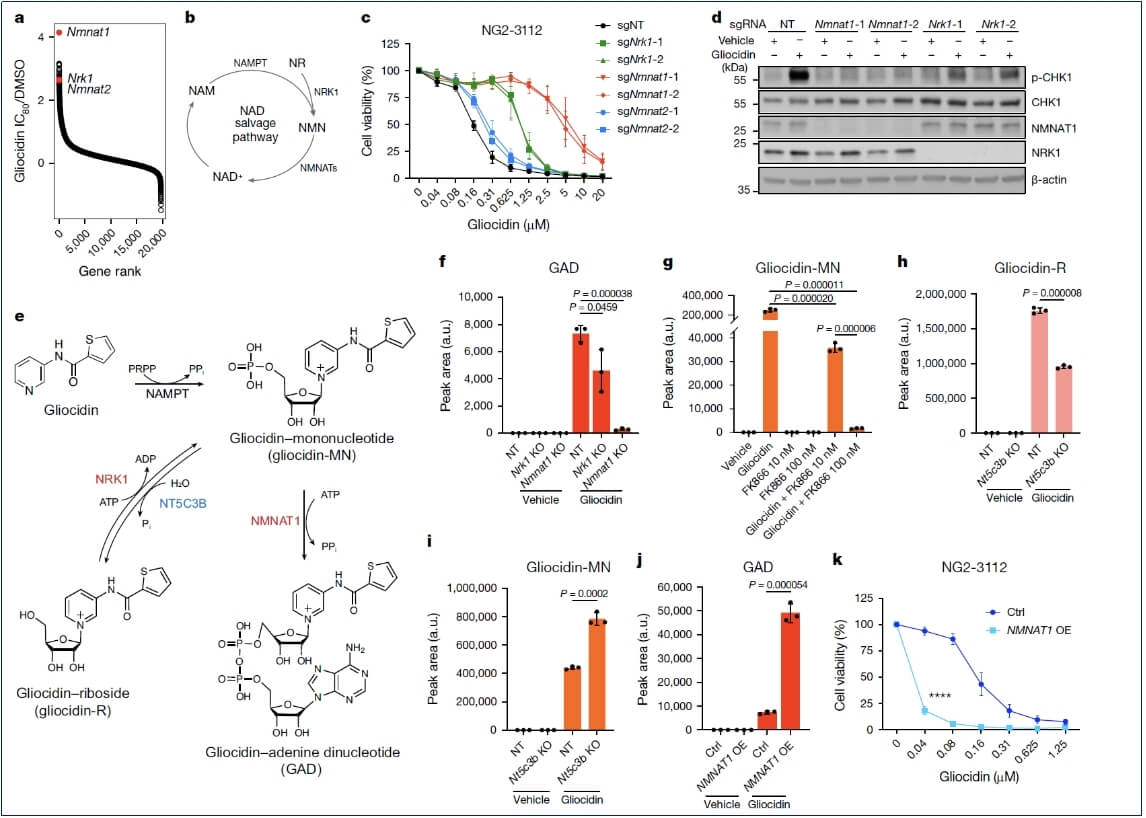
NAD⁺salvage途径的参与:CRISPR-Cas9筛选发现,Gliocidin处理细胞后,NAD⁺salvage途径中的基因在富集的sgRNA中排名较高。敲除Nmnat1或Nrk1可使细胞对Gliocidin产生抗性,降低Gliocidin诱导的复制应激、IMP积累和鸟嘌呤核苷酸耗竭。细胞内Gliocidin可转化为Gliocidin-单核苷酸(Gliocidin-MN)、Gliocidin-核糖苷(Gliocidin-R)和Gliocidin-腺嘌呤二核苷酸(GAD),其中GAD是活性代谢物,Nmnat1是其产生的限速酶。
GAD抑制IMPDH2的机制及Gliocidin的体内特性
GAD抑制IMPDH2的结构机制:GAD对IMPDH2具有抑制活性,而其他前体(Gliocidin、Gliocidin-R和Gliocidin-MN)无此活性。冷冻电镜结构显示,GAD与IMPDH2的NAD⁺结合口袋结合,阻止NAD⁺与IMPDH2结合,从而抑制IMP向XMP的转化。
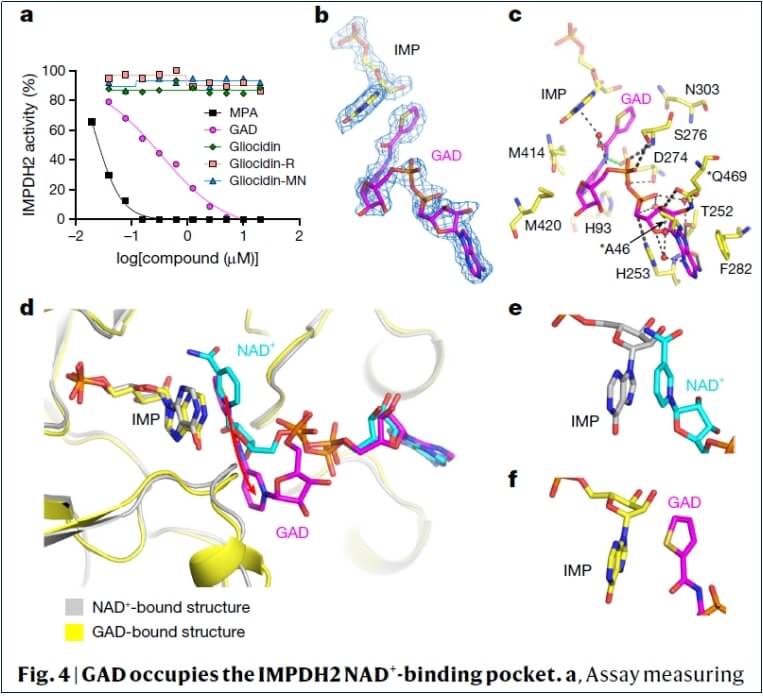 GAD与IMPDH2的NAD⁺结合口袋相结合
GAD与IMPDH2的NAD⁺结合口袋相结合
Gliocidin的体内药代动力学和毒性:Gliocidin具有较强的血脑屏障穿透能力(脑/血浆比=7.75),且在脑实质中的稳定性高于血浆和其他组织。毒性研究显示Gliocidin安全性良好。
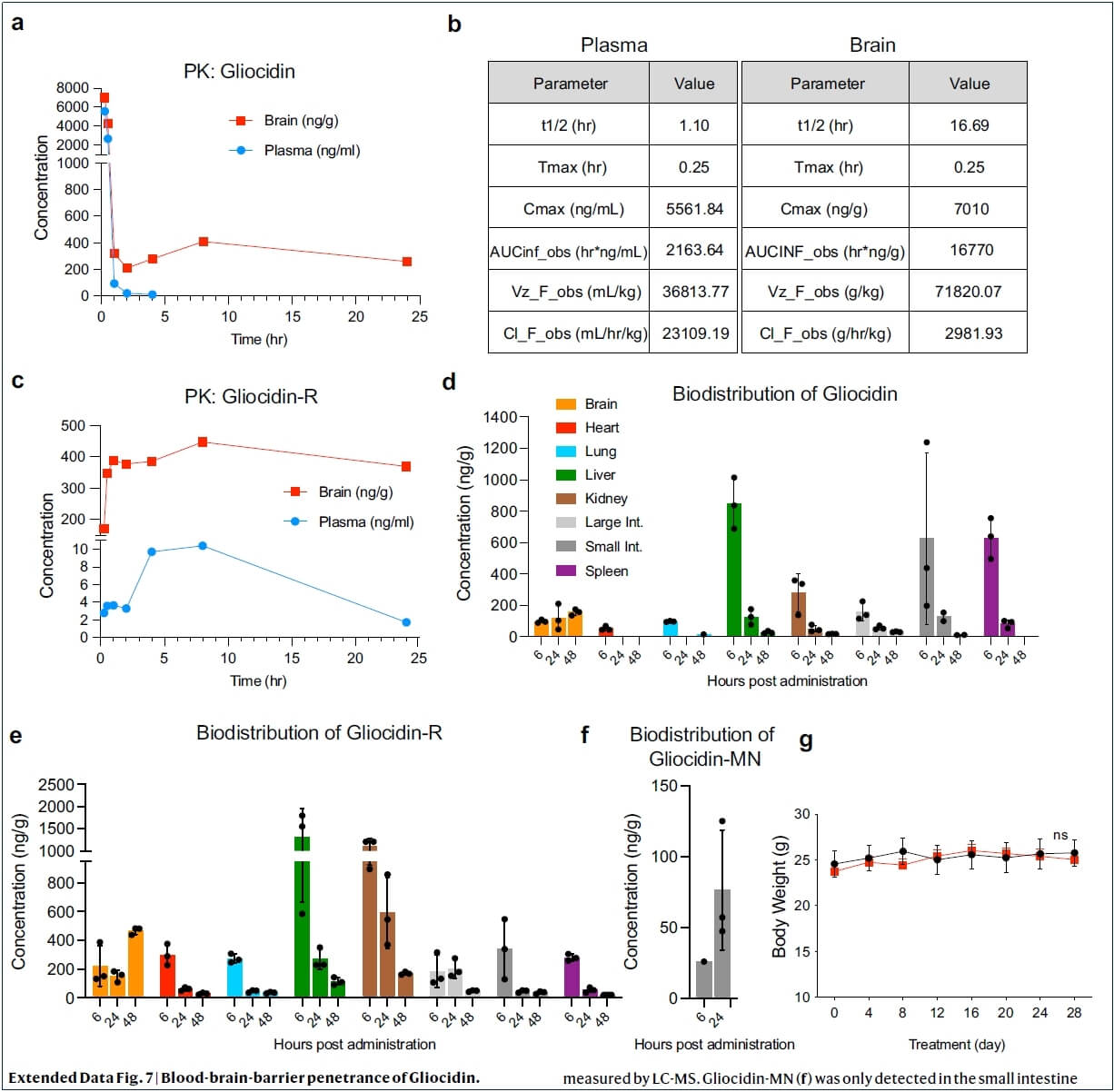
Gliocidin血脑屏障穿透能力强,毒性小
Gliocidin在体内抑制GBM的效果
单独使用Gliocidin:在免疫功能正常的原位GBM小鼠模型中,Gliocidin单药治疗可延长小鼠生存期。在无胸腺裸鼠的GBM模型中也观察到类似结果,表明T细胞缺失对Gliocidin的治疗效果影响较小。
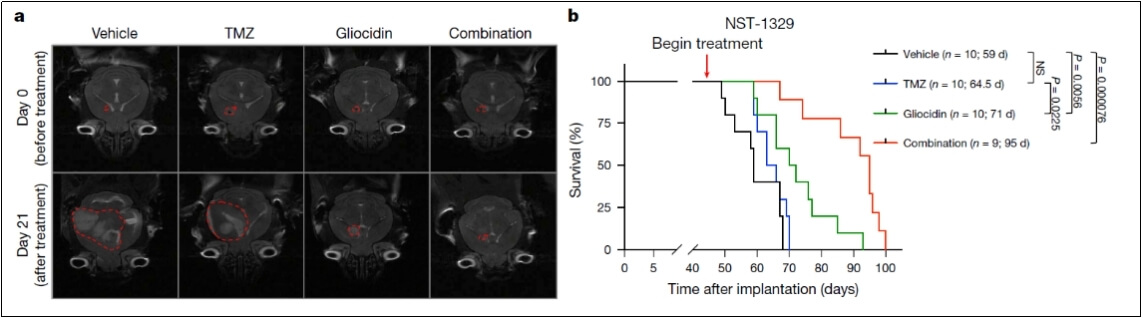
Gliocidin在GBM小鼠和裸鼠中效果类似
Gliocidin与替莫唑胺联合使用:在原位GBM小鼠模型中,Gliocidin与替莫唑胺联合治疗显著延长了小鼠的生存期,效果优于单独使用Gliocidin或替莫唑胺(图5a,b)。在患者来源的异种移植(PDX)GBM小鼠模型中,联合治疗也能延长生存期,且单细胞RNA测序分析表明,可减少肿瘤细胞毒性,改善生存。
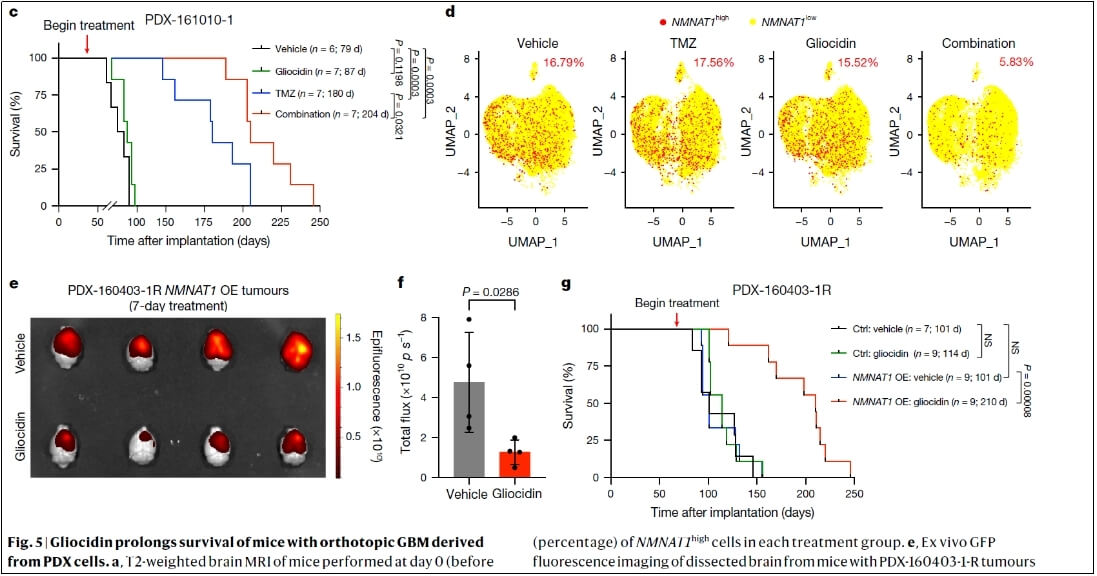
Gliocidin与替莫唑胺联合用药效果更强
总结与展望
Gliocidin作为一种新型的潜在治疗脑肿瘤的化合物,具有诸多优势,如良好的血脑屏障穿透性、较高的脑实质稳定性以及较低的毒性。其通过复杂的细胞内途径发挥作用,最终导致胶质瘤细胞因鸟苷酸耗竭而死亡。NMNAT酶在Gliocidin的抗肿瘤活性中起着关键作用,这提示高表达Nmnat1或Nmnat2的肿瘤可能对Gliocidin治疗更敏感,同时也为联合使用诱导Nmnat表达的药物(如替莫唑胺)提供了理论依据。此外,Gliocidin与免疫疗法的联合应用也具有潜在的研究价值。未来的研究需要进一步探索Gliocidin的耐药机制以及其在其他脑恶性肿瘤中的活性,为脑癌治疗带来更多突破。
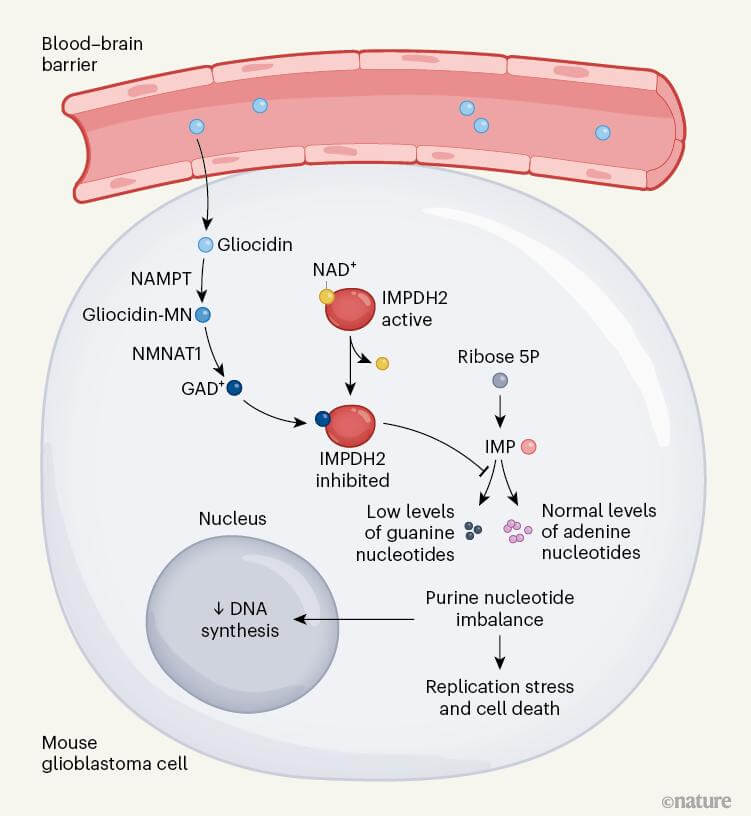
Gliocidin在胶质母细胞瘤(GBM)细胞作用机制
CRISPR文库筛选服务快至8周筛到新靶点!还拥有400+CRISPR文库现货产品(质粒、病毒、Cell Pool),欢迎咨询~










