CRISPR/Cas9系统究竟对RKO细胞做了什么?
RKO细胞是由 Michael Brattain 开发的一个低分化的结肠癌细胞系,它含有野生型P53,但缺乏人甲状腺受体核受体(h-TR beta 1)。RKO细胞系是RKO-E6和RKO-AS45-1的亲本细胞系,它的P53蛋白水平高于RKO-E6细胞。 该细胞系可以在裸鼠中成瘤,也可在软琼脂中形成集落。目前RKO细胞不仅被广泛应用于分子、细胞生物学和生物医学基础研究,如蛋白质组学、基因组学、细胞系研究、DNA,RNA和遗传学研究等,还可应用于当今热门的生物医药产业如药物筛选、药物代谢和毒理研究、癌症药物的研究等,具有十分广阔的市场前景。源井生物提供、活力强、状态好的野生型RKO细胞,并能适用于各类基因编辑实验,便于构建各类RKO细胞模型,如基因敲除、敲入、点突变或稳转细胞株的构建。
具体应用
1. 用于癌症研究,可以验证由细胞株研究获得的结果;
2. 预测个体样本的反应和排斥性,从而选择最有效的抗癌药物;
3. 筛选最具选择性或毒性的新药化合物;
4. 作为识别靶标进行抗肿瘤药物筛选与模型建立等。
CRISPR/Cas9技术在RKO细胞中的应用
CRISPR/Cas9系统正在改变许多生物医学研究前景,包括癌症研究。通过灵活的可编程性和诱导DNA双链断裂,实现了在体外或体内将癌症突变引入细胞。然而,并非所有突变对肿瘤的发生都有同样的作用,区分肿瘤生长和存活的基本突变和生物惰性突变是很麻烦的。Sayed等人提出了一种在RKO细胞中筛选高通量突变的功能相关性的方法。他们利用CRISPR/Cas9系统探测结直肠癌细胞系中的癌症脆弱性, 使用正筛或负筛从整个集合群体中分离具有特定表型变化的细胞,来尝试识别新的癌症驱动突变。他们设计了100个高质量的sgRNAs,这些sgRNAs能够特异性切割RKO细胞中存在的突变。然后生成一个包含这些sgRNAs的多功能慢病毒文库,并用于联合筛选,以探测这些突变可能的生长条件。收集不同时间点的基因组DNA,PCR扩增、纯化sgRNA,并通过深度测序定量sgRNA计数。分析结果显示,在RKO细胞中,两个靶向相同突变的sgRNAs(UTP14A:S99delS)将随着时间的推移而耗尽(图1A)。实验结果证实,该突变的失活损害了细胞生长,因此Sayed等人认为UTP14A:S99delS是RKO细胞中的驱动突变(图1B)。上述的研究结果表明利用CRISPR/Cas9系统能实现在功能上大规模分离癌症突变,这显然对未来癌症的研究和治疗提供了有效的帮助[2]。源井生物已以CRISPR/Cas9技术为基础研发了独家CRISPR-U™技术专利,CRISPR-U™技术具有更高效的基因切割效率,能提高至少10倍的基因编辑效率。目前源井生物向全球提供CRISPR-U™技术服务,包括基因敲除/点突变/敲入细胞株、基因编辑载体构建、稳转细胞株等等。
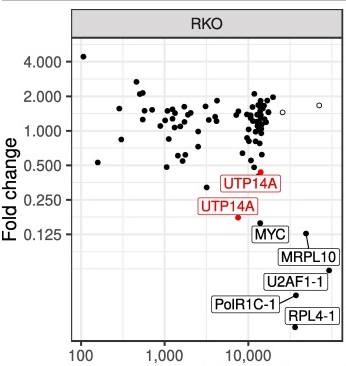
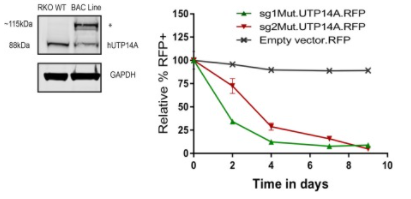
A B
图1
RKO细胞中基因编辑的具体案例
RKO 细胞中DIP2C 的缺失在研究人类癌症中的作用
Disco-Interacting Protein 2 Homolog C (DIP2C),是一种在人体组织和成人肿瘤中高水平表达的非特征基因,在外显子组范围内的激素突变分析中被确定为推定的癌症基因。为了研究DIP2C失活在人类癌症中的作用并确定受该基因活性影响的过程,Larsson等人利用CRISPR/Cas9技术构建了人类DIP2C敲除RKO细胞系。结果显示,RKO 细胞中DIP2C 的敲除会导致细胞增大和生长迟缓。并且Larsson等人揭示了表达水平会受到DIP2C缺失影响的780 个基因,包括编码CDKN2A基因的肿瘤抑制基因、编码上皮间充质转化(EMT)调节因子的ZEB1以及编码乳腺癌干细胞的CD44和CD24等等。DNA 甲基化分析显示超过30,000个基因位点受差异甲基化影响,其中大部分在DIP2C缺失后发生低甲基化。,而启动子区域 DNA 甲基化的变化与基因表达的变化密切相关。DIP2C敲除后的RKO细胞具有更高的创伤闭合容量,所以DIP2C的缺失将会触发癌细胞中大量的DNA甲基化和基因表达变化、细胞衰老和上皮-间质转化[1]。
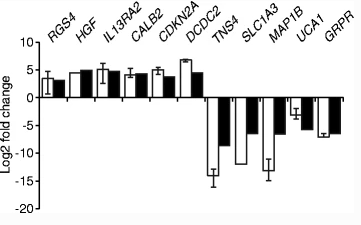
图 2 DIP2C的缺失导致基因表达的改变
筛选最具耐药性的因子,推进抑制剂的研发进程
坏死的细胞死亡途径是人类病原体防御的一个关键组成部分,在组织稳态过程中可以被异常抑制,从而导致多种类型的组织损伤和疾病。虽然含有RIPK1、RIPK3和MLKL的坏死体激酶信号复合物的形成机制已被熟知,但其调控和效应功能的其他机制仍然有待发现。Callow等人通过CRISPR/Cas9进行了全基因敲除筛选了19,883个小鼠蛋白编码基因,并且通过大规模转导 RKO 细胞获得的 sgRNA 参考文库,筛选出对细胞坏死具有耐药性的因子,然后鉴定了112个坏死调控因子和介质,包括59个新的候选通路成分,发现在没有坏死诱导的情况下细胞生长基本不会受到任何影响。他们还进一步表明了一些组织特异性或应激反应途径可能会通过调节RIPK1来防止受调控的细胞死亡。上述研究结果表明,对RIPK1功能的进一步探索对于推进了新的治疗干预策略或临床抑制剂的开发
[3]具有重要作用。
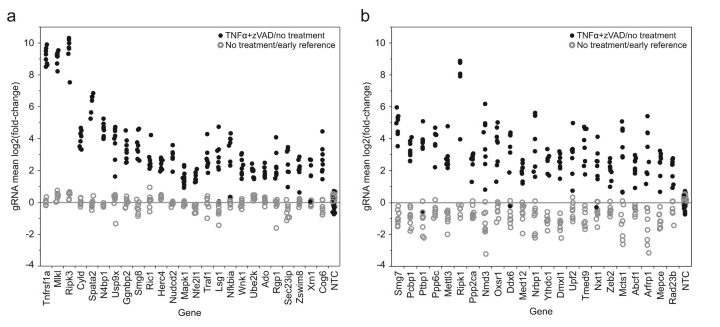
图3 耐药性因子筛选
全基因组敲除后的RKO 细胞对于放疗CRC提供了至关重要的帮助
结直肠癌 (CRC) 在最常诊断的癌症中排名前三,并且是全球癌症相关死亡的主要原因之一。除了手术切除和化疗,放疗的佐剂也起着关键作用,可以延长患者的生存率。然而在放疗过程中约有50%的患者会对放疗佐剂产生耐药性,从而导致疗效不理想、复发和转移。因此,确定放射抗性的潜在机制,可以改善结直肠癌患者的治疗结果。Yu等人通过在RKO结直肠癌细胞系进行基因组规模的CRISPR 敲除筛选,并结合 NGS 测序,以探索涉及结直肠癌放射抗性的调节因素,最终得到了3个候选基因。他们发现microRNA-5197-5p(miR-5197)可以显著增强IR对RKO的细胞毒性。Yu等人通过进一步的机制研究,证明了miR-5197 直接靶向 CDK6 并抑制其在 RKO 细胞中的表达,可以诱导细胞周期停滞在 G1/S 期并抑制细胞分裂,因此,miR-5197 增强了放射敏感性。研究结果表明,miR-5197 可能是调节 CRC 细胞放射敏感性的关键因素,并为开发对 IR 具有抗性的 CRC 患者的治疗策略提供了帮助[4]。
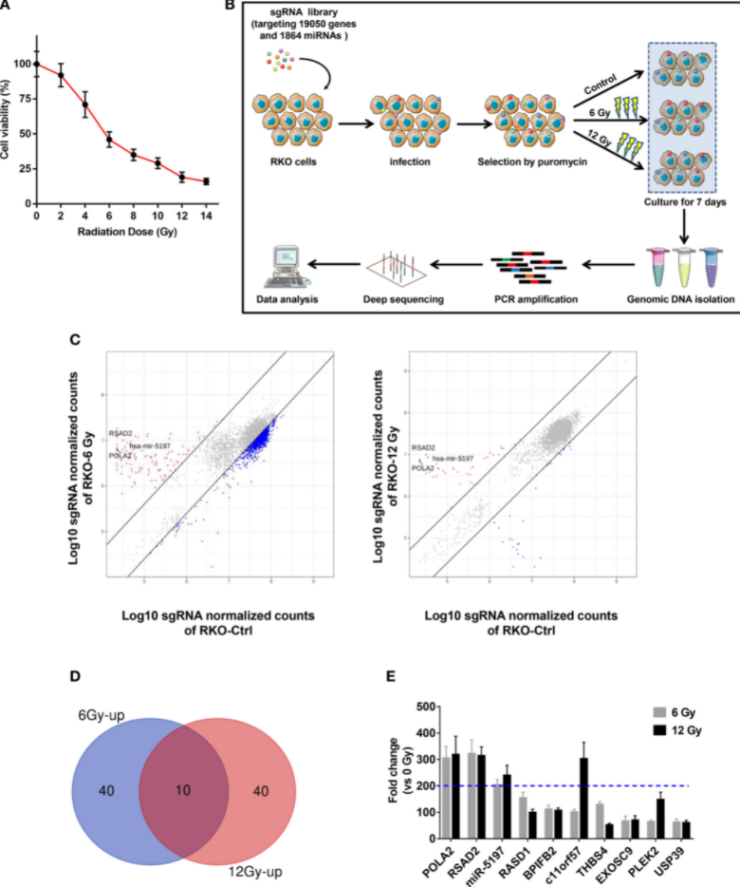
图 4 通过全基因组 CRISPR 敲除筛选鉴定与 CRC 放射抗性相关的候选基因
源井生物目前已凭借CRISPR-U™技术专利自身更高效的切割效率成功在包括RKO细胞的超200多种细胞中成功建立了各类细胞模型,并成功敲除了超5000种基因,为全球不同地区的科研人员提供了一定的帮助。现在源井生物的细胞基因编辑服务正在进行活动大促,价格优惠,欢迎在线咨询!
参考文献
[1] Larsson, Chatarina, et al. "Loss of DIP2C in RKO cells stimulates changes in DNA methylation and epithelial-mesenchymal transition." BMC cancer 17.1 (2017): 1-12.
[2] Sayed, Shady, et al. "CRISPR/Cas9 as a tool to dissect cancer mutations." Methods 164 (2019): 36-48.
[3] Callow, Marinella G., et al. "CRISPR whole-genome screening identifies new necroptosis regulators and RIPK1 alternative splicing." Cell death & disease 9.3 (2018): 1-13.
[4] Yu, Shijun, et al. "A Genome-Scale CRISPR Knock-Out Screen Identifies MicroRNA-5197-5p as a Promising Radiosensitive Biomarker in Colorectal Cancer." Frontiers in Oncology (2021): 3050.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划




























 联系电话
联系电话
 投诉电话
投诉电话
