挖掘乳腺癌发病机制,从ARID家族基因入手


据2018年全球癌症统计,乳腺癌已经成为继肺癌之后,全球癌症发病率和死亡率第二的癌症类型[1],是女性中最常见的癌症诊断和癌症死亡的主要原因。亚洲约有世界60%的人口,全球超过一半的癌症死亡发生在亚洲,亚洲已经成为癌症发病率的高风险区。癌症的发生受遗传因素和环境因素综合影响,乳腺癌是一种异质性疾病,发病机制尚未清楚,随着医疗保健成本上升和新的靶向治疗引入,生物标记的使用已经成为一种辅助乳腺癌治疗期间和治疗后疾病监测的方法[2]。基于乳腺癌的信号通路和代谢成分可以被靶向的特点,Oncotype DX、Mamm aPrint和uPA等[2-4]相关生物标记物逐渐受到关注,可以靶向细胞表面的特定肿瘤抗原。AT-rich interaction domain (ARID)家族是一类SWI/SNF染色质重塑复合物的基因家族,其家族成员基因具有调节转录的能力,参与细胞的分化和增殖[5],本期介绍ARID的家族成员作为生物标志物在乳腺癌免疫调节中的潜在作用。
编码SWI/SNF复合体的基因突变在癌症中普遍存在,ARID1A基因是该复合体中最常见的突变成员,其突变已被证实与肿瘤发生有关,ARID1A失活突变在晚期乳腺癌中出现频率很高,其改变会导致细胞功能丧失,CRISPR-Cas9基因敲除会将ARID1A确定为首选基因,该基因参与控制PI3K/AKT/mTOR通路、癌症的免疫反应、EZH2甲基转移酶活性、类固醇受体调节、DNA损伤检查点以及p53靶点和KRAS信号的调控。
根据内部靶向外显子组测序平台(MSK-IMPACT)、乳腺癌国际联盟的癌症基因组图谱(TCGA)、分子分类数据集的分析,首次证实ARID1A是雌激素受体阳性(ER)乳腺癌中SWI/SNF复合体中最常突变的基因。此外,与原发肿瘤相比,ARID1A是转移瘤中更常见的基因突变的基因(图1a)。在MCF7乳腺癌细胞中使用sgRNA文库进行了CRISPR-Cas9的KO筛选,该文库针对用氟维司群处理的细胞中的人类表观基因组(图1b)。12个靶向ARID1A的不同sgRNA中,有10个在暴露环境中富维菌集量最高的3% sgRNA中,因此ARID1A是筛选中最主要的候选sgRNA,其损失会导致富维菌耐药性(图1c)。由于ARID1A是CRISPR筛选的首选候选基因,并且ARID1A失活突变在晚期内分泌耐药ER乳腺癌中富集,所以将研究重点放在ARID1A的作用上。为了验证这些发现,使用四种不同的引导gRNAs在整个MCF7细胞群中完全敲除了ARID1A(图1d)。ARID1A的敲除对ER蛋白或SWI/SNF复合物BRG1的催化亚基的表达水平没有影响(图1d)。
然而,体外细胞增殖实验和结晶紫实验显示ARID1A敲除后氟维司群治疗后细胞生长增加(图1e)。此外,与对照细胞相比,在缺乏雌激素的条件下,MCF7细胞中ARID1A缺失导致细胞增殖增加,在体内环境下,原位异种移植的ARID1A敲除MCF7细胞在富维司坦处理下表现出比对照细胞的生长优势(图1f)。与对照细胞相比,ARID1A敲除肿瘤表现出稳定的疾病,氟维司群治疗6个月后肿瘤根除(图1f)。MDA-MB-415乳腺癌细胞中的ARID1A KO(图1g)也导致对氟维司群的耐药性(图1h);通过来自1756名乳腺癌患者的1918个肿瘤的临床-基因组分析显示与野生型(WT)肿瘤相比,具有ARID1A改变的肿瘤患者在SERDs上的无进展生存期明显较短,中位无进展生存期为2.8个月对5.7个月(图1i)。若您想以ARID1A基因为生物标志物,从事与乳腺癌相关的课题研究,源井生物具有相关实验成功案例,让您的实验少走弯路,省时省力,高效科研!
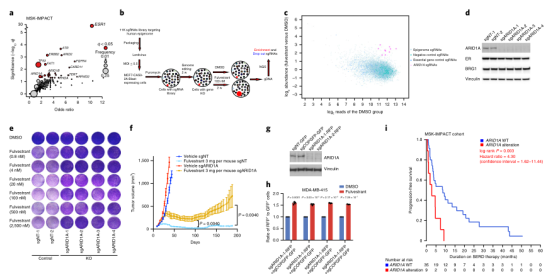
图1 ARID1A缺失介导内分泌的耐药性
一些体外研究表明,ARID1B促进细胞增殖,与ARID1A的肿瘤发生中的作用相反。在本研究中,利用乳腺癌组织微阵列(TMAs)确定了ARID1B表达与临床病理参数的关系。ARID1B染色只在正常和癌性乳腺组织的细胞核中检测到。ARID1B在细胞核内不同强度的染色如图2A-C所示。阴性对照组未见染色(图1D)。考虑免疫阳性细胞百分比和染色强度,采用IRS法测定ARID1B的免疫组化表达水平。以IRS中位数125为分界点,将ARID1B免疫染色分为高组和低组。值得注意的是,ARID1B在荷瘤组织中的表达水平明显高于邻近的非肿瘤组织(图3, P = 0.0018)。表明ARID1B免疫组化染色可以作为肿瘤分级的独立预测因子。值得注意的是,与非三阴性亚型相比,在乳腺癌的ER(-)/PR(-)/ HER-2(-)免疫表型中检测到ARID1B表达增加的频率较高,这表明ARID1B可能参与了侵袭性和高侵袭性三阴性乳腺癌的发展。研究了ARID1B表达水平与5年无病生存期之间的相关性。156例患者中,27例5年内复发。在复发组中,ARID1B高表达或低表达(由IRS确定)的患者的中位无病生存期分别为19.53个月或37.00个月(图4)。
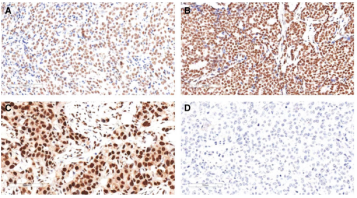
图2 乳腺癌组织中ARID1B的免疫组化染色
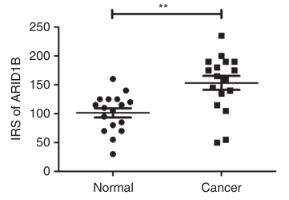
图3正常组织与乳腺癌组织ARID1B表达水平比较
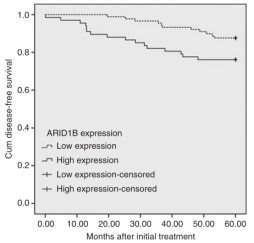
图4 ARID1B表达与患者5年无病生存的关系
为了阐明ARID1B在乳腺癌组织中高表达的分子机制,研究了ARID1B抑制对细胞增殖的影响,结果显示抑制ARID1B会导致细胞增殖显著下降(图5B)。由于ARID1B活性的中断被证明可以延迟人成纤维细胞G1-S期的细胞周期进展,细胞周期分析显示,与对照组相比,ARID1B活性降低的细胞中G1期细胞明显增多,S期细胞减少(图6A, B)。这一发现促使我们研究参与G1/S细胞周期转变的周期蛋白和CDKs的表达。与对照细胞相比,Arid1bdeficient细胞中cyclin D1和cdk6的mRNA水平分别下降了30%和15%以上(图6C),这表明ARID1B通过调节细胞周期的调节因子(如cyclin和CDKs)的表达来促进G1-S细胞周期进程。
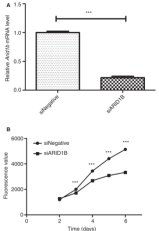
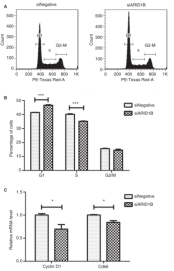
图5 ARID1B抑制细胞增殖的作用 图6 ARID1B抑制对细胞周期的影响
因此,研究表明ARID1B的高表达可能有助于乳腺癌的发病机制,并可能作为一种有前景的预后生物标志物。并作为治疗乳腺癌的有用靶点,公司可实现对ARID1B基因的编辑,助力您的肿瘤研究!
ARID家族的成员ARID3B是一种进化保守的转录因子,与细胞永生化、上皮-间充质转化(EMT)和肿瘤发生有关。鉴于ARID3B在肿瘤发展中的新作用,检测了它在原发性患者来源的乳腺癌样本和细胞系中的表达。原发性乳腺浸润性肿瘤均检测到细胞核、细胞质和低水平膜性ARID3B染色(图7)。ARID3B核染色与患者雌激素受体(ER)状态呈正相关,与肿瘤分级、有丝分裂指数及ERBB2状态呈负相关。ARID3B的核表达在表达ER乳腺癌细胞系中得到证实。从正常乳腺癌和乳腺癌源性细胞系中分离总RNA,合成cDNA,设计异构体特异性引物,并进行RT-qPCR。这些亚型特异性引物扩增并证实了在正常乳腺细胞(MCF10A, 永生化的非致瘤性乳腺细胞系)和两种乳腺癌源性细胞系(MCF7和MDA-MB-231)中存在4316、2365和654 bp长的亚型(图8)。
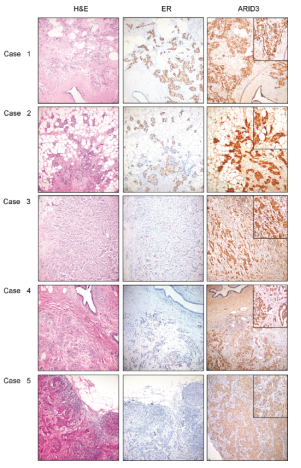
图7 IHC检测ER和 ARID3B表达
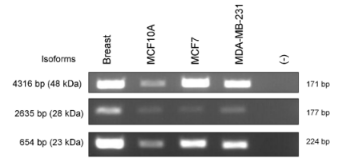
图8 ARID3B亚型在正常乳腺组织和乳腺癌细胞系中的表达
该研究报道了原发性乳腺癌中ER阳性与核ARID3B表达呈正相关,与ERBB2状态呈负相关。在乳腺癌细胞系中也发现了非常相似的相关性。最近ARID3B的表达越来越多地与癌症相关蛋白和microRNAs相关,关于ARID3B基因表达和功能的相关知识有助于进一步了解潜在的乳腺癌发病机制相关网络,我们公司提供CRISPR-Cas9基因敲除服务,可为您定制在乳腺癌细胞中编辑ARID3B基因服务,探究ARID3B在乳腺癌细胞中的作用机理。
在癌症进化过程中,原发肿瘤与转移肿瘤之间基因的变化直接影响临床治疗效果和疾病研究进展,开发和研究针对新发现的驱动畸变的靶向药物,指导转移性乳腺癌的个体化治疗,是非常重要和迫切的。ARID家族成员参与癌症相关信号通路,在肿瘤组织中高度突变或差异表达,可作为癌症预后或治疗结果的预测因子。在癌症中所起作用的分子生物学和临床研究。这可能有助于我们从一个新的角度理解癌症的发生和发展,并为癌症治疗提供潜在的靶点。
ARID家族基因KO现货细胞系等你来选购!3500+KO现货细胞库,200+细胞经验,5000+成功经验加持,覆盖肿瘤癌症为主的27种疾病类型、26条信号通路、5大类药物靶点,低至8000元。
更有细胞ko定制服务,HEK293/Hela/HCT 116/A549细胞4周即可交付纯合克隆,缩短您的实验进程!
参考文献
[1]Bray F, Ferlay J, Soerjomataram I et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA: Cancer J Clin (2018)68: 394-424
[2]Barzaman K, Karami J, Zarei Z et al. Breast cancer: Biology, biomarkers, and treatments[J]. International Immunopharmacology. (2020)84: 106535
[3]Syed YY.Oncotype DX Breast Recurrence Score®: A Review of its Use in Early-Stage Breast Cancer[J]. Molecular Diagnosis & Therapy. 24(5): 621-632
[4]Duffy MJ, McGowan PM, Harbeck N et al. uPA and PAI-1 as biomarkers in breast cancer: validated for clinical use in level-of-evidence-1 studies[J]. Breast Cancer. (2014)16:428
[5]Li C, Song W, BiXY et al. Recent advances in the ARiD family: focusing on roles in human cancer[J]. OncoTargets and Therapy. (2014)7: 315-324
[6]Xu GT, Chhangawala S, Cocco E et al. ARID1A determines luminal identity and therapeutic response in estrogen-receptor-positive breast cancer[J]. Nature Genetics. (2020)52: 198-207
[7]Shao F, Guo TT, Chua PJ et al. Clinicopathological significance of ARID1B in breast invasive ductal carcinoma[J]. Histopathology. (2015)67: 709-718
[8]Erdogan ASO, Ozdemirler N, Oyken M et al. ARID3B expression in primary breast cancers and breast cancer-derived cell lines[J]. Cell Oncol. (2014)37: 289-296










