肺癌靶点研究渐露锋芒,源井生物基因编辑细胞助力肿瘤研究

肺癌靶标热点追击,ERRα/LTK/EMSY初露锋芒

癌症一直是我国最为严重的公共卫生事件,同时也影响个人的正常生活和工作。由于统计的滞后性,在2016年统计数据中(图1所示),406万癌症病人中发生病例最多的是肺癌,达到 82.8万人[1]。肺癌目前是全世界癌症死因的第一名,且每年人数都在上升,因此肺癌是医学领域研究的重点对象,靶向治疗成为临床研究一项不可或缺的技术手段,随着靶点精准治疗研究的不断推进,肺癌逐渐成为临床可控的疾病,相比化疗时代,延长了晚期患者的生存时间。依据EGFR、ALK、ROS1等靶点的特点,相关药物已被生产出来并应用到临床治疗中,但由于靶向治疗费用高昂,让许多患者望而却步,因此能否发现并应用更多的靶位点成为关键问题,这一期介绍2022年肺癌研究中3个新的热门靶点。雌激素相关受体α(estrogen-related receptor α, ERRα),白细胞受体酪氨酸激酶( leukocyte tyrosine kinase,LTK)和EMSY转录抑制因子(EMSY transcriptional repressor,EMSY)。
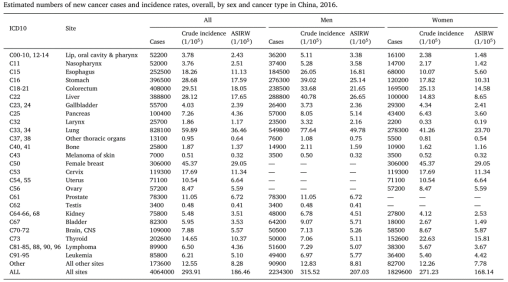
图1. 2016年我国国内肿瘤发生病例[1]
雌激素相关受体α(estrogen-related receptor α, ERRα)
雌激素相关受体(estrogen-related receptors, ERRs)家族有三个亚型α、β和γ,该类蛋白属于孤核受体大家族一员,它们参与肌肉分化,骨骼再生、免疫系统调控、基因调控和能量代谢等等[2]。最早的ERRs是在cDNA文库筛选中,根据人类雌激素受体α(estrogen receptor α, ERα)的DNA结合域序列的相似性来筛选出的类固醇受体[3]。ERRs的基本结构(图2A所示),包括一个激活功能结构域1(AF1),一个DNA结合域(DBD)、一个配体结合结构域(LBD)和一个激活功能结构域2结构域(AF2)。ERRs的三个亚型α、β和γ的4个结构域具有相对高的保守性(如图2B所示)。正常的ERRs参与着细胞各种代谢,维持细胞稳态,最近一篇综述总结了近年的研究后发现,异常表达的ERRs会成为肿瘤的帮凶。
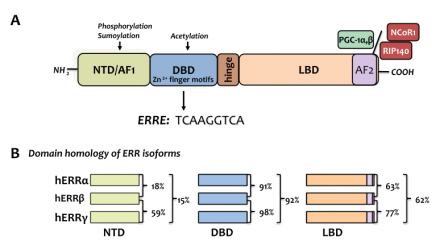
图2. A是ERRs家族的基本结构,B是ERRs家族三个亚型的同源性比较[2]。
其中雌激素相关受体α(estrogen-related receptor α, ERRα)尽管一开始就被定义为孤核受体,便很快有相关研究证明ERRα有其他对应配体结合参与基因调控,但是它被定义为孤核受体并一直沿用至今。ERRα参与了雌激素依赖和非依赖性两种方式的肿瘤发生过程。ERRα的异常表达与乳腺癌、前列腺癌、非小细胞肺癌等癌症相关[4]。因此ERRα也逐渐作为一个癌症治疗的潜在靶点。最近的一个研究发现,ERRα再表达能通过激活EGFR/Src/Erk/SP1信号通路(如图3所示)来增加非小细胞肺癌的耐药性,使EGFR抑制剂EGFR-TKIs药效减弱[5]。文章通过EGFR抑制剂EGFR-TKIs筛选出耐药肺癌细胞株,鉴定出这些耐药肺癌细胞株的EGFR/Src/Erk/SP1信号通路的下游蛋白ERRα高表达。 Lovastatin下调胆固醇水平或者ERRα的抑制剂XCT790阻断通路都能有效抑制耐药肺癌细胞生长。还有2023年最新的一个研究,Avinash等人开发了BipotentR一种蛋白组学方法成功预测并验证ERRα耐药性是除了能量代谢途径外,还可以通过抑制两条免疫途径:a.细胞因子诱导,引起促炎巨噬细胞极化;b. 抗原呈递刺激,引导CD8 +T细胞进入肿瘤[6]。目前已有较为成熟的ERRα敲除的动物及细胞模型供研究[7]。源井生物提供CRISPR/Cas9敲除ERRα技术,提供缺乏ERRα基因型的稳定细胞模型,为实验提供好的平台,用于探究ERRα其他功能及在各类疾病中担任的角色,如肌肉分化、免疫系统、骨骼再生和癌症发生等等。
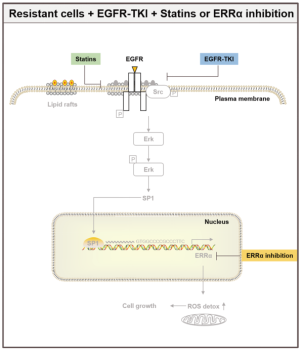
图3. EGFR/Src/Erk/SP1信号通路[5]。
白细胞受体酪氨酸激酶( leukocyte tyrosine kinase,LTK)
染色体重排导致基因融合是一个重要的致癌驱动因素,在不同的肿瘤类型中,融合的基因不尽相同。最近在《自然》的一篇文章中,Izumi等人发现CLIP1-LTK融合蛋白(图4所示)而非单独的LTK蛋白,在肺癌中是引起癌症发生的因素,且占肺癌病例比例有0.4%[8]。作者通过使用LTK5’橙色和3’绿色的两种不同荧光信号的荧光探针,确定18%的癌症病人癌细胞存在LTK发生重排,即只有一种3’绿色荧光。通过测序确定CAP-Gly结构域连接蛋白1(CAP-Gly domain containing linker protein 1,CLIP1)的16号外显子开始与LTK的11号外显子连接,形成新的融合蛋白CLIP1-LTK。白细胞受体酪氨酸激酶( leukocyte tyrosine kinase,LTK)是RTKs胰岛素受体超家族中间变性溶质瘤激酶(ALK)/LTK亚家族的成员,与ALK激酶结构域有近80%的同源性。因此ALK的抑制剂,如Lorlatinib也能对CLIP1-LTK融合蛋白阳性的癌细胞有抑制效果(如图6)。源井生物提供CRISPR/Cas9敲除LTK技术用于探究CLIP1-LTK融合蛋白缺失基因型的代偿的代谢途径变化或耐药机理变化,又或者根据不同的临床数据对LTK定点突变技术获得不同的LTK突变型,探究不同突变型中在其他功能及引起癌症的其他机理或筛选新的药物等。
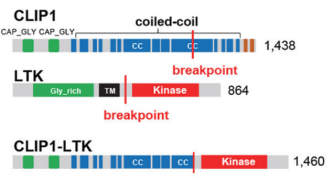
图4. CLIP蛋白、LTK蛋白和CLIP-LTK融合蛋白结构。
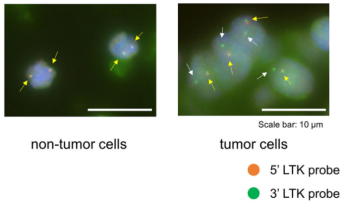
图5.LTK的荧光原位杂交FISH实验[9]。
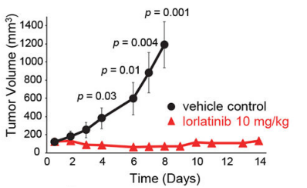
图6. Lorlatinib体内抑制CLIP1-LTK融合蛋白阳性肿瘤的实验[9]。
EMSY转录抑制因子(EMSY transcriptional repressor,EMSY)
随着科研手段的升级及临床数据库的增加,临床研究发现,EMSY在乳腺癌和卵巢癌中都有异常高表达的现象,因此也逐渐成为一个新兴的治疗靶点。EMSY到2003年才被分离确认,EMSY与BRCA2和BRCA2样蛋白结合,具有与DNA修复和转录调控相关的功能[10]。最近有文章报道,在肺癌中检测到EMSY异常高表达[11]。该研究发现携带KEAP1突变的非小细胞肺癌(NSCLCs)通常对免疫治疗产生耐药性,并总结出以下通路方式(如图7所示)。作者通过基因敲除KEAP1,发现EMSY会累积,并开始抑制细胞基因同源重组修复和干扰素I型免疫应答,促使肺癌细胞免疫逃逸。最终推测出来癌症病人中KEAP1 (kelch like ECH associated protein 1)的突变导致EMSY泛素化降解途径受阻,从而引起了EMSY的累积(如图8所示),最终导致了肺癌对免疫治疗的耐受性。EMSY的累积如同双刃剑,一方面增加免疫治疗耐受性,另一方面这种耐受性的肺癌细胞它们对PARP(poly ADP-ribose polymerase 1)的抑制剂或STING的激动剂更敏感。源井生物可以像文章中研究一样,根据客户需求定点敲除基因(如KEAP1)或对EMSY定点突变逃脱泛素化降解,对通路进行激活,完善通路中其他未知的位点,助你研究信号通路更加省时省力。
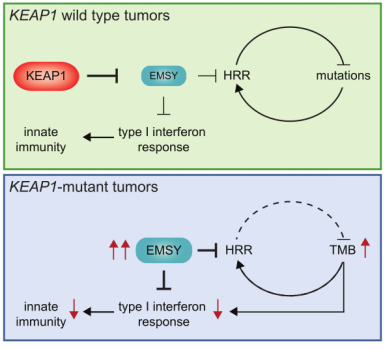
图7. KEAP1-EMSY通路图[11]
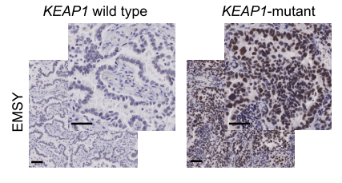
图8. KEAP1野生型和突变型病人组织样品免疫组化图[11]
小结
癌症一直是医学领域研究的热点问题。但有很多原癌基因尚未发现,对抑癌基因的作用机理知之甚少。本文粗略地介绍了肺癌中的三个治疗新靶点:雌激素相关受体α(estrogen-related receptor α, ERRα),白细胞受体酪氨酸激酶(leukocyte tyrosine kinase,LTK)和EMSY转录抑制因子(EMSY transcriptional repressor,EMSY)。这3个靶点发现较晚,研究尚少,但也逐渐热络。中医有云:对症下药。肿瘤靶蛋白的不断发现,促使精准化肿瘤治疗时代更快到来,推动了晚期治疗中以生物标志物为导向的治疗模式,我们期待未来出现更多有效的治疗方式。
上述EGFR、ERRa(ESRRA)、KEAP1均有现货KO细胞,源井生物3500+KO细胞库还包含RB1、PIK3CB、ERBB2、AKT1、MYC等肺癌研究热门靶点,低至8000元,1周达。
更有基因编辑细胞定制服务,4周极速,全方位方案评估和红棉基因风险分析,实验少走弯路,项目更有保障!
[1] Zheng R, Zhang S, Zeng H, Wang S, Sun K, Chen R, Li L, Wei W and He J. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center 2022; 2 1-9.
[2] Huss JM, Garbacz WG and Xie W. Constitutive activities of estrogen-related receptors: Transcriptional regulation of metabolism by the ERR pathways in health and disease. Biochim Biophys Acta 2015; 1852: 1912-1927.
[3] Giguere V, Yang N, Segui P and Evans RM. Identification of a new class of steroid hormone receptors. Nature 1988; 331: 91-94.
[4] Mukherjee TK, Malik P and Hoidal JR. The emerging role of estrogen related receptoralpha in complications of non-small cell lung cancers. Oncol Lett 2021; 21: 258.
[5] Pan Z, Wang K, Wang X, Jia Z, Yang Y, Duan Y, Huang L, Wu ZX, Zhang JY and Ding X. Cholesterol promotes EGFR-TKIs resistance in NSCLC by inducing EGFR/Src/Erk/SP1 signaling-mediated ERRalpha re-expression. Mol Cancer 2022; 21: 77.
[6] Sahu A, Wang X, Munson P, Klomp JPG, Wang X, Gu SS, Han Y, Qian G, Nicol P, Zeng Z, Wang C, Tokheim C, Zhang W, Fu J, Wang J, Nair NU, Rens JAP, Bourajjaj M, Jansen B, Leenders I, Lemmers J, Musters M, van Zanten S, van Zelst L, Worthington J, Liu JS, Juric D, Meyer CA, Oubrie A, Liu XS, Fisher DE and Flaherty KT. Discovery of Targets for Immune-Metabolic Antitumor Drugs Identifies Estrogen-Related Receptor Alpha. Cancer Discov 2023; 13: 672-701.
[7] Mao L, Peng L, Ren X, Chu Y, Nie T, Lin W, Zhao X, Libby A, Xu Y, Chang Y, Lei C, Loomes K, Wang N, Liu J, Levi M, Wu D, Hui X and Ding K. Discovery of JND003 as a New Selective Estrogen-Related Receptor alpha Agonist Alleviating Nonalcoholic Fatty Liver Disease and Insulin Resistance. ACS Bio Med Chem Au 2022; 2: 282-296.
[8] Izumi H, Matsumoto S, Liu J, Tanaka K, Mori S, Hayashi K, Kumagai S, Shibata Y, Hayashida T, Watanabe K, Fukuhara T, Ikeda T, Yoh K, Kato T, Nishino K, Nakamura A, Nakachi I, Kuyama S, Furuya N, Sakakibara-Konishi J, Okamoto I, Taima K, Ebi N, Daga H, Yamasaki A, Kodani M, Udagawa H, Kirita K, Zenke Y, Nosaki K, Sugiyama E, Sakai T, Nakai T, Ishii G, Niho S, Ohtsu A, Kobayashi SS and Goto K. The CLIP1-LTK fusion is an oncogenic driver in non-small-cell lung cancer. Nature 2021; 600: 319-323.
[9] The CLIP1-LTK Fusion Is an Oncogenic Driver of NSCLC. Cancer Discov 2022; 12: 286.
[10] Hughes-Davies L, Huntsman D, Ruas M, Fuks F, Bye J, Chin SF, Milner J, Brown LA, Hsu F, Gilks B, Nielsen T, Schulzer M, Chia S, Ragaz J, Cahn A, Linger L, Ozdag H, Cattaneo E, Jordanova ES, Schuuring E, Yu DS, Venkitaraman A, Ponder B, Doherty A, Aparicio S, Bentley D, Theillet C, Ponting CP, Caldas C and Kouzarides T. EMSY links the BRCA2 pathway to sporadic breast and ovarian cancer. Cell 2003; 115: 523-535.
[11] Marzio A, Kurz E, Sahni JM, Di Feo G, Puccini J, Jiang S, Hirsch CA, Arbini AA, Wu WL, Pass HI, Bar-Sagi D, Papagiannakopoulos T and Pagano M. EMSY inhibits homologous recombination repair and the interferon response, promoting lung cancer immune evasion. Cell 2022; 185: 169-183 e119.










