CRISPR/Cas9联手干细胞助力研究NLGN3 R451C突变在ASD致病机制中的作用!


CRISPR/Cas9联手干细胞助力研究NLGN3 R451C突变在ASD致病机制中的作用!

孤独症谱系障碍(Autism Spectrum Disorder,ASD)是一组复杂的神经发育障碍性疾病,包括自闭症、阿斯伯格综合征和待分类的广泛性发展障碍,表现出社会交往障碍、言语交流障碍、重复性刻板行为等症状,对儿童的健康发育、家庭的经济和精神带来很大的影响。因此,探索ASD的发病机制为ASD的有效预防和早期干扰提供理论基础刻不容缓。
突触功能障碍被认为是ASD和其他神经发育障碍的关键生理致病机制,与之相关的基因有编码神经连接蛋白(Neuroligin,NLGN)和编码神经突触蛋白(Neurexin,NRXN)的基因,其中NLGN3基因上的R451C突变已被证实会引起小鼠社交障碍、神经突触传递异常等与ASD密切相关的特征,但尚未验证该突变在人类神经元中是否有同样影响。
中南大学的陈超教授团队与斯坦福大学Thomas C. Südhof教授、美国罗格斯大学Zhiping Pang教授团队联手对此展开研究,并在Molecular Psychiatry上联合发表了题为“Analyses of the autism-associated neuroligin-3 R451C mutation in human neurons reveal a gain-of-function synaptic mechanism”的文章。

他们利用人源胚胎干细胞的多向分化潜能,通过CRISPR/Cas9基因编辑技术建立了NLGN3 R451C突变神经元模型,发现敲入NLGN3 R451C突变后,细胞内的NLGN3蛋白水平显著下降,兴奋性突触传递增强,并验证了该突变为ASD相关关键细胞表型,为ASD治疗策略开发提供理论依据。
NLGN3 R451C突变引起兴奋性突触数量及传递强度增加
研究人员使用CRISPR/Cas9基因编辑技术将R451C突变敲入人类H1细胞中,确认NGLN3 R451C突变H1细胞的多能性未被破坏且未有脱靶突变后,采用iN细胞技术将对照细胞和NLGN3 R451C突变的H1细胞诱导分化成兴奋性神经元和抑制性神经元。
共同培养这两种神经元,对其蛋白水平、基因表达进行分析发现:与NLGN3 R541C突变敲入小鼠模型中观察到的结果一致,敲入R451C突变会导致胞内NLGN3蛋白水平显著下降(图1e)。但qPCR的结果显示敲入NLGN3 R451C突变不会改变NLGN mRNA的水平(图S2),这说明NLGN3 R451C突变是通过影响NLGN3蛋白的稳定性引起蛋白水平下降的。
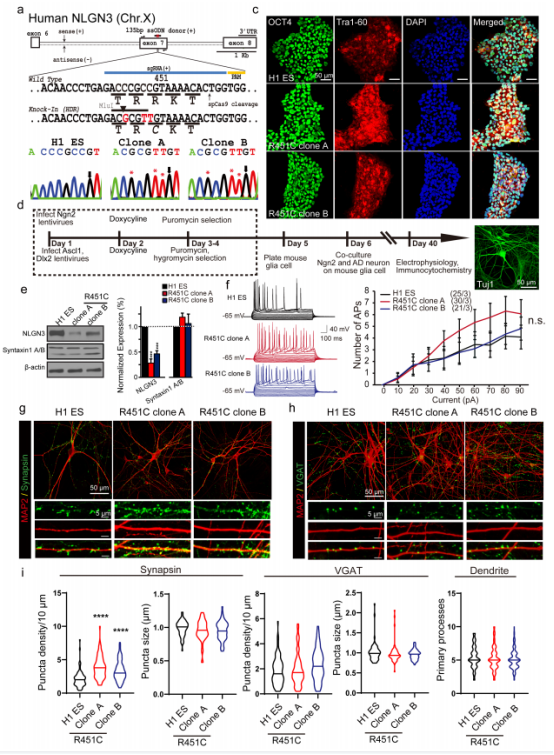
图1
图S2
接着,为了研究受NLGN3 R451C突变影响而胞内NLGN3蛋白水平下降的神经元是否存在功能障碍,研究人员通过全细胞膜片钳技术和形态学对突变神经元和对照神经元进行了分析。他们发现NLGN3 R451C突变神经元的固有点响应特性、对电刺激响应的动作电位与对照神经元相似(图1f,图2c-e),但有且仅有突变株的兴奋性突触数量增多(图1g-i)。
对NLGN R451C突变神经元和对照神经元的自发兴奋性突触后电位(sEPSCs)和抑制性突触后电流进行记录和分析发现:与对照神经元相比,NLGN R451C突变神经元的sEPSCs频率大幅增加,而sIPSCs则没有明显差异(图2f-i)。在加入河豚毒素作为刺激源的实验中观察到相似的结果,表明:在人类神经元中NLGN3 R451C突变可通过增加兴奋性突触数量来增强兴奋性突触传递的强度,从而打破突触兴奋/抑制传递平衡,导致神经元功能障碍。
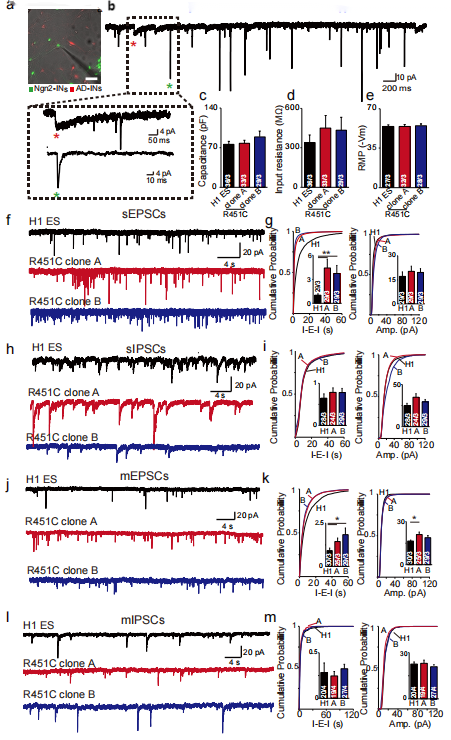
图2. NLGN3 R451C增强了兴奋性突触传递强度
基于上述结果,研究人员猜测NLGN3 R451C突变可能通过影响NLGN3蛋白的稳定性诱发内质网应激反应,从而对神经元造成重大损害导致ASD。但他们验证后排除了这一推测,并对其具体机制进行了别的摸索。
源井已成功在多种干细胞中实现基因编辑,积累了丰富的干细胞培养及基因编辑经验,采用精研干细胞培养基,保留干性的同时保证细胞转染前后状态如初,独家CRISPR-U™技术提高基因编辑效率达10倍,轻松交付优质iPS/ES基因编辑纯合克隆!基因敲除/敲入/点突变均可定制,神经细胞、心肌细胞模型构建不再难!
将NLGN3 R451C突变神经元移植至小鼠大脑中验证细胞水平结果
研究人员将表达mCherry的对照兴奋性神经元和表达mVenus的NLGN3 R451C突变兴奋性神经元一同移植到RAG2免疫缺陷新生小鼠的海马体中(图4a),并在6周后通过成像、电生理学、全细胞膜片钳技术对神经元进行分析。
经检测发现移植的神经元在形态和功能上已成功整合到小鼠的神经元网络中,既能接收兴奋性突触传递也能接收抑制性突触传递。不仅如此,研究人员观察到了与细胞实验中一样的现象:相比于对照神经元,NLGN R451突变神经元的sEPSC频率更高,但振幅没有显著差异(图4e-i)。进一步证实了NLGN3 R451C突变在人类神经元中产生的影响与在小鼠体内产生的影响是一致的,也表明NLGN3 R451C突变是ASD相关功能获得性表型。
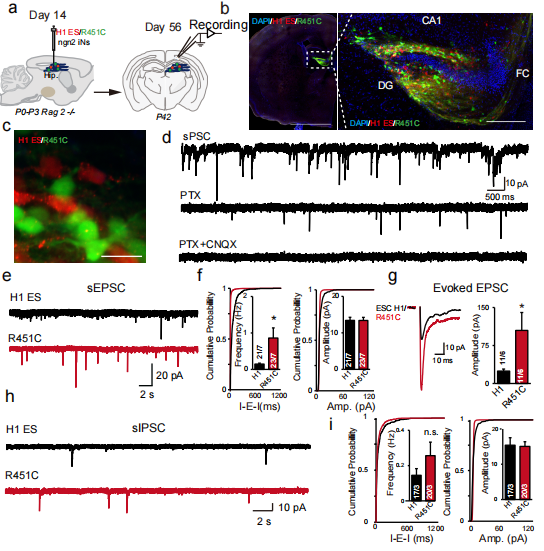
图4
NLGN3 R451C突变对兴奋性神经元的影响更大
为了研究NLGN3 R451C突变在人类神经元中产生的影响与突触表型相关基因的关系,研究人员使用单细胞RNA测序对体外共培养的对照组和突变组神经元进行分析,得到基因富集图谱和基因表达差异结果。数据显示差异表达基因在不同类型神经元中是不同的,提示NLGN3 R451C突变可能对不同类型神经元产生的影响不同(图5d)。而后用SynGo进行深度分析发现上调的基因中突触功能相关的居多。不仅如此,他们发现兴奋性NLGN3 R451C突变神经元比抑制性NLGN3 R451C突变神经元显示出更高的突触功能基因富集(图5e),且兴奋性NLGN3 R451C突变神经元的基因表达差异更大,这表明NLGN3 R451C突变可能对兴奋性神经元的基因表达差异影响更大,也从侧面验证了NLGN3 R451C突变是通过影响兴奋性神经元突触传递引起神经元功能障碍的。
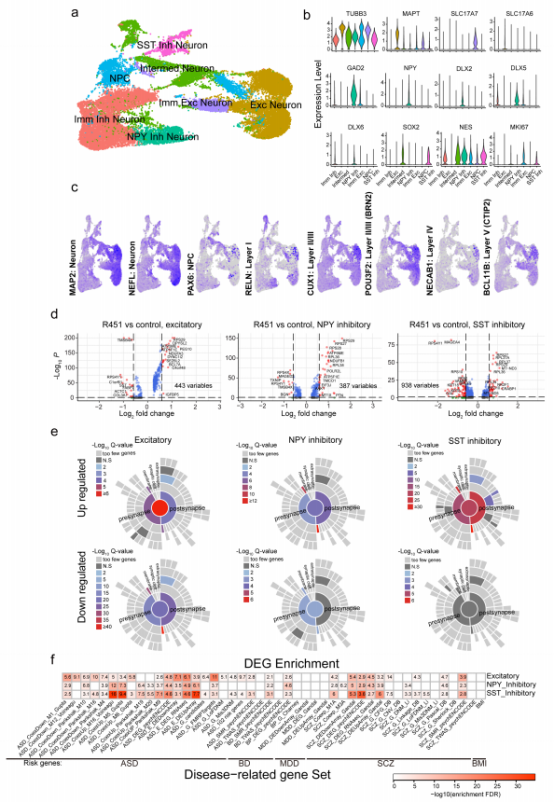
图5
NLGN3 R451C突变在SCZ、BP、ASD等精神障碍的生理病理发展中起关键作用
研究人员还通过包括遗传学、差异表达、共表达在内多种类型的数据对NLGN3 R451C突变引起的基因表达差异与精神疾病的关系展开了研究,他们发现被NLGN3 R451C突变影响的与突触功能相关的趋同基因网络在精神分裂症、双相情感障碍、孤独症谱系障碍等多种精神障碍的生理病理进程中都起着关键性作用。这也从另一方面验证了NLGN3 R451C突变是精神障碍疾病的关键细胞表型。
该研究巧妙结合人源胚胎干细胞的多向分化潜能特性及CRISPR/Cas9技术优势,建立了NLGN3 R451C突变神经元模型以研究NLGN3 R451C突变对人类神经元的影响,揭示了NLGN3 R451C突变是ASD细胞的关键功能获得性表型、对兴奋性神经元突触传递有增强作用,填补了人源细胞NLGN3 R451C突变的研究空缺,为ASD预防和治疗提供理论基础。
除了H1/H9/iPS等干细胞的基因编辑服务,源井还能提供超200种肿瘤细胞的基因敲除细胞系、基因敲入细胞系、基因点突变细胞系、基因过表达细胞系、基因干扰细胞系定制服务,助力细胞疾病模型构建,快至4周交付优质纯合。










