mTOR在疾病治疗与药物开发方面研究价值高?CRISPR/Cas9来助一臂之力!


DEPTOR基因敲除细胞证实DEPTOR可抑制ESCC细胞的肿瘤发生,是人类ESCC的潜在治疗靶点或预后标志物
使用MLST8敲除及点突变细胞发现mTORC2特异性抑制剂开发新途径——破坏mTOR-mLST8相互作用
PRAS40通过抑制内皮细胞中mTORC1依赖性促炎信号传导来抑制动脉粥样硬化形成
mTOR在疾病治疗与药物开发方面研究价值高?CRISPR/Cas9来助一臂之力!
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种丝氨酸/苏氨酸蛋白激酶,为PIKK蛋白质家族成员之一,被多种刺激因素激活后,以mTORC1和mTORC2两种复合物的形式介导下游通路,调节包括蛋白质合成、新陈代谢、细胞自噬与细胞存活在内的各种生理活动。上述提到的mTORC1由mTOR、Raptor、mLST8、Deptor、PRAS40组成,而mTORC2则由mTOR、Rictor、mLST8、mSin1、PRR5组成。
mTOR上下游涉及的信号通路超30个,交互关系错综复杂,这里我们简化了一个示意图(图1)。从图中可以看出,激活mTOR通路的因素有很多,包括细胞营养、能量状态、氧气水平、机械刺激、氨基酸和激素生长因子等。这些刺激因素通过上游信号通路(如:AMPK、MAPK或PI3K/Akt等)激活mTORC1或mTORC2复合物,而后作用于下游效应分子。下游效应分子中的CLIP-170与微管蛋白组装有关,Grb10、Lipin-1与脂类代谢相关,ATG1与细胞自噬相关联,4E-BP、eIF4E、S6K、eIF4B与蛋白质合成有关,Rho和PKC与细胞骨架有密切联系,SGK1则与细胞存活所关联。
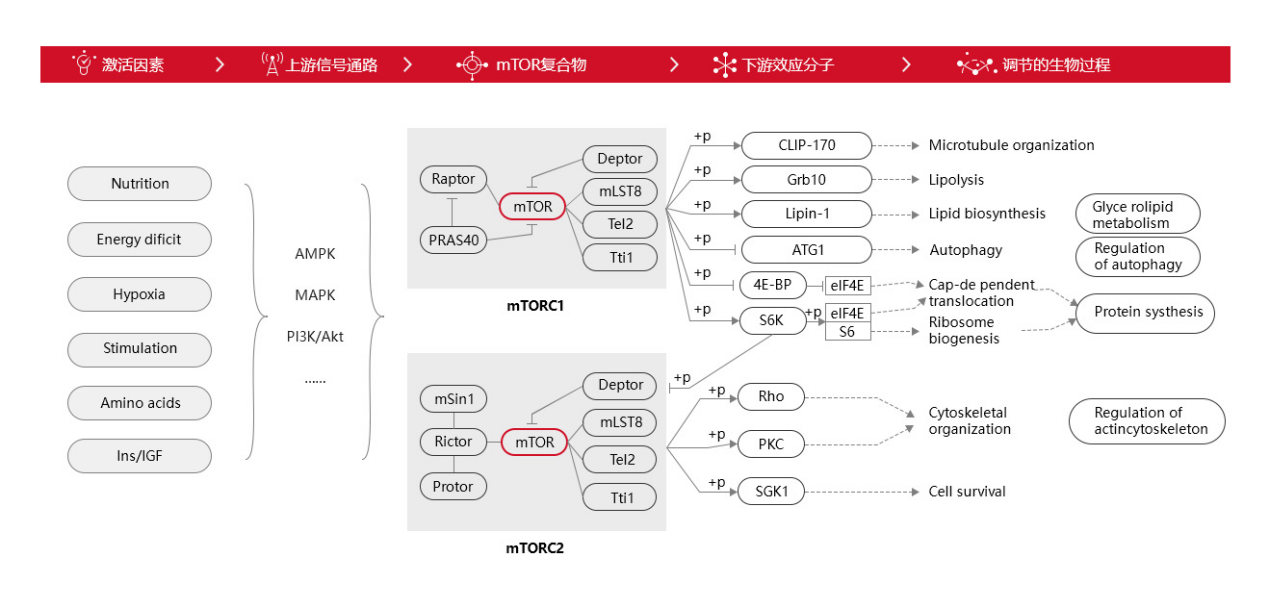
图1.mTOR信号通路简图
正因如此,mTOR能调节各种细胞生理活动,参与多种人类疾病的发生与发展,如心血管疾病、糖脂代谢障碍、神经系统疾病、癌症等。探清mTOR通路中与疾病有关的基因和致病机制有助于找出更多的潜在药物靶点。下面给大家介绍几个mTOR通路基因与疾病研究相关的案例。
DEPTOR抑制ESCC细胞的肿瘤发生,成为人类ESCC的潜在治疗靶点或预后标志物
作为一种能抑制mTORC1和mTORC2激酶活性的mTOR结合蛋白,DEPTOR表达的上调在结直肠癌、肝癌、多发性骨髓瘤和胰腺癌中均有抗肿瘤活性。大量实验表明,DEPTOR表达的下调会激活Akt/mTOR通路,直接磷酸化下游的SGK1及其底物NDRG1,从而促进肿瘤的增殖。Ji等人[2]发现在人类ESCC患者肿瘤组织中的表达显著降低,并称DEPTOR的表达下调可作为ESCC的预后标志物。不仅如此,他们还发现DEPTOR的表达对ESCC细胞系(KYSE150、KYSE510和KYSE190)的致瘤活性具有负向调节作用。使用CRISPR/Cas9介导DEPTOR敲除会显著促进ESCC细胞系增殖、迁移和侵袭。且体内试验进一步显示,与未处理的 KYSE150 细胞相比,DEPTOR 异位表达的 KYSE150 细胞生长受到显著抑制,而DEPTOR敲除KYSE-510细胞的增殖、迁移与侵袭则得到显著增强。最重要的是:经生化检验发现,在DEPTOR 过表达的KYSE150中,Akt、mTOR 和下游 SGK1 的磷酸化均下调,这表明DEPTOR的过表达可以抑制Akt/mTOR 通路,从而控制ESCC的进展。
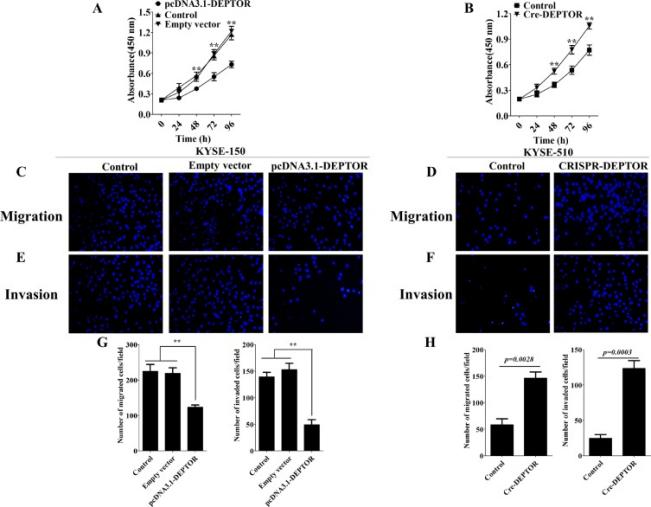
图2.DEPTOR 抑制 ESCC 细胞的增殖、迁移和侵袭
源井可提供DEPTOR敲除细胞现货及“单克隆级别”过表达稳转株服务,前者低至¥8000,快至1周,后者¥9980即可拿下表达均一性高、细胞状态好的纯合子!点击此处联系客服获取专属服务>>
mTORC2 特异性抑制剂开发新途径——破坏mTOR-mLST8相互作用
众所周知,mLST8存在于mTORC1和mTORC2复合物中,但对于mLST8如何促进mTOR 复合物的组装和维持其活性则知之甚少。Hwang等人[3]设计了靶向MLST8外显子2、4和7的sgRNA,通过CRISPR/Cas9介导获得MLST8基因敲除的293T细胞系。经实验验证,MLST8蛋白敲除会影响mTORC2与RICTOR和SIN1的组装,从而消除mTORC2的活性,但对mTORC1的活性无影响。同时,Hwang等人还通过CRISPR/Cas9技术同源重组修复构建了mTOR 的突变体,确定了mTOR和MLST8的相互作用位点。并对SIN1编码基因MAPKAP1进行CRISPR/Cas9基因编辑产生了SIN1敲除的293T 细胞,证实了mLST8是mTORC2中mTOR和SIN1之间的分子桥梁。这也表明破坏mTOR-mLST8相互作用可能是mTORC2特异性抑制剂设计新策略。
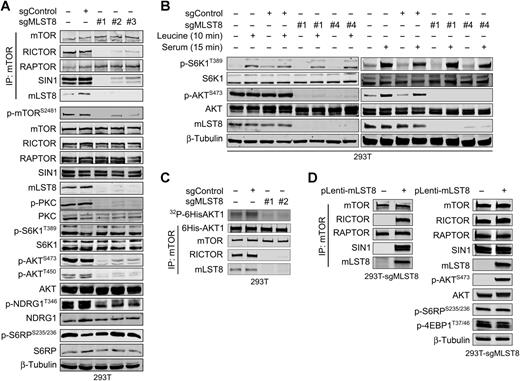
图3.mTORC2 的组装和活动需要mLST8
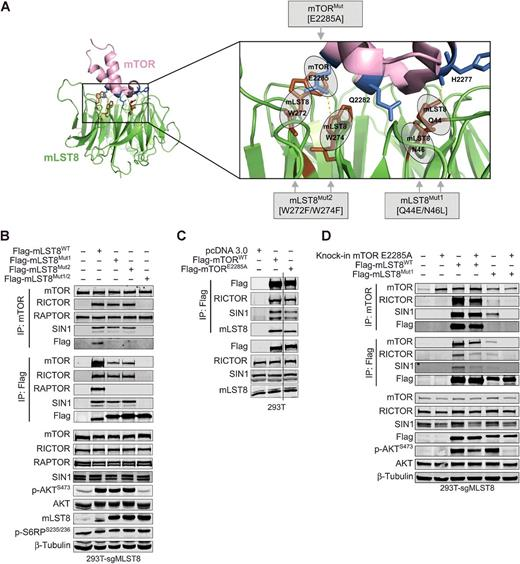
图4.破坏mTOR-mLST8互作的突变位点会影响mTORC2的组装与活性
PRAS40通过抑制内皮细胞中mTORC1依赖性促炎信号传导来抑制动脉粥样硬化形成
内皮细胞中促炎信号的激活是动脉粥样硬化发生的关键,许多促炎和致动脉粥样硬化信号都集中在mTOR信号通路上。临床前研究发现mTORC1抑制剂可以减少动脉粥样硬化程度,但会引发胰岛素抵抗和血脂异常等副作用,在临床的应用上颇为受限。Zhang等人[1]选择了mTORC1 的内源调节基因PRAS40(AKT1S1)进行功能验证,尝试找到新的基因靶点。实验表明,下调人脐静脉内皮细胞(HUVEC)中PRAS40的表达可以激活TNFα诱导的mTORC1信号传导、促进细胞增殖、上调炎症标志物及单核细胞募集水平。相比之下,PRAS40的过表达会阻断mTORC1和所有促炎信号的传导。此外,在动脉粥样硬化的体内模型中,内皮特异性PRAS40基因敲除的小鼠显示出内皮促炎激活反应的增强以及新内膜增生和动脉粥样硬化病变形成的增加。这些数据表明 PRAS40 通过抑制内皮mTORC1介导的促炎信号传导来抑制动脉粥样硬化。结合其对代谢稳态的有利影响,PRAS40 成为治疗动脉粥样硬化的潜在靶点。
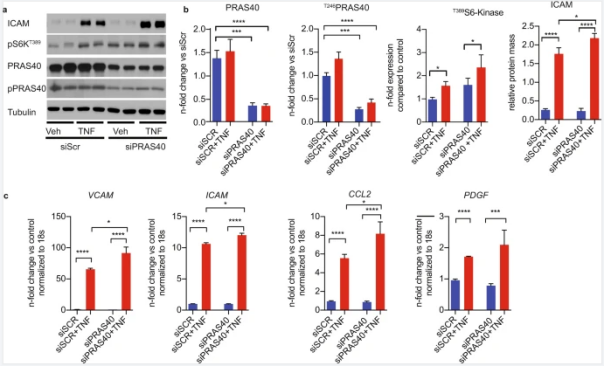
图5.PRAS40 敲低促进内皮细胞中的促炎信号传导
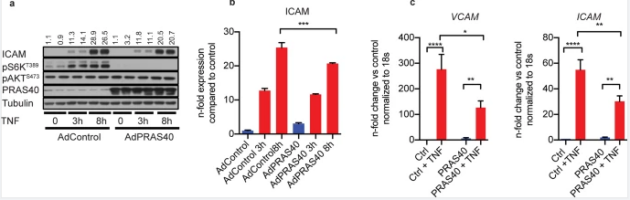
图6.PRAS40 过表达减弱内皮细胞中的促炎信号
mTOR在疾病进程及治疗研究方面有着强大的潜力,验证这些作用机制可能需要用到大量的基因敲除细胞或过表达细胞,源井生物近期上新mTOR信号通路基因敲除细胞,文献中提到的PRAS40(AKT1S1)、DEPTOR、mLST8、SIN1(MAPKAP1)及其他mTOR信号通路相关基因(如DVL1、TSC1、SGK1)均有KO现货!超3000种KO现货低至¥8000,快至1周!点击入库搜索心仪细胞>>
更有快至4周KO极速定制,点击咨询获取服务详情>>
[1]Zhang K S, Schecker J, Krull A, et al. PRAS40 suppresses atherogenesis through inhibition of mTORC1-dependent pro-inflammatory signaling in endothelial cells[J]. Scientific reports, 2019, 9(1): 1-13.
[2]Ji YM, Zhou XF, Zhang J, Zheng X, Li SB, Wei ZQ, Liu T, Cheng DL, Liu P, Song K, Tan T, Zhu H, Guo JL. DEPTOR suppresses the progression of esophageal squamous cell carcinoma and predicts poor prognosis. Oncotarget. 2016 Mar 22;7(12):14188-98. doi: 10.18632/oncotarget.7420. PMID: 26893358; PMCID: PMC4924707.
[3]Hwang Y, Kim L C, Song W, et al. Disruption of the Scaffolding Function of mLST8 Selectively Inhibits mTORC2 Assembly and Function and Suppresses mTORC2-Dependent Tumor Growth In VivoSelective Role of mLST8 in mTORC2[J]. Cancer research, 2019, 79(13): 3178-3184.










