作为生物制剂生产的黄金标准,CHO细胞真的够格吗?
CHO细胞(Chinese hamster ovary cell)是源自1957 年西奥多·帕克 (Theodore Puck) 获得的那只雌性中国仓鼠的卵巢,属于上皮样细胞,通常贴壁生长、也可悬浮生长。除其他一些特殊的的因素外(如利用伽玛射线诱变CHO细胞,产生一种新的细胞系CHO-DG44,这些DHFR缺陷型菌株需要甘氨酸、次黄嘌呤和胸腺嘧啶核苷才能生长),它们易于在规定条件下的大规模细胞培养中生长,并且允许进行人类生物仿制药的翻译后修饰,这些特性使 CHO 细胞成为强大的生物工厂。它们独特的有益质量特性组合使它们成为生产许多蛋白质的理想细胞系。CHO细胞通常应用于生物学和医学研究,并且在商业上用于生产具治疗性的蛋白质[1]。目前它们已广泛用于遗传学、毒性筛选,以及营养方面和基因表达的研究,特别是CHO细胞用于重组蛋白治疗剂和工业生产的最常用的哺乳动物宿主[1],是生物制剂生产的黄金标准。另外所有CHO细胞系均不会合成脯氨酸及表达表皮生长因子受体(EGFR),所以CHO细胞成为研究各种EGFR突变的理想选择[1]。
1.CHO细胞是应用于大规模生产治疗性蛋白质和重组蛋白表达的最常见哺乳动物细胞系
由哺乳动物细胞产生的蛋白质疗法改变了人类医疗水平的格局。基于哺乳动物细胞的生物过程已用于制造病毒疫苗、诊断和治疗蛋白质。在蛋白质治疗剂的生产中,细胞是产生蛋白质的主要宿主。最广泛使用的宿主哺乳动物细胞是中国仓鼠卵巢 (CHO) 细胞和小鼠骨髓瘤细胞。CHO经过长期驯化和改造, 目前已经发展出多个不同的CHO细胞系, 常见的有CHO-K1、CHO-S、CHO-DXB11、CHO-DG44等。CHO-S细胞也是野生型细胞株, 与CHO-K1都来源于最原始的CHO细胞系。CHO 细胞是市场上超过 70% 的蛋白质药物的首选制造宿主细胞,这是因为CHO细胞能够在无血清悬浮培养中以高密度生长,可以在延长的发酵周期中维持高水平的蛋白质表达。除此之外,CHO细胞可以在外源表达的蛋白质上掺入复杂的聚糖,典型的糖蛋白仅包含少数 N-连接聚糖,有助于蛋白质折叠和细胞内运输。当这些聚糖终止于唾液酸残基时,它们会增加对蛋白水解的抵抗力并延长体内血清半衰期。由于这些物理和药代动力学优势,重组糖蛋白表达侧重于最大化每个分子中含有唾液酸的复杂聚糖的数量。因此CHO细胞也成为被广泛用作重组蛋白表达的宿主细胞[2]。
CHO细胞作为哺乳类的细胞, 与真核表达系统中的酵母细胞、果蝇细胞S9的翻译后修饰相比, 更接近人源细胞蛋白质中的修饰。CHO细胞不仅具有贴壁生长的特点, 还能在无血清无蛋白培养基中进行高密度悬浮培养, 适于大规模的工业化生产。CHO细胞隶属于成纤维细胞, 内源性蛋白分泌少, 可高效分离和纯化重组蛋白。除此之外,CHO细胞具有重组蛋白的高表达和高扩增能力。同时, CHO细胞也有着自身无法避免的遗传缺陷, 即其胞内不含脯氨酸合成基因, 导致无法将谷氨酸转变为谷氨酸-γ-半醛, 并且在它合成的过程中还需要在对应的培养基中添加辅助生长的L-脯氨酸[2]。
CRISPR/Cas9基因组编辑技术已被广泛应用于通过快速,简单高效的哺乳动物基因组工程。CRISPR/Cas9已经成为在CHO细胞中产生基因断裂的高效工具,CRISPR/Cas9在CHO细胞工程中扩大产品多样性、控制和提高重组蛋白的产品质量和产量起到非常重要的作用,CRISPR/Cas9 系统的高效率、稳定性、易用性和低成本使其成为学术界和工业界极具吸引力的基因组编辑工具。在CHO细胞中引入 CRISPR/Cas9 系统并结合CRISPy 设计工具将显着加快CHO细胞基因组编辑的步伐,并且可以提高CHO细胞系改良率,从而提高生物药物的产量和质量[3]。
源井生物已成功在CHO-K1细胞系中进行了基因编辑,并且源井生物专家团队凭借12年的基因编辑经验对我们独家的CRSIPR-U™技术体系进行了升级,将基因敲除效率提高到80%,可实现在CHO细胞中进行高效的基因编辑。我们提供所有的基因编辑服务都面向全球,包括基因敲除/敲入/点突变细胞株,稳转细胞株/病毒包装和gRNA载体现货。
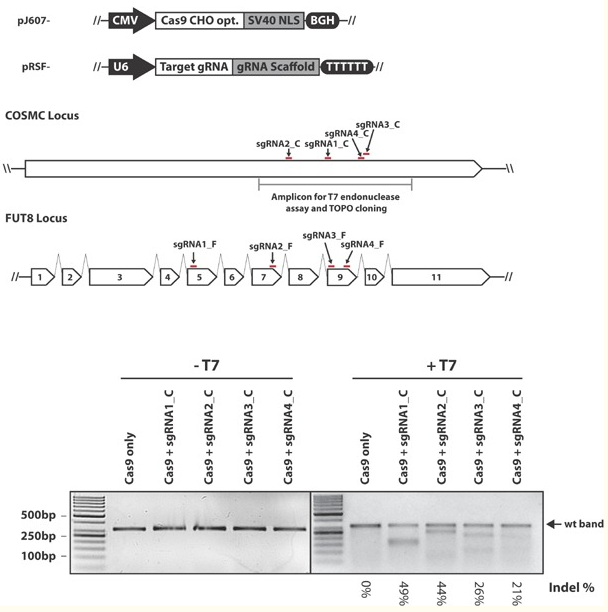
图 1
CHO细胞是生物制药工业生产复杂药物蛋白的首选宿主,CHO 细胞的基因组工程将有利于产品产量和稳定性。Long等人通过在Dnmt3a中产生位点特异性的基因断裂来验证Dnmt3a 的敲除对基因长期表达稳定性的影响,该基因编码涉及DNA甲基转移酶的蛋白质。将稳定转染CMV或EF1的3a-30和CHO-K1细胞的多克隆α在有(G418+)或无(G418-)的选择压力下通过中60段。检测10、20、30、40、50和60代细胞的MFIs,判断EGFP表达强度。无论是否存在G418,转染CMV的Dnmt3a缺陷型3a-30细胞系表现出最稳定和最高的表达水平(图1)。稳定转染EF1的3a-30和正常CHO细胞的转基因表达水平α 在长期培养过程中表现出生产力的损失。结果表明,基于Dnmt3a敲除的Dnmt3a 缺陷型CHO细胞系在超过60代的转染细胞中,在 CMV 启动子的控制下,表现出增强的转基因表达的长期稳定性(图1B)[4]。
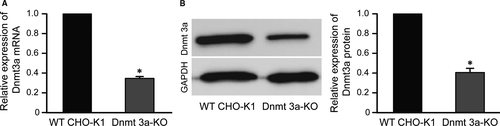
图 2 Dnmt3a 在野生型 (WT) 和敲除 (KO) CHO-K1 细胞中的表达水平。
在CHO细胞中,可编辑的核酸酶的基因敲入主要通过NHEJ方法进行。Sakuma等人使用转录激活子样效应核酸酶(TALEN)和PITCh系统在CHO细胞中敲入一个大分子片段 (携带一个单链Fv-Fc(scFv-Fc),以及DsRed和嘌呤霉素耐药基因PuroR)[5]。
为了估计CHO-K1 细胞中HPRT1位点基因敲入的能力和效率,首先使用 TALEN 介导的 PITCh 系统进行了整个质粒整合。DsRed和PuroR基因,分别由延伸因子 1 α (EF-1α) 和Simian病毒 40 (SV40) 启动子启动,独立放置在供体质粒中,以便于筛选质粒掺入的细胞(图 2)。然而,即使质粒通过随机整合整合到基因组中,这些基因也能发挥作用。所以在供体质粒中添加了修饰的 TALEN 靶序列,使MMEJ介导的PITCh能够实现。修改后的 TALEN 位点包含与基因组上原始目标位点不同的间隔序列,如图3 b所示。在每个靶点发生DSB后,理想情况下,9bp的Microhomologies可用于MMEJ介导的整合(图3b)[5]。
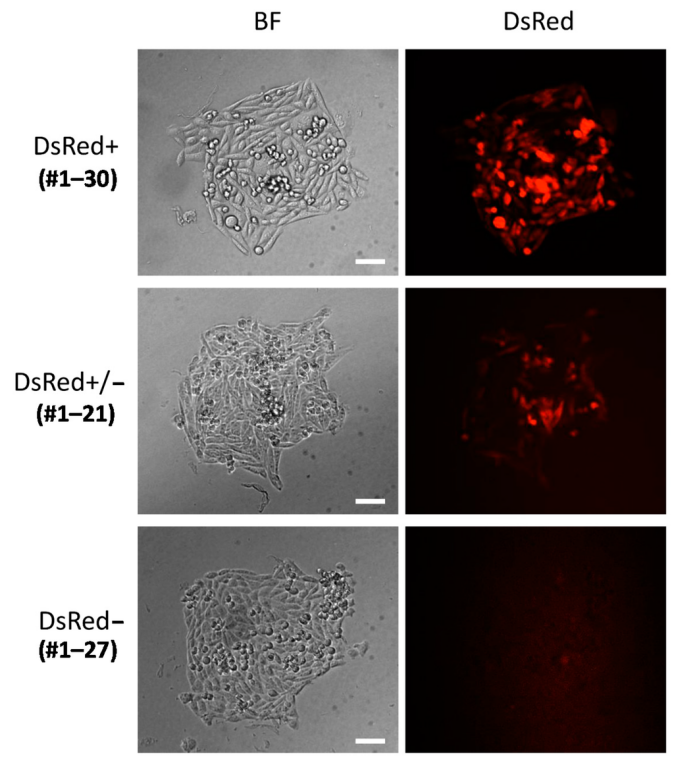
图 3 荧光图像
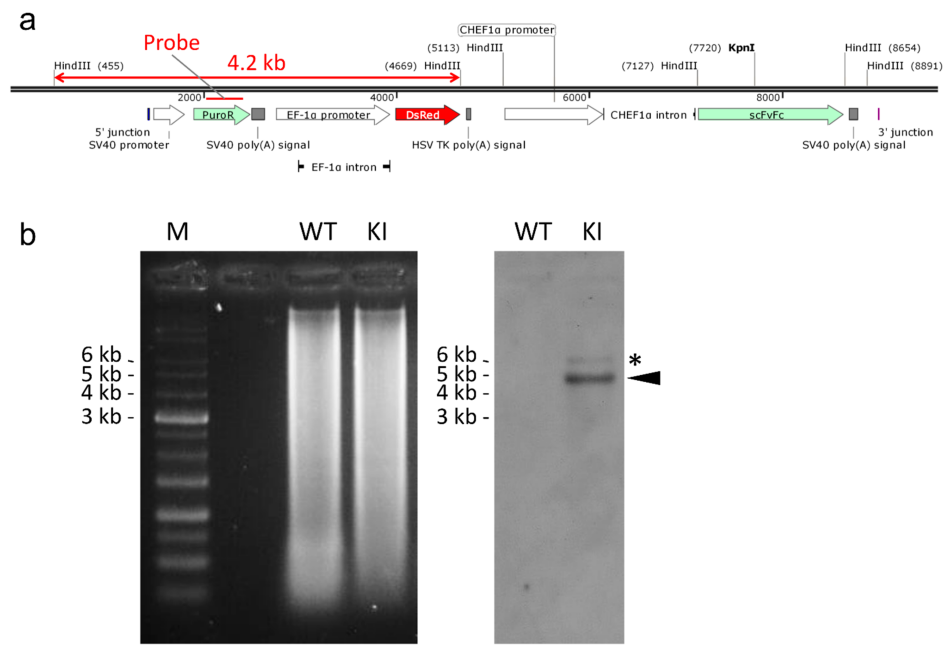
图 4 敲入细胞克隆的 5' 和 3' 连接序列
CRISPR/Cas9技术可实现上述实验目标,此外,与传统技术(如TALEN)比起来,CRISPR/Cas9技术更简单高效!而源井生物的CRISPR-U™技术体系是基于传统CRISPR/Cas9技术独家研发的,基因敲除效率高达60%-80%,其他的基因编辑实验也能高效完成。
hGHR基因突变是Laron综合征的主要原因,为了构建稳定表达先天生长激素不敏感综合征相关的基因hGHR以及突变体(hGHR-E42K、hGHR-H56R)的CHO细胞株,Lihua等人利用PUC-hGHR质粒,定点突变获得两个突变体(hGHR-E42K、hGHR-H56R),限制性酶切法将目的基因克隆到真核载体pcDNA3.1/(zeo+),然后利用Lipofectamine2000将重组子转染至CHO细胞,通过Zeocin抗性筛选稳定表达hGHR以及突变体的细胞群,并用RT-qPCR 和Western Blot 证实hGHR,STAT5-P表达水平。结果显示,测序验证hGHR的E42K和H56R错义突变成功引入,并克隆到真核表达载体,转染后在CHO细胞中成功检测到hGHR和突变体的mRNA和蛋白,突变细胞株(hGHR-E42K、hGHR-H56R)的磷酸化STAT5蛋白表达量低于野生细胞株。因此,GHR突变后磷酸化STAT5水平,发现突变子的磷酸化STAT5α,STAT5β蛋白表达量都明显低于野生型GHR,解释了GHR突变患者生长发育迟缓的内在机制[6]。
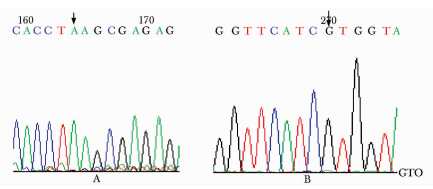
图 5 hGHR-E42K、hGHR-H56R的测序图

图 6 RT-qPCR检测 wt-hGHR及突变体在CHO细胞内的表达
迄今为止,源井生物已成功利用独家CRISPR-UTM技术体系对包括SW480细胞在内的超200种的热点细胞进行了基因编辑,并在全球范围内提供成熟优质的基因编辑服务。
参考文献:
[1] Wurm FM. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 2004 Nov;22(11):1393-8. doi: 10.1038/nbt1026. PMID: 15529164.
[2] STOLFA G, SMONSKEY M T, BONIFACE R, et al. The fickle CHO: a review of the causes, implications, and potential alleviation of the CHO cell line instability problem [J]. Curr Opin Biotech, 2019,
[3] STOLFA G, SMONSKEY M T, BONIFACE R, et al. The fickle CHO: a review of the causes, implications, and potential alleviation of the CHO cell line instability problem [J]. Curr Opin Biotech, 2019, Jia, Yan‐Long, et al. "CRISPR/Cas9‐mediated gene knockout for DNA methyltransferase Dnmt3a in CHO cells displays enhanced transgenic expression and long‐term stability." Journal of cellular and molecular medicine 22.9 (2018): 4106-4116.
[4] Sakuma, Tetsushi, et al. "Homologous recombination-independent large gene cassette knock-in in CHO cells using TALEN and MMEJ-directed donor plasmids." International journal of molecular sciences 16.10 (2015): 23849-23866.
[5] DiBello, Paul R., et al. "Selective uncoupling of RGS action by a single point mutation in the G protein α-subunit." Journal of Biological Chemistry 273.10 (1998): 5780-5784.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划