经典模型HT-29细胞,也能把结直肠癌研究出花来!


经典模型HT-29细胞,也能把结直肠癌研究出花来!

HT-29细胞的背景
HT-29细胞系是在1964年由Fogh 和 Trempe 两位科学家分离发现,来源于一名患结直肠癌(CRC)的白人女性的原发肿瘤。 HT-29细胞具备成熟肠细胞的特征,当给予不同的培养条件或者诱导剂时,它会表现出不同的分化途径,因此HT-29细胞可作为研究肠道细胞分化分子机制的独特模型。HT-29细胞作为研究热点细胞,源井生物也对其培养体系、基因敲除体系进行了深入的探究,并已在HT-29细胞的基因敲除实验中实现蛋白层面的完全敲除。
如何利用HT-29细胞
目前HT-29细胞被广泛用于各种基本的细胞生物学和生物医学研究,包括结直肠癌增殖、相应抑制剂的研究、肿瘤形成和转移等等。
(1) 新合成药物在生物医学领域的应用研究:例如以HT-29细胞为模型,研究以Abutilon indicum叶提取物为原料制备多酚稳定胶体金纳米颗粒对结肠癌细胞的细胞毒作用机制[1]。
(2) 食品工业残留物应用研究:有研究发现果汁生产残留物能有效抑制HT-29细胞增殖,并在不同阻滞点G1、G2/M和S中诱导细胞周期阻滞[2],这对抗结肠癌的药物研发有一定的推动作用。
(3) 完善结肠癌形成的分子机制:例如,脯氨酰4 -羟化酶、β多肽(P4HB)与结肠癌的发生有关,研究发现P4HB敲低能降低信号转换器和转录激活因子3 (STAT3)的激活,并促进活性氧(ROS)的积累,进而诱导HT-29细胞凋亡[3]。
(4) 天然发酵产物对结肠癌细胞的作用研究:例如,研究发现天然发酵产物Lactobacillus acidophilus CICC 6074 S-layer 蛋白处理后细胞出现染色质凝结、核碎裂、液泡等凋亡特征变化,该蛋白可能通过死亡受体凋亡途径和线粒体途径诱导HT-29细胞凋亡,并通过抑制PI3K/AKT通路和FasL通路的合成来抑制细胞侵袭[4]。
CRISPR/Cas9技术在HT-29细胞中的应用
CRISPR/Cas9技术是一种高度特异性的基因编辑方法,可以在细胞或个体层面引发基因序列的缺失、序列插入和定点突变等,使用催化活性失活的dCas9可以阻断转录进而抑制基因表达。 CRISPR/Cas9技术在HT-29细胞中也有广泛的应用,比如研究发现在HT-29细胞和原发人结肠癌细胞中通过shRNA诱导周期蛋白依赖性激酶(CDK)样激酶p38γ沉默或CRISPR/ cas9介导的p38γ敲除,都能抑制细胞的生长、增殖和迁移,并显著诱导细胞的凋亡[7]。
下面具体介绍一个利用CRISPR研究直肠癌细胞耐药机制的案例[8],便于大家开拓思路。药物治疗是结直肠癌患者治疗的一种方式,但是持续用药会造成结直肠癌细胞耐药。5-氟尿嘧啶(5-FU)是一种人工合成的核苷酸类似物,自20世纪50年代以来一直作为CRC患者化疗的主要药物,主要通过抑制胸苷酸合酶并将其代谢产物掺入DNA,从而导致细胞死亡。 此外,oxaliplatin也可用于结直肠癌患者的药物治疗,该药物属于第三代铂类药物,能够形成铂- DNA复合物引发细胞毒性。
Jinming Yu等人分别利用5-FU和oxaliplatin长时间处理的方式建立了HT-29和SW480耐药细胞株。通过Western blot实验发现REV7(转译合成聚合酶ζ(POLζ)的关键组成部分)在5-FU和oxaliplatin耐药的CRC细胞中均上调(Fig 1. a-d),且在随着药物处理浓度的增加,HT-29和SW480中的REV7也呈现递增的趋势,表现出剂量依赖性(Fig 1. e-h)。但有趣的是,药物处理后,REV7 mRNA的表达没有显著的差异,也就意味着REV7蛋白的增加不是转录水平的变化引起的。
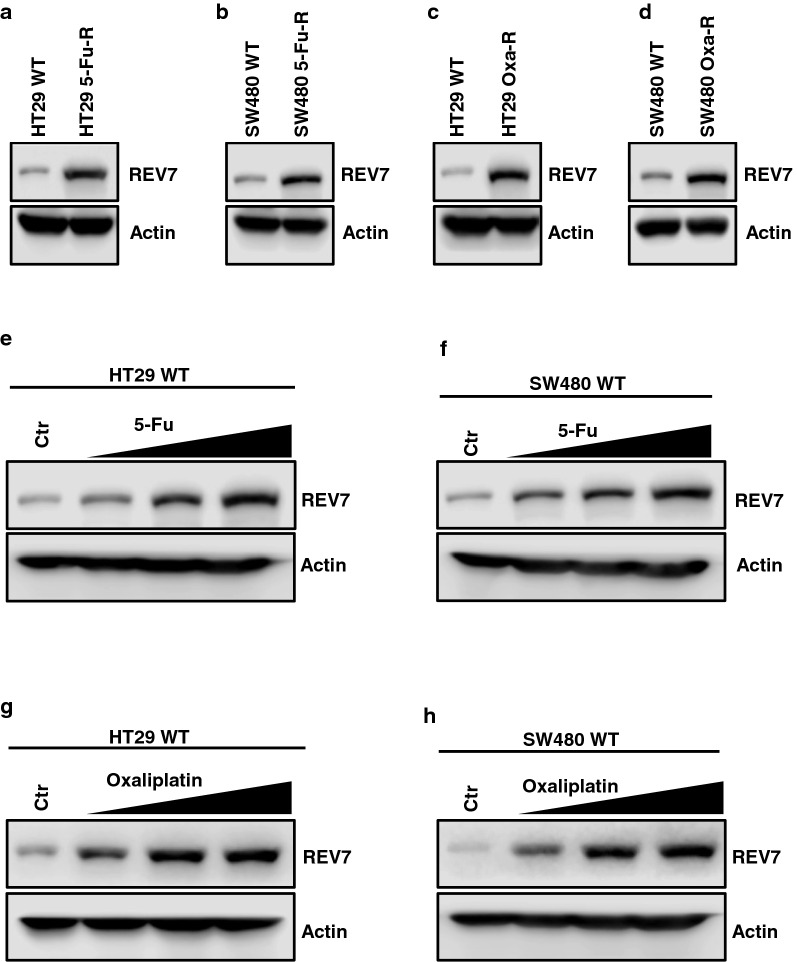
Fig 1.
随后,Jinming Yu等人利用CRISPR/Cas9技术特异靶向REV7基因,发现在药物处理条件下,REV7在REV7缺失细胞株中几乎不表达(Fig 2. a-b)。plasmid-based TLS efficiency分析发现REV7缺失显著抑制了耐药HT29细胞中的TLS(translesion synthesis)效率,而在补充REV7后,这一现象又会得到缓解(Fig 2. c-d)。
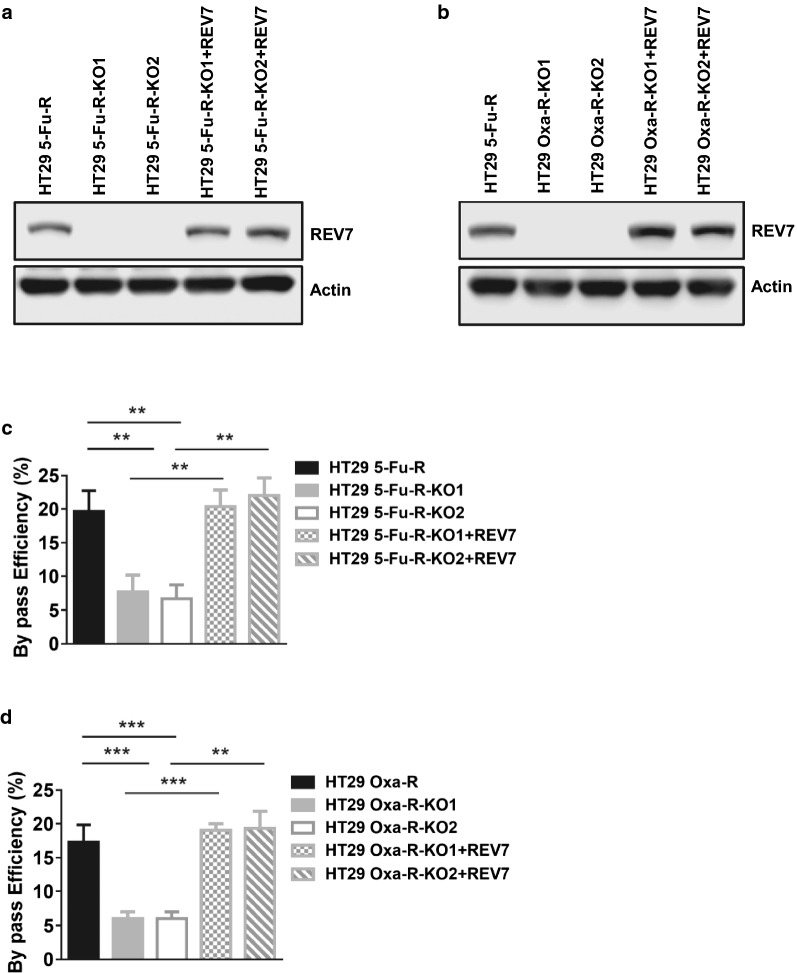
Fig 2.
在小鼠异种移植耐药细胞株模型实验中发现,当没有药物刺激的情况下,REV7的表达不影响肿瘤体积,说明REV7不影响结直肠癌的发生。当给予药物刺激时,REV7的缺失会明显抑制肿瘤生长,但在个体重量方面并没有显著差异(Fig 3.)。
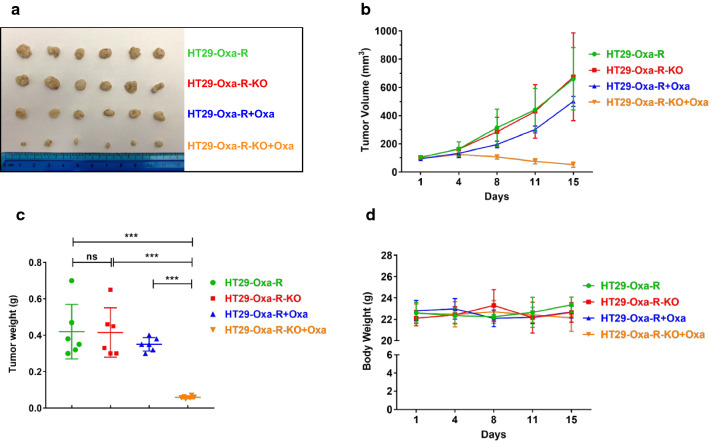
Fig 3.
综上,HT-29细胞作为经典的癌细胞模型对于结直肠癌的研究是十分重要的,而CRISPR/Cas9作为分子水平的研究手段,也起到了十分重要的作用。迄今为止,源井生物已成功利用独家技术专利CRISPR-UTM对包括HT-29细胞在内的超200种的热点细胞进行了基因编辑,并在全球范围内提供成熟优质的基因编辑服务。
参考文献:
[1] Sadras Sudha Rani, et al. Polyphenol stabilized colloidal gold nanoparticles from Abutilon indicum leaf extract induce apoptosis in HT-29 colon cancer cells[J]. Colloids Surf B Biointerfaces, 2016, 143: 499-510.
[2] Catarina M.M.Duarte, et al. Evaluation of Opuntia spp. derived products as antiproliferative agents in human colon cancer cell line (HT29)[J]. Food Research International, 2013, 54: 892-901.
[3] Zhang Qilin, et al. P4HB knockdown induces human HT29 colon cancer cell apoptosis through the generation of reactive oxygen species and inactivation of STAT3 signaling[J] .Mol Med Rep, 2019, 19: 231-237.
[4] Yuxing Guo, et al. Effect of Lactobacillus acidophilus CICC 6074 S-Layer Protein on Colon Cancer HT-29 Cell Proliferation and Apoptosis[J]. J Agric Food Chem, 2020, 68: 2639-2647.
[5] Yaguang Xi, et al. CRISPR/cas9, a novel genomic tool to knock down microRNA in vitro and in vivo[J]. Sci Rep, 2016, 6: 22312.
[6] Jinke Wang,et al. Cancer gene therapy by NF-κB-activated cancer cell-specific expression of CRISPR/Cas9 targeting to telomere. doi: https://doi.org/10.1101/553099
[7] Yiou Cao, et al. Targeting p38γ to inhibit human colorectal cancer cell progression[J].Biochem Biophys Res Commun. 2019 Sep 10;517(1):172-179. doi: 10.1016/j.bbrc.2019.07.038.
[8] Jinming Yu, et al. Targeting REV7 effectively reverses 5-FU and oxaliplatin resistance in colorectal cancer[J].Cancer Cell Int, 2020, 20: 580.










