HCT116细胞与CRISPR/Cas9结合——结直肠癌治疗研究的绝佳拍档


HCT116细胞与CRISPR/Cas9结合——结直肠癌治疗研究的绝佳拍档
细胞背景与应用现状
1. 细胞背景:
HCT116细胞是由M·Brattain等人于1979年从一位患结直肠癌的48岁男性病人中分离得到的。该细胞在半固体琼脂糖培养基中形成克隆,在无胸腺裸鼠中有致瘤性,形成上皮样的肿瘤,属于上皮样贴壁生长的肿瘤细胞系。
2. 应用范围和前景:
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤之一,在恶性肿瘤中发病率位居第三,死亡率位居第二,根据 GLOBOCAN 数据显示,2018 年全球结直肠癌新增 185 万例,约 88 万人死亡,给人类健康带来了巨大威胁。[1]因此,研究结直肠癌的发病机制以及治疗手段对临床诊断和治疗结直肠癌具有十分重要的意义。目前,在药物开发的最初级阶段即细胞生物学水平的鉴定中,HCT166细胞已成为结直肠癌研究领域中被广泛使用的模式细胞,具体应用举例如下:
(1) 探究药物影响结直肠癌细胞增殖,迁移和侵袭的机制。例如:PPARα在白霉素处理的HCT116细胞迁移活性及CYP2S1和CYP1B1的表达中起重要作用[2]
(2) 探究药物影响结直肠癌细胞生长的体外作用机制,如细胞凋亡和细胞周期改变等。例如:Raddeanin A通过PI3K/AKT通路调控人HCT116细胞凋亡和周期阻滞[3]
(3) 探究药物对结直肠癌治疗的敏感性和耐药性。例如:Doxorubicin抑制HCT116细胞中miR-140的表达而上调PD-L1,从而使肿瘤细胞对药物产生耐药性[4]
(4) 开发新的癌相关信号通路,为临床治疗结直肠癌提供指导:例如,研究Notch和Wnt信号通路在结直肠癌细胞HCT116耐药中的意义等[5]
(5) 开发LncRNA和miRNA在结直肠癌治疗中的新途径。例如:在HCT116细胞中,YWHAE长链非编码RNA通过激活K-Ras/Erk1/2和PI3K/Akt信号通路与miR-323a-3p和miR-532-5p竞争,为结直肠癌的治疗提供新的靶位点[6]
CRISPR/Cas9技术在HCT116细胞中的应用
如上所述,HCT116细胞在结肠癌的各种机制都具有重要的研究价值,而最基本的研究思路一般都从分子层面即基因或蛋白开始,因此CRISPR/Cas9技术的身影也就理所当然地出现在许多研究课题中,毕竟它在研究致癌相关的单基因功能中有着无可替代的优势。
如发现TRPM4在人结直肠癌中高表达,似乎与结直肠癌细胞的增殖、细胞周期和侵袭有关,通过在HCT116细胞中利用CRISPR/Cas9技术对TRPM4基因敲除后发现肿瘤细胞的迁移和侵袭的确都降低了,同时伴随着细胞周期的改变[7]; 以及Cell报道利用CRISPR/Cas9技术,将野生型KRAS替换为突变型使得杂合突变的HCT116细胞对药物治疗更为敏感[8]; 再如利用CRISPR/Cas9技术对HCT116细胞中的Tks4基因敲除,表现出显著的上皮间质转化,细胞运动增加,细胞间的粘附程度降低,发现Tks4基因在EMT调控和肿瘤发展中发挥重要作用[9]; 发现CTC1L1142H突变导致端粒酶维持受损,研究人员利用CRISPR/Cas9技术对HCT116细胞中的CTC1点突变,证实了CTC1:STN1相互作用为抑制端粒酶活性所必需[10]。
可以看出,研究人员对于CRISPR/Cas9技术的青睐是毋庸置疑的,源井生物提供的CRISPR/Cas9技术服务也为众多科研人员解决了实验难题,如细胞基因敲除不彻底、细胞基因敲入不稳定等等,让更多科研人员能顺利实现他们的科研目标。
案例分析
1. 基因点突变[11]
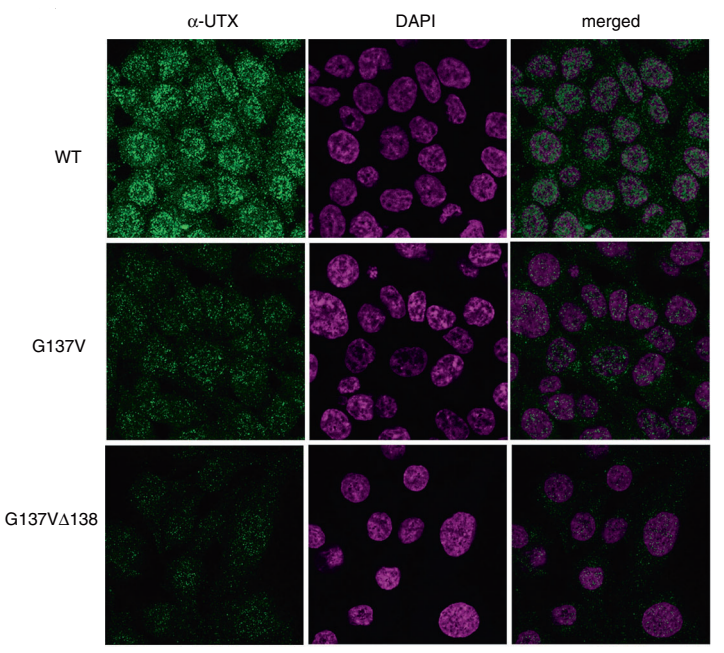
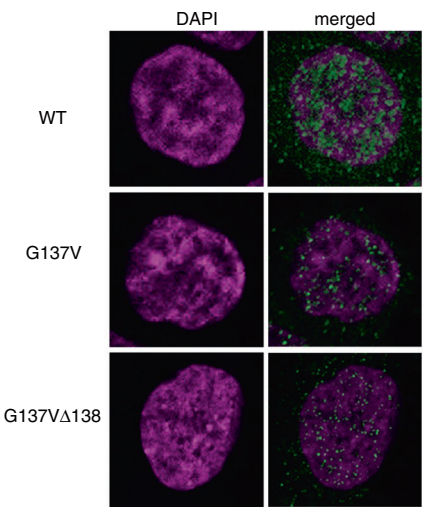
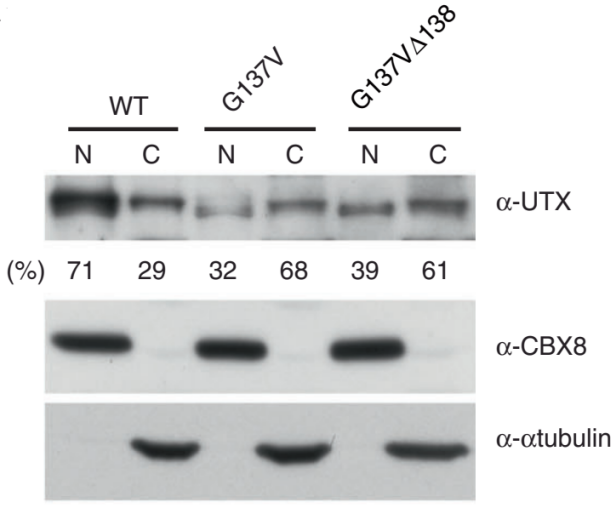
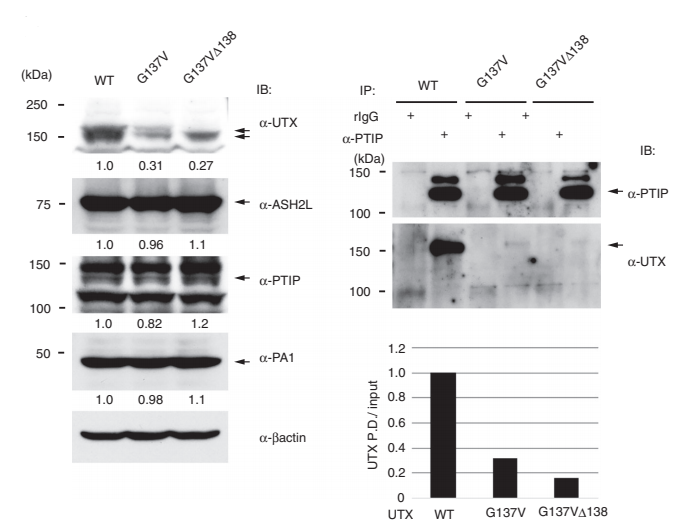
Hiroyuki Kato等研究者利用CRISPR/Cas9技术在HCT116细胞中突变了UTX基因第137和138位氨基酸:G137V和 G137VΔ138,发现原本表达于细胞核的野生型UTX,在两种突变株的细胞核中表达量大大降低了,而在细胞质中的表达增加了,如图A-C所示:A,B为免疫荧光图片,C为Western Blot结果;免疫共沉淀的结果如图D所示,这是一种新的UTX调控机制,文章中还进一步揭示了UTX与MLL3/4复合物(ASH2L, PTIP and PA1是MLL3/4复合物的成分)相互作用在癌症形成中的重要性。
2. 基因敲除[12]
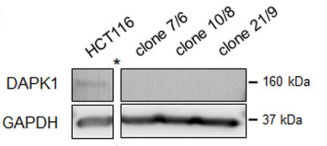
Sara Steinmann等人利用CRISPR/Cas9基因编辑技术获得了DAPK1缺失型的HCT116单克隆细胞系,最终揭示了DAPK1对结直肠癌侵袭性的影响。
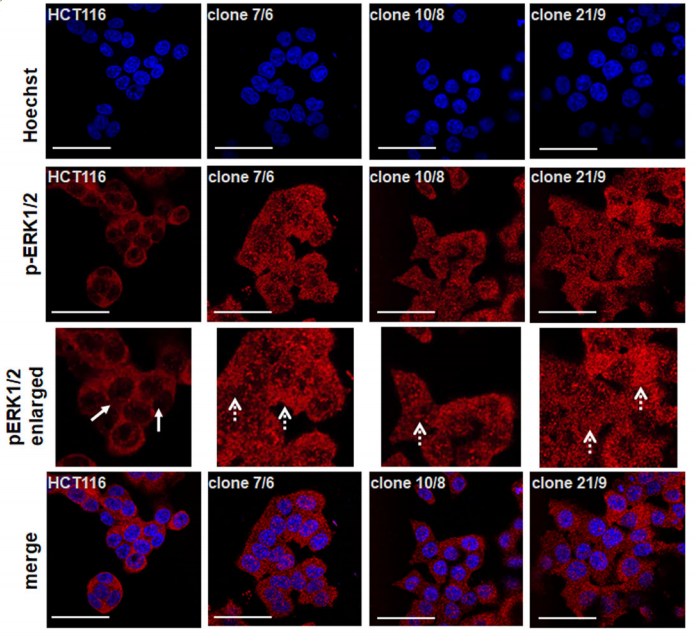
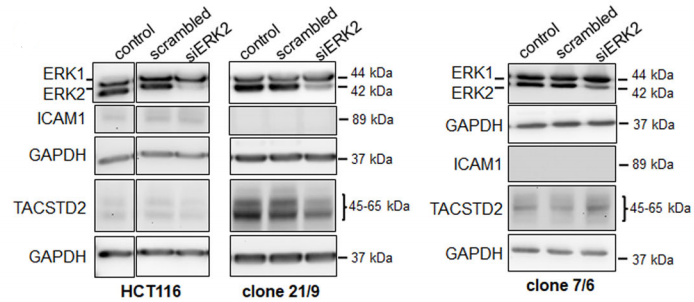
经过Western Blot验证,Sara Steinmann等人得到了三种DAPK1基因敲除型单克隆细胞(如图A所示)。免疫荧光实验检测pERK1/2主要位于野生型HCT116细胞质,然而在三种基因敲除型细胞中,pERK1/2均在细胞核中显著表达。(如图B所示)
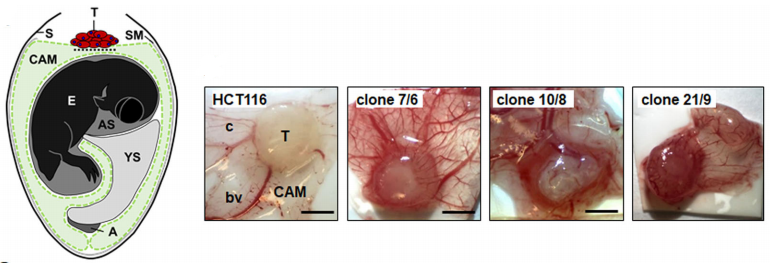
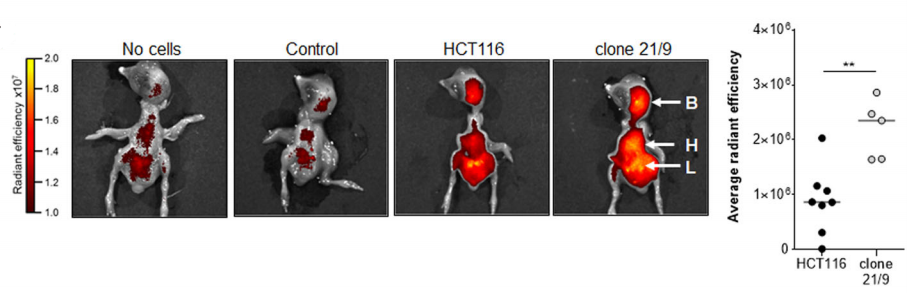
由于绒毛膜尿囊膜模型(CAM)实验是血管生成的经典体内模型,研究人员将DAPK1基因敲除型克隆和野生型HCT116细胞移植到鸡CAM上,并在蛋中培养5天,发现DAPK1的缺失导致CAM体内生长模式的改变和肿瘤出芽的增强(如图C所示)
此外,该研究团队利用大鼠脑3D体外模型发现肿瘤细胞在鸡胚胎器官中有更多的扩散,并且侵袭能力也增强了。DAPK缺失型HCT116细胞表现出更多的弥散性肿瘤细胞,并优先在鸡胚的肝、心、脑中积累(如图D所示)。最后,研究人员发现DAPK1-ERK1信号通路参与了CRC的转移过程(如图E所示)。
3. 基因敲入[13]
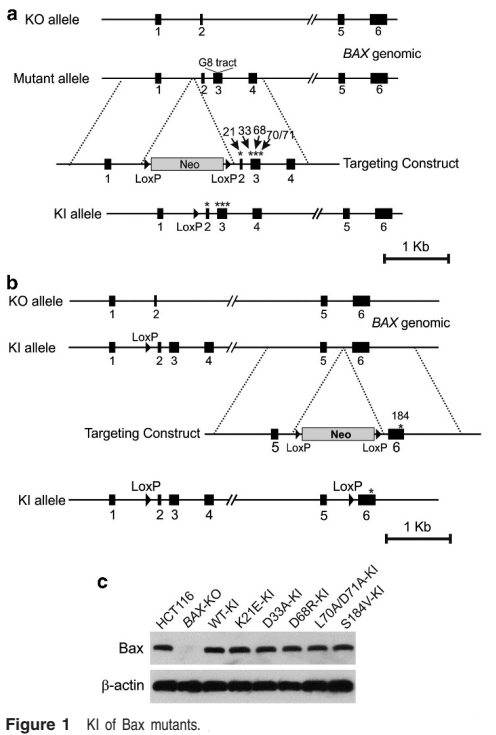
Bax是促凋亡Bcl-2基因家族成员之一,在线粒体依赖的凋亡起始中发挥重要作用,R Peng等研究人员在BAX-KO HCT116细胞中敲入了5种位于Bax基因上且与Bcl-2其它成员有相互作用的突变位点。
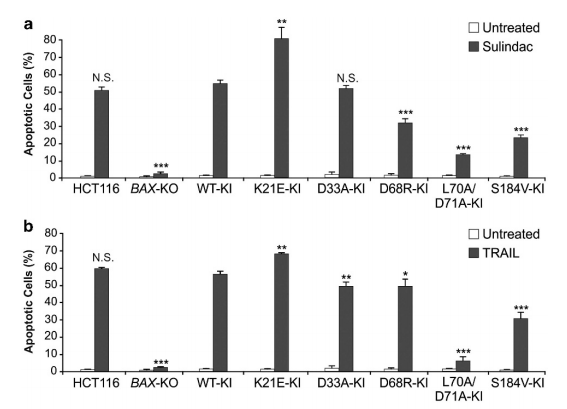
已有文献报道BAX-KO HCT116细胞在一种甾醇类药物 sulindac的刺激下并不会发生凋亡,而R Peng等研究人员发现在BAX-KO HCT116细胞中敲入WT BAX能恢复sulindac和TRAIL引起的HCT116细胞凋亡;敲入K21E和D33A突变,Bax介导的凋亡被完全恢; 敲入D68R和 S184V突变只恢复了一部分,而敲入L70A/D71A突变恢复药物引起的凋亡程度更低。
该研究是在目的基因敲除了的目的细胞的基础上,再进行含有突变位点的目的基因敲入以及WT目的基因敲入(作为对照),便可清晰地了解目的基因表达的蛋白和与之相互作用的其它蛋白间相互作用的特定位点关系,是一个验证通过生物信息学分析得到的预测位点是否在蛋白质相互作用中真实起作用的好方法。因此,源井生物也为科研人员提供了相应的服务便利,在享受细胞基因敲入服务的同时,还会得到我们赠送的基因敲除细胞,满足科研人员的各种研究需求。
源井生物的独家专利技术CRISPR-U™以及5000多例成功案例经验,让我们的基因编辑服务更有保障。
参考文献:
[1] Bray, Freddie et al. “Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.” CA: a cancer journal for cliniciansvol. 68,6 (2018): 394-424. doi:10.3322/caac.21492
[2] Khor CY, Khoo BY. PPARα plays an important role in the migration activity, and the expression of CYP2S1 and CYP1B1 in chrysin-treated HCT116 cells. Biotechnol Lett. 2020;42(8):1581-1595. doi:10.1007/s10529-020-02904-
[3] Meng C, Teng Y, Jiang X. Raddeanin A Induces Apoptosis and Cycle Arrest in Human HCT116 Cells through PI3K/AKT Pathway Regulation In Vitro and In Vivo. Evid Based Complement Alternat Med. 2019;2019:7457105. Published 2019 May 26. doi:10.1155/2019/7457105
[4] Naba NM, Tolay N, Erman B, Sayi Yazgan A. Doxorubicin inhibits miR-140 expression and upregulates PD-L1 expression in HCT116 cells, opposite to its effects on MDA-MB-231 cells. Turk J Biol. 2020;44(1):15-23. Published 2020 Feb 17. doi:10.3906/biy-1909-12
[5] Kukcinaviciute, Egle et al. “Significance of Notch and Wnt signaling for chemoresistance of colorectal cancer cells HCT116.” Journal of cellular biochemistry vol. 119,7 (2018): 5913-5920. doi:10.1002/jcb.26783
[6] Bjeije, Hassan et al. “YWHAE long non-coding RNA competes with miR-323a-3p and miR-532-5p through activating K-Ras/Erk1/2 and PI3K/Akt signaling pathways in HCT116 cells.” Human molecular genetics vol. 28,19 (2019): 3219-3231. doi:10.1093/hmg/ddz146
[7] Kappel, Sven et al. “TRPM4 is highly expressed in human colorectal tumor buds and contributes to proliferation, cell cycle, and invasion of colorectal cancer cells.” Molecular oncology vol. 13,11 (2019): 2393-2405. doi:10.1002/1878-0261.12566
[8] Szeder, Bálint et al. “Absence of the Tks4 Scaffold Protein Induces Epithelial-Mesenchymal Transition-Like Changes in Human Colon Cancer Cells.” Cells vol. 8,11 1343. 29 Oct. 2019, doi:10.3390/cells8111343
[9] Burgess, Michael R et al. “KRAS Allelic Imbalance Enhances Fitness and Modulates MAP Kinase Dependence in Cancer.” Cell vol. 168,5 (2017): 817-829.e15. doi:10.1016/j.cell.2017.01.020
[10] Gu, Peili et al. “CTC1-STN1 coordinates G- and C-strand synthesis to regulate telomere length.” Aging cell vol. 17,4 (2018): e12783. doi:10.1111/acel.12783
[11] Kato, Hiroyuki et al. “Cancer-derived UTX TPR mutations G137V and D336G impair interaction with MLL3/4 complexes and affect UTX subcellular localization.” Oncogene vol. 39,16 (2020): 3322-3335. doi:10.1038/s41388-020-1218-3
[12] Steinmann, Sara et al. “DAPK1 loss triggers tumor invasion in colorectal tumor cells.” Cell death & disease vol. 10,12 895. 26 Nov. 2019, doi:10.1038/s41419-019-2122-z
[13] Peng, R et al. “Targeting Bax interaction sites reveals that only homo-oligomerization sites are essential for its activation.” Cell death and differentiation vol. 20,5 (2013): 744-54. doi:10.1038/cdd.2013.4










