基因编辑RAW 264.7细胞系——助力炎症以及破骨细胞生成相关研究

基因编辑RAW 264.7细胞系——助力炎症以及破骨细胞生成相关研究
小鼠单核巨噬细胞白血病细胞(RAW264.7)被认为是巨噬细胞的最佳模型之一,因为该细胞能够进行胞饮和吞噬作用,在炎症、免疫、凋亡、肿瘤研究应用广泛。RAW264.7细胞在体外可以对刺激产生反应,并随后产生具有破骨细胞完全分化的特征的多核细胞,被广泛用于研究骨骼疾病如风湿性关节炎、骨质疏松症、骨质溶解、牙周炎等。
RAW264.7是单核细胞/巨噬细胞样细胞系,源自BALB/c 微小核糖核酸的Abelson白血病病毒转化细胞系。RAW 264.7是破骨细胞、炎症研究最常用的体外模型之一。
据报道,类风湿关节炎(RA)影响着全世界2100多万人。RA是一种影响关节的自身免疫性炎症疾病。它的特征是巨噬细胞和淋巴细胞浸润,滑膜成纤维细胞增殖,最终的关节破坏。巨噬细胞在RA发病机制中发挥重要作用。RA炎性滑膜中巨噬细胞数量高于正常关节,与关节疼痛和炎症的严重程度呈正相关。许多药物已经被批准用于治疗风湿性关节炎,基因或细胞疗法。
MicroRNA 155 (miR-155)在小鼠16号染色体和人类21号染色体的BIC基因中被发现。在临床和实验模型中,miR-155与RA的发病机制有关,因为它在RA患者的滑膜和滑膜液巨噬细胞中上调。siRNA干扰miR-155 (KD)可以抑制促炎细胞因子的产生。miR-155参与RA形成的机制可能是多方面的,其中之一是miR-155靶向Src同源性-2的3个未翻译区域,其中包含肌醇磷脂酶1 (SHIP1),炎症的负调节因子。因此,RA中升高的miR-155导致SHIP1水平降低,导致促炎细胞因子的产生升高。
研究者利用CRISPR/CAS9技术成功突变小鼠巨噬细胞RAW264.7内源性miR-155基因,获得miR-155基因组敲除(GKO)克隆。进一步分析表明,在LPS刺激下,miR-155 GKO克隆表达更高水平的SHIP1,但产生较少的促炎细胞因子。
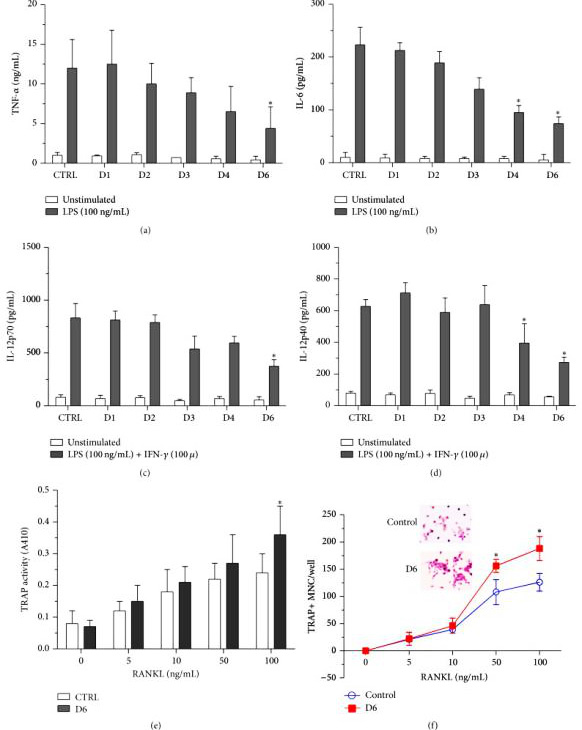
通过使用miR-155 GKO克隆,去除miR-155会导致巨噬细胞产生促炎细胞因子的减少,从而证实了之前的观察,即升高的miR-155有助于RA患者细胞因子产生的持续水平。通过将miR-155模拟物转染回GKO克隆,研究者能够重新引入miR-155效应。总之,这些结果表明,内源性miR-155基因的突变可能导致pre-miR-155产物被截断,无法成熟为更短但稳定的miR-155。
NLR家族蛋白NLRP3是外源性病原体和内源性损伤相关分子模式(DAMPs)的胞质传感器。NLRP3激活后,与适配器蛋白ASC和半胱氨酸蛋白酶caspase-1组装,形成NLRP3炎性小体,导致caspase-1的裂解和激活。活化的capase-1裂解IL-1的细胞因子和IL-18的前体,使其成熟,并导致几种促炎细胞因子的释放,包括IL-1的细胞因子和IL-183。据报道,NLRP3炎症小体在多种炎症疾病的发生和发展中起重要作用。抑制NLRP3炎症小体信号已被证明在减轻败血性休克、腹膜、阿尔茨海默病、动脉粥样硬化、T2D、多发性硬化、和痛风等疾病中有效。因此NLRP3炎性小体是治疗多种炎性疾病的一个极好的靶点。
利用CRISPR/Cas9在基因组水平上直接破坏关键分子-NLRP3,不仅可以完全抑制NLRP3炎症小体的激活,还可以避免抑制抗炎生物制剂和抑制剂的脱靶途径的潜在风险。研究CRISPR/Cas9敲除NLRP3的策略有望成为治疗多种炎症性疾病更有效的方法。
在这项研究中,研究者报道了一个系统的传递系统CRISPR/cas9 将mCas9和gNLRP3封装进CLAN中。CLAN是一种以PEG -b- PLGA为基础的纳米颗粒,辅以阳离子脂质BHEM - Chol,用于核酸治疗的递送。在之前的工作中,研究者们已经将小干扰RNA、RNA适配体和乙肝病毒CpG导入肿瘤细胞、心肌细胞、巨噬细胞或浆细胞样树突状细胞CLAN。
然而,mCas9/gNLRP3不同于其他核酸疗法,纳米颗粒的性质影响给药效率。为检测CLAN42是否能有效递送mCas9/gRNA,研究者将Cas9和增强绿色荧光蛋白(EGFP)共表达mRNA (Cas9-EGFP mRNA,或mCas9-EGFP)及阴性对照gRNA (gNC)封装到选择的CLANs(CLANmCas9-EGFP/gNC)中。用不同的CLANmCas9- EGFP/gNC转染骨髓源巨噬细胞(BMDMs)。转染组EGFP阳性的BMDMs百分比最高。接下来,研究者通过转染稳定表达GFP (Raw264.7-GFP)的Raw264.7细胞(巨噬细胞系)和包裹mCas9和gRNA靶向GFP (gGFP)的CLAN(CLANmCas9/gGFP)检测基因敲除效率。转染组中gfp敲除(KO) Raw264.7-GFP细胞比例最高,达53.9%。研究者通过向小鼠注射不同的CLANmCas9- EGFP /gNC进一步证实了CLAN42的体内mCas9/gRNA传递效率。注射组EGFPpositive腹膜巨噬细胞的百分比最高(48.4%)。综上所述,由于其巨噬细胞摄取能力最强,所以在mCas9/gRNA传递中,CLAN42是最有效的,并且CLAN42更适合包封mCas9/gNLRP3(记为CLANmCas9/gNLRP3)用于多种炎症性疾病的治疗。
因此,研究者通过调整聚合物中阳离子脂质BHEM-Chol的重量和PEG5K-b-PLGA11K的质量分数,建立了不同表面电荷和PEG密度的基团库。研究者在体外和体内都筛选了家族,并选择了一个更好的家族来将mCas9/gNLRP3导入巨噬细胞中,通过破坏巨噬细胞中的NLRP3来改善脓毒症休克,mCas9/gNLRP3诱导的腹膜炎和HFDinduced T2D。研究为CRISPR/Cas9进入巨噬细胞和治疗多种炎症性疾病提供了一个有前景的策略。
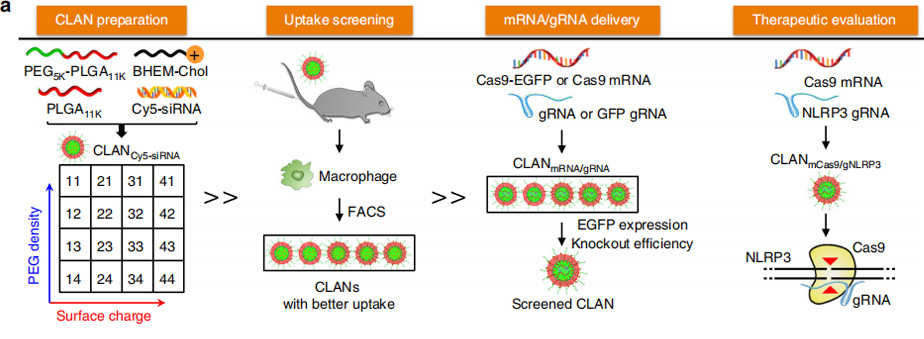
研究结果证明了CLANmCas9/ gNLRP3是一种很有前途的治疗NLRP3依赖性炎症性疾病的方法。研究也为通过纳米颗粒介导的免疫细胞基因编辑治疗免疫相关疾病提供了一个范例。
CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR / Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过100种细胞系上实现基因编辑。
参考文献
Jing W, Zhang X, Sun W, Hou X, Yao Z, Zhu Y. CRISPR/CAS9-Mediated Genome Editing of miRNA-155 Inhibits Proinflammatory Cytokine Production by RAW264.7 Cells. Biomed Res Int. 2015;2015:326042. doi:10.1155/2015/326042
Xu C, Lu Z, Luo Y, et al. Targeting of NLRP3 inflammasome with gene editing for the amelioration of inflammatory diseases.[J]. Nature Communications, 2018, 9(1).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6484317/










