RNAi和CRISPR,到底谁才是基因研究的“首选工具”?


RNAi和CRISPR,到底谁才是基因研究的“首选工具”?

shRNA vs gRNA:技术更迭中的较量
RNA干扰(RNAi)技术曾是分子生物学研究的主力军,尤其在基因功能研究、靶点筛选、抗病毒及抗肿瘤研究中扮演着关键角色。然而,随着脱靶效应等问题逐渐暴露,以及CRISPR/Cas9技术的快速崛起,RNAi的局限性逐渐凸显。 CRISPR系统以其更高的特异性、稳定的敲除效果以及更广的适用范围,迅速成为基因编辑领域的“新宠”。本篇将系统梳理RNAi与CRISPR的原理、优劣、应用差异以及未来发展趋势,助您更好地选择实验工具。
原理解析
将体外合成的gRNA与Cas9蛋白形成RNP复合物,并与单链寡核苷酸(ssODN)供体模板共转染入细胞。Cas9识别并切割目标位点,细胞利用ssODN通过HDR机制修复,完成碱基替换。
基本概念对比:shRNA vs gRNA
| 项目 | RNAi(shRNA/siRNA) | CRISPR/Cas9(gRNA) |
|---|---|---|
| 原理 | 靠RNA诱导沉默复合体(RISC)降解目标mRNA | 靠gRNA引导Cas9切割目标DNA |
| 效果 | 可逆性的基因敲低 | 不可逆的基因敲除 |
| 操作难度 | 操作相对简单,适合初级实验室 | 构建稍复杂,但稳定性更好 |
| 脱靶效应 | 易发生脱靶,干扰内源microRNA及非特异mRNA | 高特异性,脱靶风险较低 |
| 抑制效率 | 中低,蛋白水平变化不稳定 | 高效敲除,效果稳定 |
| 适用靶点类型 | 编码基因(mRNA),部分非编码RNA | 编码与非编码基因均可(如lncRNA、circRNA) |
RNAi的局限性:脱靶效应不是唯一问题
RNAi因其简便性被广泛使用,但其局限性不容忽视,尤其在以下几方面:
· 脱靶效应严重:如2009年关于蛋白激酶STK33的研究误导了癌症药物研发方向,源于RNAi干扰非靶mRNA所致。
· 表达调控不稳定:siRNA/shRNA可能下调效果不明显,甚至导致蛋白表达上调。
· 靶点选择有限:对于高度表达的转录本、核内非编码RNA等难以干扰。
· 重复性较差:不同实验、不同文库之间结果不易重现。
这些问题不仅影响研究准确性,也在国际期刊投稿中增加了质疑声和审稿难度。
CRISPR的优势:更稳定、更精准、更广谱
CRISPR技术的发展不仅提高了基因操作的精度,还扩大了研究的边界:
· 高特异性与低脱靶:Cas9酶的切割行为依赖gRNA与目标DNA的完美匹配及PAM序列识别,极大降低了非特异性干扰。
· 应用范围更广:不仅可用于基因敲除、激活,还能实现点突变、标签敲入、染色质结构研究等多种用途。
· 文库筛选更高效:Michael Bassik教授与Rene Bernards教授的对比研究显示,CRISPR文库在基因筛选中的命中率和重复性优于shRNA文库。
此外,CRISPR还催生了诸如CRISPRi(干扰)和CRISPRa(激活)等子技术,提供更灵活的调控方式。
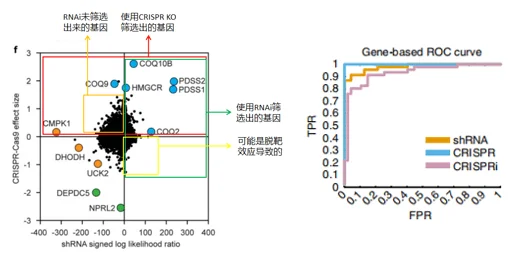
不是“你死我活”——RNAi与CRISPR可以互补
尽管CRISPR被认为在多数场景中优于RNAi,但RNAi依旧有其不可替代的角色:
· 暂时性调控:适合进行基因功能的短期观察或剂量效应研究。
· 无需改变DNA序列:适用于不希望基因永久改变的实验条件。
· 验证CRISPR表型:在某些研究中,shRNA可用于验证CRISPR观察到的表型是否为脱靶假象。
正如Rene Bernards所指出,理想的策略应结合两者的优势,尤其在临床前研究中,双重验证更具说服力。
源井生物:为您的科研方案保驾护航
源井生物拥有15年以上的基因调控平台研发经验,致力于为科研客户提供高效、个性化的一站式服务,助力每一位学者精准探索生命奥秘。
我们提供:
参考文献
[1] Combined shRNA over CRISPR/cas9 as a methodology to detect of-target efects and a potential compensatory mechanism.
[2]CRISPR knockout screening outperforms shRNA and CRISPRi in identifying essential genes.
[3] Systematic comparison of CRISPR/Cas9 and RNAi screens for essential genes.
[4] Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR.










