基因点突变立新功!基于PE技术改善盲鼠视网膜功能


Nature系列进展|基因点突变立新功!基于PE技术改善盲鼠视网膜功能
视网膜色素变性(RP)是最常见的遗传性视网膜营养不良,全球发病率约1/4000,以视杆细胞(暗光视觉)先退化、视锥细胞(色觉 / 强光视觉)后退化为特征,患者青少年期夜盲,青年期丢失周边视野,最后丧失中心视力。目前该病仍无有效根治手段。
2025年3月10日,上海交通大学附属第九医院眼科范先群团队与哈佛大学David R. Liu团队合作的最新研究成果在《Nature Communications》上发表,他们针对无义突变视网膜色素变性(RP),设计了以双 AAV 为载体、搭载epegRNA 和 RT^ΔRnH的先导编辑器(PE),在经典 RP 模型rd1 小鼠中开展实验,实现了26.47±13.35% 的靶向编辑效率,且经 AID-Seq 和 PE-tag 验证无显著脱靶效应,成功将 PDE6B 蛋白表达恢复至野生型(WT)小鼠的 39%,保护视杆细胞免于退化,并通过视网膜电图(ERG)、明暗箱测试等功能实验证实,PE 系统可有效抑制 rd1 小鼠视力下降,为遗传性 RP 的基因组水平治疗提供了新方案。

一、研究背景
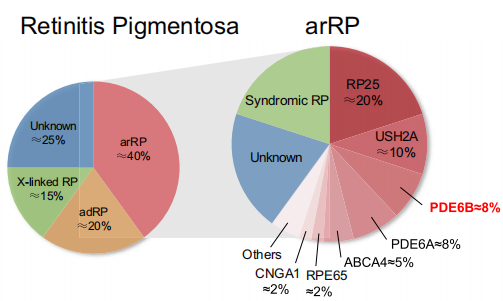
1. 视网膜色素变性(RP)
RP 具有高度遗传异质性,遗传模式主要分为三类:常染色体隐性遗传(arRP,约占 40%)、常染色体显性遗传(adRP,约占 25%)、X 连锁遗传(XLRP,约占 15%),剩余 20% 为散发病例。目前已发现 70 余个致病基因存在超过 3000 种遗传变异(数据来源于 RetNet 数据库),涉及光信号传导、视黄醇循环、光感受器细胞结构维持等关键生理过程;其中,PDE6B 基因(OMIM 180072)是 arRP 的主要致病基因之一,其突变会直接导致视杆细胞功能异常与凋亡。
2. 先导编辑器(PE)
PE技术作为下一代精准基因编辑技术,其优势体现在无需双链断裂(DSB),精准实现单碱基替换(不仅限于A>G或C>T),不引发大规模DNA损伤,安全性更高,适配更广泛的细胞类型和应用场景(包括难编辑的细胞系)。先导编辑系统主要由两个部分组成:
● 一个含有DNA切口酶(Cas9 nickase,nCas9)和工程逆转录酶(RT)的融合蛋白
● 另一个是PE向导RNA——pegRNA。
pegRNA是在sgRNA的基础上,在其3’末端增加了一段RNA序列,这段序列具有双重角色,一端作为逆转录引物结合位点(Primer Binding Site,PBS),另一端则是能与逆转录酶(RT)结合的逆转录模板(Reverse Transcriptase Templates,RTT),携带着认为设计的目标点突变或插入缺失突变。
二、研究设计与方法
1. PE 系统优化与载体构建
● 核心组件改进:
epegRNA:在常规 pegRNA 基础上添加 3'RNA 结构基序,防止 3' 延伸区降解,提升编辑效率。
RT^ΔRnH:截短 RNaseH 结构域(约 0.6kb)的逆转录酶,功能与全长 RT 相当,但减小载体体积,适配 AAV 递送。
载体系统:双 AAV2 载体(视网膜靶向性强),解决 PE 系统(约 6.3kb)超 AAV 单载体(最大容量~4.8kb)的问题:
| AAV 载体类型 | 携带元件 | 功能 |
|---|---|---|
| AAV2-PE-N | epegRNA、sgRNA、nCas9 氨基端(1-713aa) | 提供引导 RNA 与 Cas9 部分片段 |
| AAV2-PE-C | nCas9 羧基端(714-1368aa)、RT^ΔRnH | 提供 Cas9 剩余片段与截短逆转录酶 |
● 体外筛选:
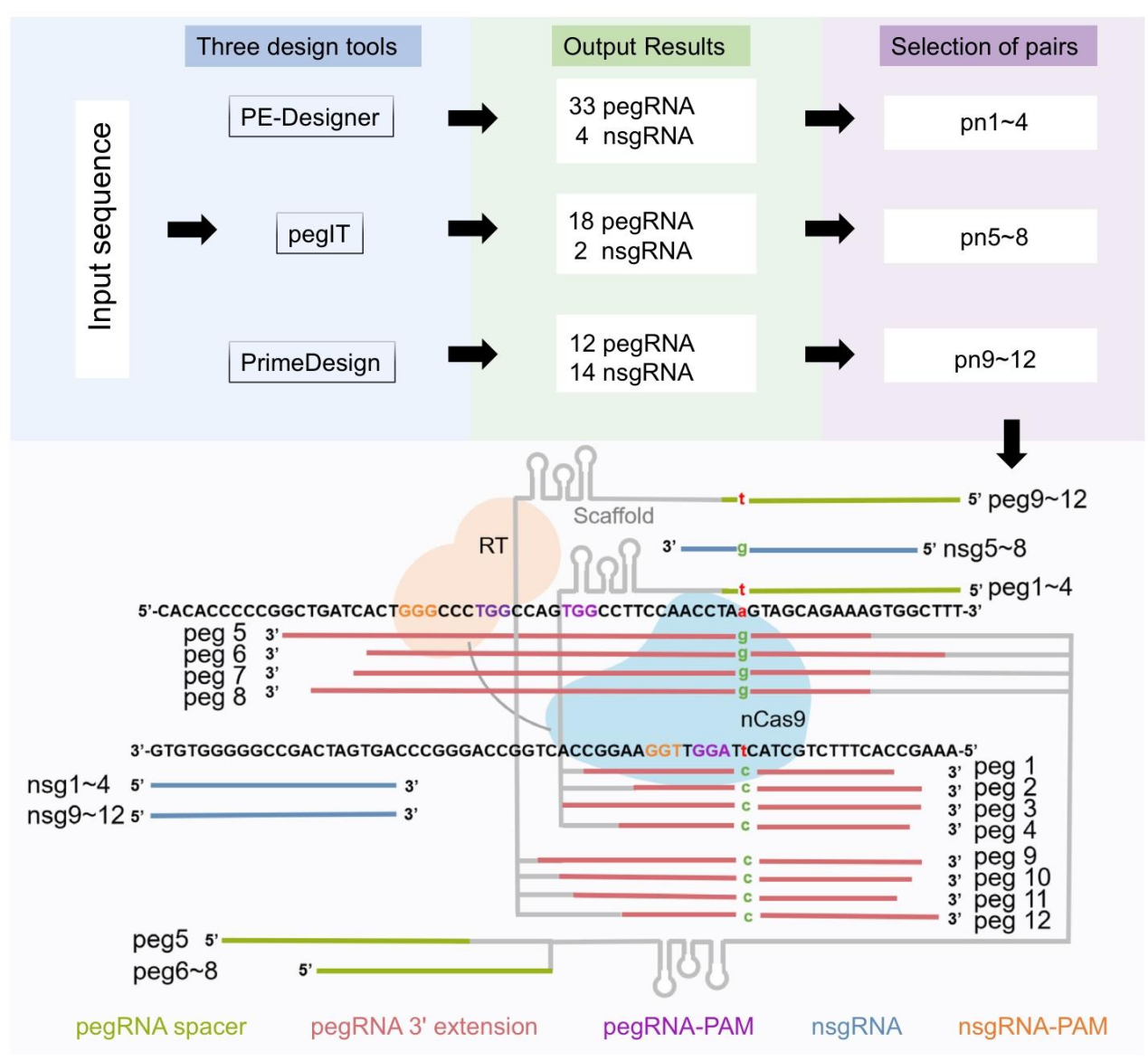
作者通过PE-Designer、pegIT、PrimeDesign 三个工具设计针对 Pde6b Y347X 突变的 pegRNA 和 nsgRNA,从每个工具中随机选取 4 组组合,得到 12 组候选(pn1-12),明确 PE 系统的编辑目标为将突变位点的 A 碱基纠正为 C 碱基,恢复 PDE6B 蛋白正常翻译。
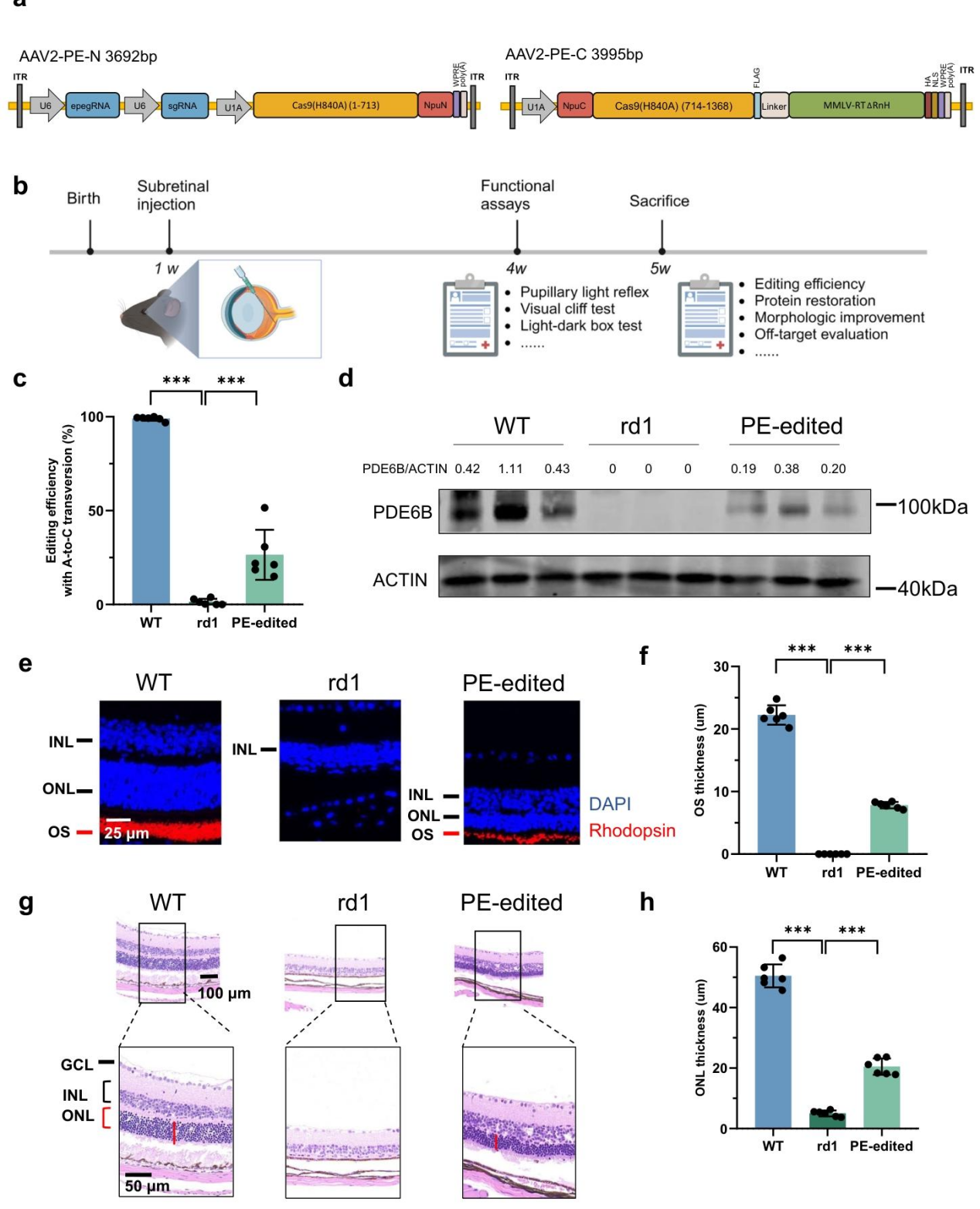
2. 体内实验流程
注射方案:1 周龄 rd1 小鼠(疾病发作前)视网膜下注射双 AAV 混合液(1μl,AAV2-PE-N 与 AAV2-PE-C 1:1 混合),无明显玻璃体出血或视网膜脱离。
检测时间点:注射后 4 周(小鼠 5 周龄,此时未治疗 rd1 小鼠视杆细胞几乎完全死亡),开展分子、形态、功能检测。
脱靶验证:采用AID-Seq(体外脱靶检测,降低假阳性)和PE-tag(最新全基因组脱靶检测技术),验证 PE 系统的安全性。
三、研究结果
1. 体外高效 pegRNA/nsgRNA 组合筛选
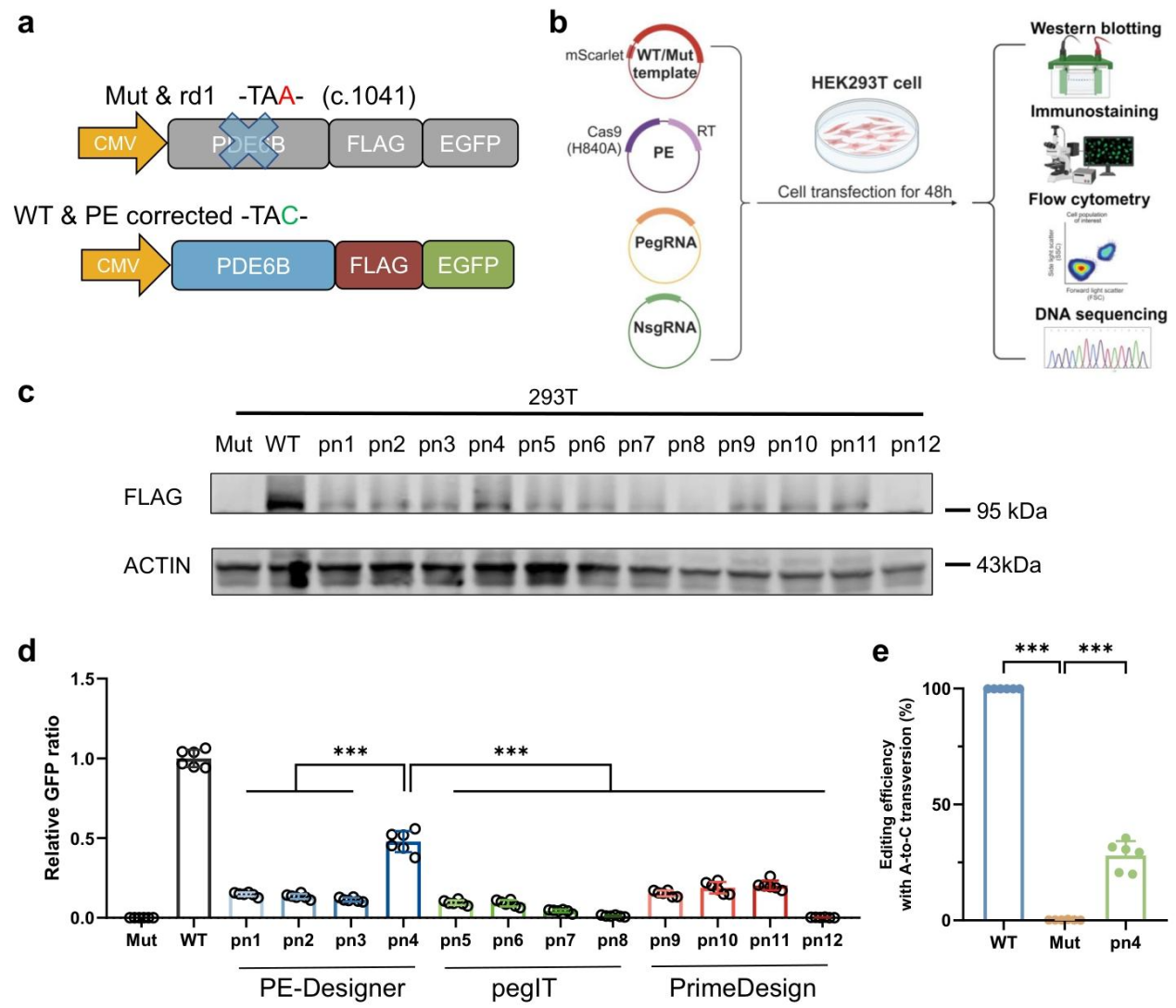
该研究构建含 Pde6b 第 7 外显子(野生型 / 突变型)、3xFlag 标签、EGFP 的报告质粒 —— 仅当 PE 成功去除终止密码子时,才能检测到 Flag 蛋白和 EGFP 信号,为筛选提供可视化指标。
作者将报告质粒(含 mScarlet 指示转染效率)与 PE 系统质粒(引导编辑器 + pn1-12)共转染 293T 细胞,48 小时后通过 Western blot、免疫染色等 4 种方法评估效率。Western blot结果显示,pn4 组的 PDE6B-Flag 蛋白表达量显著高于其他组,提示其引导 RNA 组合效率最优。通过对GFP比值定量发现,pn4 组相对 GFP 比值(GFP/mScarlet)显著高于其他 pn 组(***p<0.001),进一步验证其编辑效果。深度测序结果显示 pn4 组体外编辑效率达 27.96±6.27%(***p<0.001),最终确定 pn4 为后续体内实验的最优引导 RNA 组合。
2. PE 系统在 rd1 小鼠体内的精准编辑与光感受器保护
作者将 PE 系统拆分为 AAV2-PE-N(含 epegRNA、sgRNA、nCas9 氨基端)和 AAV2-PE-C(含 nCas9 羧基端、RT^ΔRnH),通过体内反式剪接重组为全长 PE,解决 AAV 容量限制(~4.8kb)问题。1 周龄 rd1 小鼠视网膜下注射双 AAV,5 周龄(注射后 4 周)进行功能检测并取材,此时未治疗小鼠视杆细胞已几乎完全退化。深度测序显示,PE 处理组目标位点 A→C 转换效率达 26.47±13.35%(*p<0.05,***p<0.001),且无其他非预期碱基改变,证实编辑精准性。Western blot结果显示 PE 处理组 PDE6B 蛋白表达量恢复至野生型小鼠的 39%,而未处理 rd1 小鼠未检出该蛋白,证实 PE 可恢复靶蛋白表达。通过抗视紫红质抗体免疫荧光实验发现PE 处理组视网膜视杆细胞(红色信号)显著存活,外节(OS)厚度达 20.48±2.69μm,显著高于未处理组(5.00±0.99μm,**p<0.01)。HE 染色也提示PE 处理组外核层(ONL,含光感受器细胞核)保留 4 层细胞核,厚度达 20.48±2.69μm(为野生型的 50%),而未处理组仅残留 1 层不完整细胞核,证实 PE 可显著延缓光感受器退化。
3. PE 系统体内脱靶效应评估
采用含发夹 i7 接头和生物素 i5 接头的 AID-seq 技术,降低假阳性,精准预测 peg4/nsg4 的潜在脱靶位点。AID-seq 筛选出 peg4 的 3 个潜在脱靶位点(如 chr10:87264608-87264631)和 nsg4 的 2 个潜在脱靶位点(如 chr9:57564452-57564475),均位于基因间区或内含子,无关键功能基因覆盖。深度测序显示,PE 处理组在上述潜在脱靶位点的 indel 率与未处理 rd1 小鼠无显著差异(ns);结合 PE-tag 检测(仅靶位点有高编辑活性),证实 PE 系统体内脱靶效应可忽略。
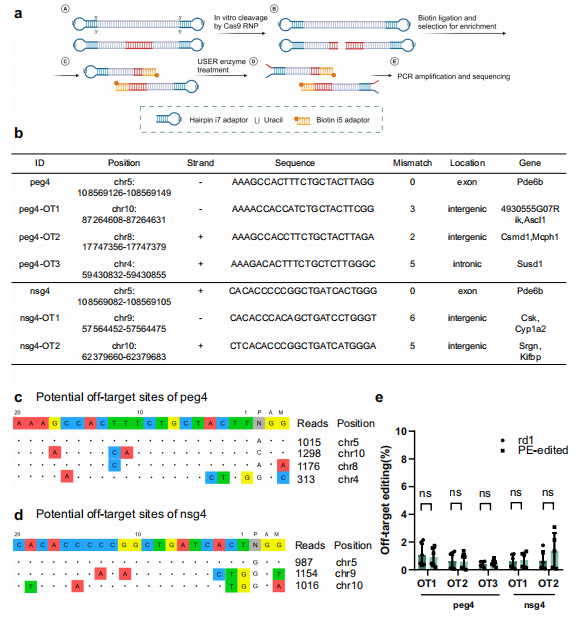
4. PE 系统对视网膜光信号传导相关基因表达的调控
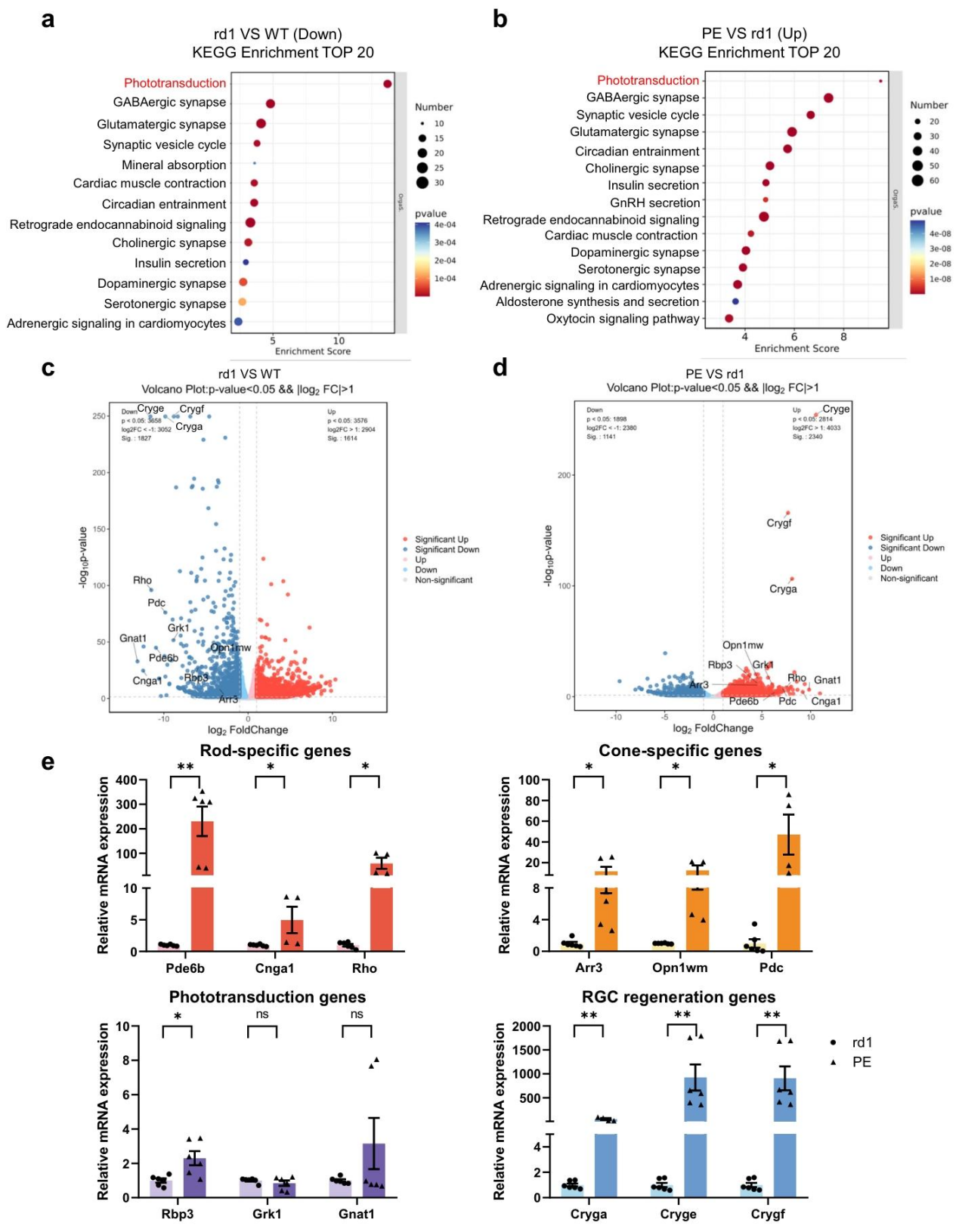
与野生型相比,rd1 小鼠视网膜光信号传导通路显著下调;而 PE 处理后,该通路显著上调(FDR<0.05),提示 PE 可修复视网膜功能相关通路。rd1 小鼠中光信号传导相关基因(如 Pde6b、Cnga1)显著下调;PE 处理后,这些基因表达显著回升(|log2 (FC)|>1,p<0.05)。
PE 处理组的视杆特异性基因(Pde6b、Cnga1、Rho)、视锥特异性基因(Arr3、Opn1mw)、光信号传导基因(Rbp3、Grk1)及视网膜神经节细胞(RGC)再生基因(Cryga、Cryge)的 mRNA 表达量,均显著高于未处理 rd1 小鼠,证实 PE 可全面恢复视网膜功能相关基因表达。
5. PE 系统对 rd1 小鼠视觉功能的修复
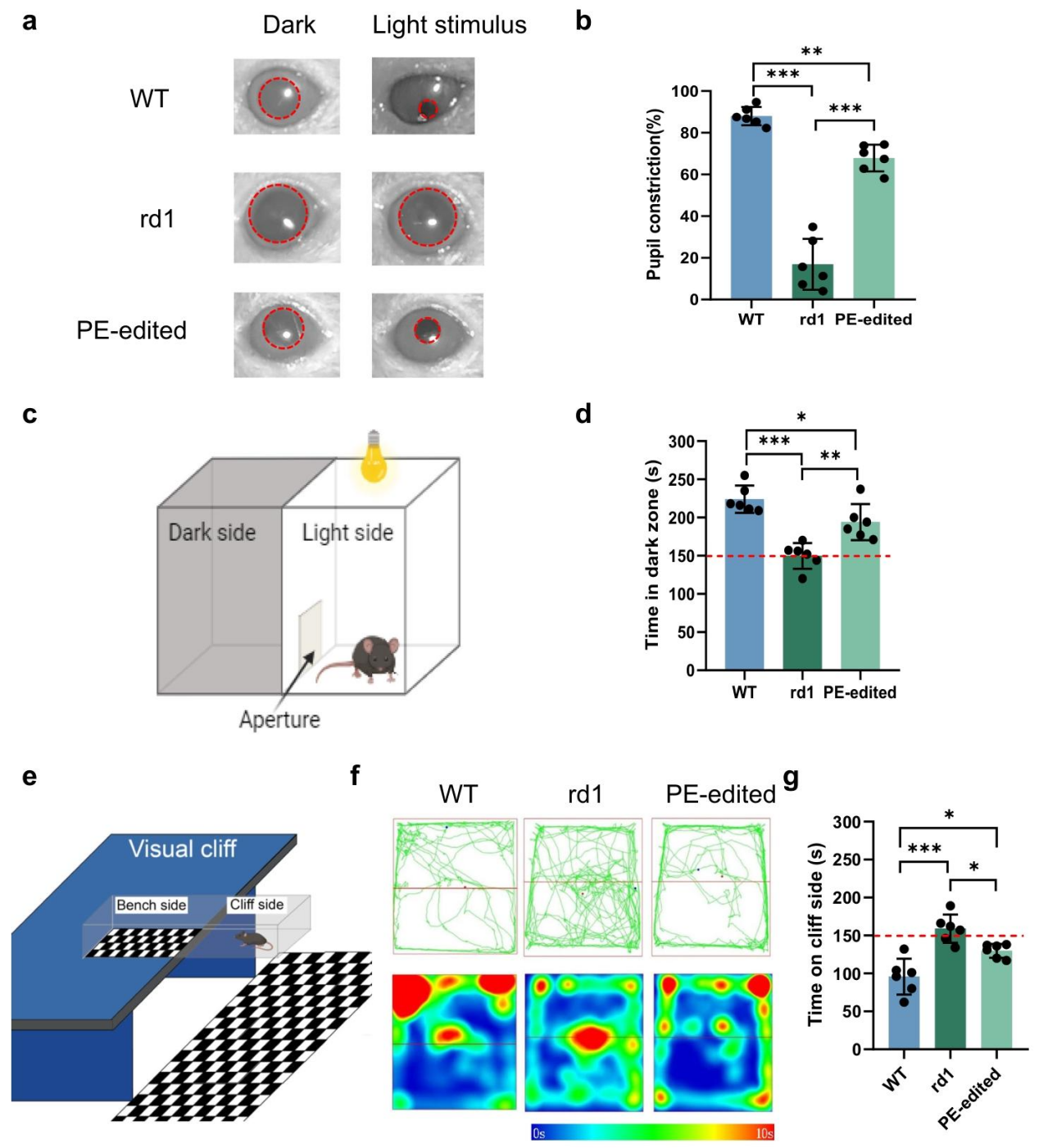
随后作者为了评估小鼠视觉功能的恢复情况,对小鼠的瞳孔光反射进行验证,结果发现,未处理 rd1 小鼠因光感受器丢失,瞳孔对光收缩反应微弱;PE 处理组瞳孔收缩率显著高于未处理组(***p<0.001),接近野生型水平,证实光反应能力恢复。根据小鼠天生偏好黑暗环境的特性,观察不同组小鼠在暗区的停留时间,作者观察到未处理 rd1 小鼠暗区停留时间(149.80±16.88s)显著低于野生型(224.00±17.75s);而PE 处理组暗区停留时间达 194.00±23.60s(**p<0.01 vs 未处理组),提示小鼠视觉介导的本能行为恢复。小鼠还拥有天生回避 “视觉悬崖”(模拟高空)的特性,依据这一特性,作者还比较了不同组小鼠在悬崖侧停留时间,结果显示未处理 rd1 小鼠在悬崖侧停留时间(159.00±18.74s)与 bench 侧无差异(无视觉辨别能力);PE 处理组悬崖侧停留时间降至 129.80±9.15s(*p=0.036 vs 未处理组),接近野生型(95.83±23.65s),证实小鼠的空间视觉功能恢复。更重要的是,PE 处理组 8 周后仍保持类似野生型的明暗箱行为(暗区停留 191.80±27.47s,**p=0.008 vs 未处理组),证实了疗效的长期性。
四、研究的意义
1. 技术可行性:成功构建以双 AAV 为载体、搭载 epegRNA 和 RT^ΔRnH 的 PE 系统,在 rd1 小鼠体内实现 26.47±13.35% 的精准编辑效率,且经 AID-seq 和 PE-tag 验证无显著脱靶效应,证实 PE 系统在眼部的安全性和有效性。
2. 分子与形态修复:PE 系统可恢复 rd1 小鼠 PDE6B 蛋白表达(达野生型 39%),保护视杆细胞免于退化 —— 外核层厚度达野生型 50%,光感受器结构显著改善。
3. 功能恢复:通过 ERG、瞳孔光反射、行为学测试等多维度验证,PE 处理可显著恢复 rd1 小鼠的暗视功能、光反应能力及视觉介导的本能行为,且疗效可维持至少 8 周。
4. 临床意义:首次证实 PE 可在 RP 模型中纠正 PDE6B 无义突变,为遗传性 RP 的基因组水平治疗提供新方案;同时,双 AAV-PE 系统的设计为其他眼部遗传性疾病的编辑治疗提供了可复用的技术框架。
源井生物在原有技术基础上自主创新,引入 U+ 分子,重磅升级为 EZ-HRex™ 精准点突变技术。升级后,细胞突变与片段敲入的 HDR效率全面提升,Cell Pool 水平 HDR 基因型占比高达 84%,显著提高构建成功率并缩短项目周期。平台支持 RNP、PE、BE 及质粒抗性筛选等多策略定制,适配多种细胞类型与复杂基因位点,仅需 ¥1.58W,最快 6周交付阳性克隆,为高难度基因编辑科研提供高效解决方案。
参考文献
Fu Y, He X, Ma L, Gao XD, Liu P, Shi H, Chai P, Ge S, Jia R, Liu DR, Fan X, Yang Z. In vivo prime editing rescues photoreceptor degeneration in nonsense mutant retinitis pigmentosa.
Nat Commun. 2025 Mar 10;16(1):2394. doi: 10.1038/s41467-025-57628-6. PMID: 40064881; PMCID: PMC11893901.











