源井助力揭秘脂肪与癌症关联—通过特定分子通路加剧TNBC转移风险


源井生物助力揭秘脂肪与癌症关联——橄榄油高脂饮食诱导的肥胖,通过特定分子通路加剧TNBC转移风险
根据世界卫生组织数据,乳腺癌已成为全球女性最常见的癌症。三阴性乳腺癌(TNBC)虽然仅占浸润性乳腺癌的15%,却导致约40%的乳腺癌相关死亡,是最具侵袭性的亚型之一。越来越多证据表明:肥胖与TNBC的不良预后密切相关。肥胖女性罹患TNBC的风险比正常体重女性高35%–50%,其转移和死亡风险也增加30%–40%。然而,肥胖与TNBC转移之间的分子机制仍不清晰。
10月7日,美国爱荷华大学AnthonyAvellino、BingLi等人的研究团队在《CancerResearch》上发表重要研究结果,论文题为“An Olive Oil-Based High-Fat Diet Promotes Obesity-Driven Metastasis of Triple-Negative Breast Cancer”。该研究旨在明确不同高脂饮食(HFD)诱导的肥胖对三阴性乳腺癌(TNBC)进展的影响及分子机制,研究中关键的敲除细胞Fabp5 Knockout cell line(4T1)和FABP5 Knockout cell line(MDA-MB-231)由源井生物提供,为解析FABP5在OA介导的PKC/ALDH通路激活及TNBC转移中的作用提供了核心细胞工具。研究通过小鼠模型、细胞实验及人类数据验证发现,与低脂饮食(LFD)相比,可可脂HFD与橄榄油HFD在小鼠中诱导相似程度肥胖,但仅橄榄油HFD会增加TNBC干细胞特性及肺转移;机制上,橄榄油HFD中的油酸(OA)通过激活蛋白激酶C(PKC)-乙醛脱氢酶(ALDH)通路促进TNBC转移,且TNBC细胞中的脂肪酸结合蛋白5(FABP5)是OA介导该通路激活的关键,多个小鼠模型中,FABP5缺失可减少TNBC转移,人类研究数据也显示FABP5高表达与TNBC患者不良预后相关;综上,该研究证实橄榄油HFD通过OA/FABP5驱动的致癌信号促进肥胖相关TNBC转移,为TNBC的精准饮食干预及靶向治疗提供了科学依据。

研究亮点
三阴性乳腺癌(TNBC)是一种侵袭性强、预后相对较差的乳腺癌亚型。它的名字来源于其病理学特征:在癌细胞上缺乏三种关键的蛋白质受体——雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)。好发于较年轻女性(尤其40岁以下),以及非洲裔或携带BRCA1基因突变的女性。而与体重正常的女性相比,肥胖(尤其是绝经后女性)罹患TNBC的风险更高。
肥胖常归因于热量摄入过多,尤其是高脂饮食。美国国家健康和营养检查调查(NHANES)显示,美国人日均摄入约2100千卡热量,其中40%来自脂肪,主要是饱和脂肪和单不饱和脂肪。由于人类饮食成分复杂,目前尚不清楚饱和脂肪和不饱和脂肪对肥胖流行的贡献是否相同,以及不同类型脂肪诱导的肥胖是否会对包括TNBC在内的肥胖相关疾病进展产生不同影响。
肥胖的特征是脂肪堆积和循环脂质升高,长链膳食脂肪酸因不溶性,需脂肪酸结合蛋白(FABPs)辅助溶解、运输和代谢。FABP家族至少有9个成员,具有组织特异性表达模式,如肠道中的FABP2、脂肪组织中的FABP4和上皮组织中的FABP5。研究表明FABP4与心血管疾病、糖尿病和乳腺癌等肥胖相关疾病有关;FABP5在上皮细胞和上皮源性肿瘤中高表达,可介导脂肪酸摄取、氧化并激活致癌信号通路(如PPARβ/δ),支持肿瘤进展和侵袭。且FABPs与不同饱和度脂肪酸结合时会发生变构,进而激活独特的脂肪酸介导的信号。因此本研究旨在揭示不同高脂饮食(HFD)诱导的肥胖对三阴性乳腺癌(TNBC)进展的影响及分子机制。
可可脂高脂饮食与橄榄油高脂饮食诱导的肥胖程度相似
研究团队首先探究了不同类型脂肪诱导的肥胖是否会对TNBC疾病进展产生不同影响,他们利用两种高脂饮食(均提供40%热量,分别来自富含饱和脂肪的可可脂和富含单不饱和脂肪的橄榄油),以低脂饮食(LFD)为对照,在BALB/c和C57BL/6小鼠模型中评估对肥胖的影响。结果显示,在BALB/c小鼠中,12周后两种高脂饮食组的体重和内脏脂肪均显著高于低脂饮食组;血清中葡萄糖和瘦素水平升高,胰岛素水平有升高趋势,脂联素和抵抗素水平无变化;外周血单个核细胞(PBMCs)的主要免疫细胞亚群比例和细胞因子产生谱无显著变化。在C57BL/6小鼠中也出现类似的结果,两种高脂饮食组体重增加相当,核磁共振(NMR)身体成分分析显示体脂含量相似增加,瘦体重相应减少;两种高脂饮食组脂肪库中参与脂肪生成和脂肪分解的基因表达均受抑制,外周免疫细胞比例及其细胞因子产生也无显著变化。这些结果表明饱和脂肪(可可脂)和单不饱和脂肪(橄榄油)诱导的高脂饮食在小鼠中能引发相似程度的肥胖,且对循环免疫细胞表型和功能影响极小。
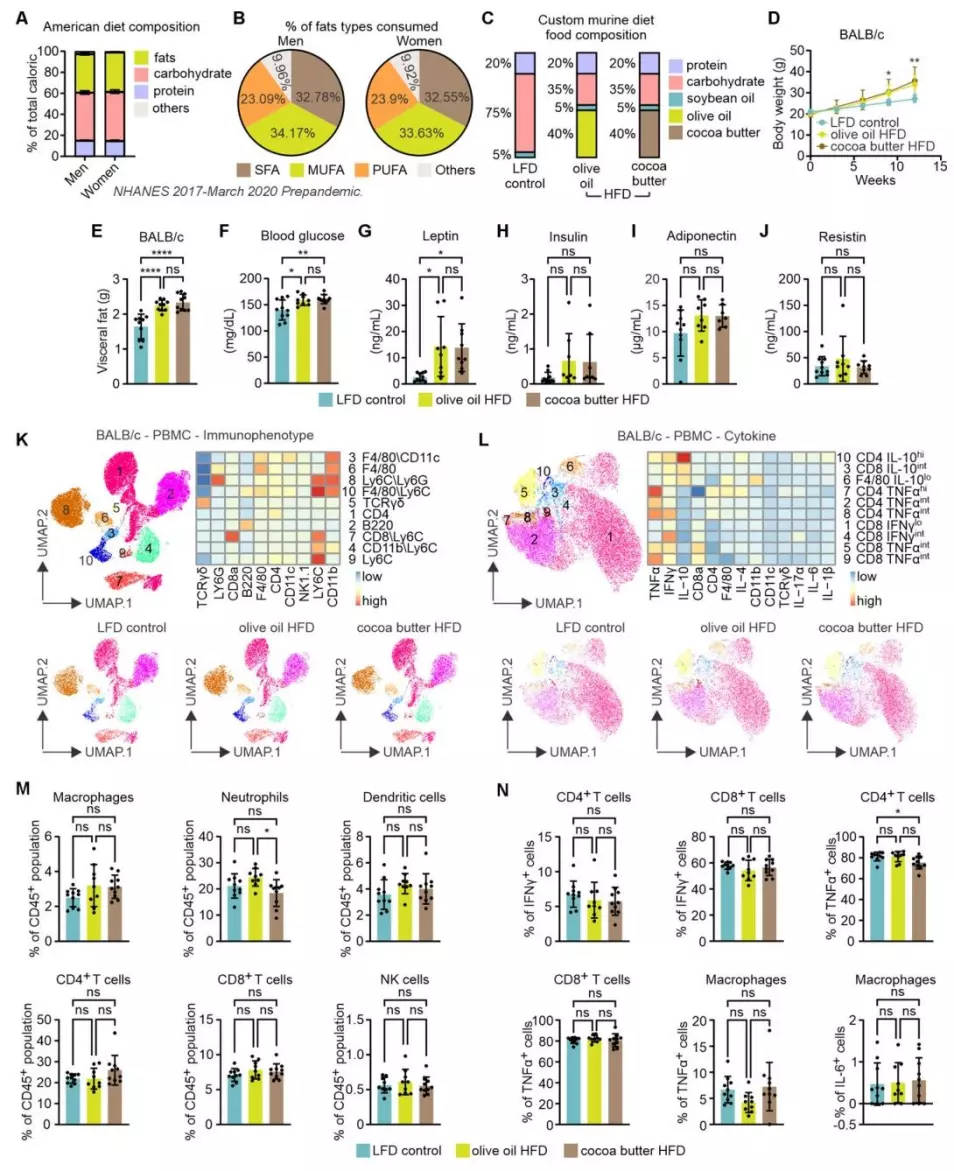
橄榄油高脂饮食诱导的肥胖促进TNBC肺转移,而可可脂高脂饮食无此作用
接下来研究者在免疫功能正常的BALB/c小鼠中植入4T1TNBC细胞,在免疫缺陷的NSG小鼠中植入人TNBC细胞系(MDA-MB-436、MDA-MB-231),分别喂食三种饮食,监测肿瘤生长和肺转移情况。在4T1TNBC模型中观察到,三组饮食的肿瘤生长曲线、肿瘤重量和大小无显著差异;但橄榄油高脂饮食组的肺重量更大、肺表面肿瘤结节更多、组织学染色显示转移灶更多、转移肿瘤面积更大;且该组肿瘤中乙醛脱氢酶(ALDH,乳腺癌干细胞和转移的标志物)活性显著更高。与4T1模型结果一致,MDA-MB-436模型的橄榄油高脂饮食不影响肿瘤生长曲线和最终肿瘤大小,但显著增加肺转移和肿瘤ALDH活性。MDA-MB-231模型结果显示,各组肿瘤生长和大小相当,橄榄油高脂饮食组肺转移显著升高,且在原位乳腺脂肪垫植入后第1天,循环肿瘤细胞数量就显著增加,但不影响肺血管通透性。此外,免疫谱分析显示各组肿瘤基质中的免疫细胞比例和细胞因子产生无显著差异。这些结果提示:橄榄油高脂饮食诱导的肥胖主要通过增强肺转移来促进TNBC进展,且这种增强的转移可能是由于对肿瘤细胞的直接作用,而非免疫介导机制,主要体现在增强肿瘤细胞的早期转移播种和侵袭能力。
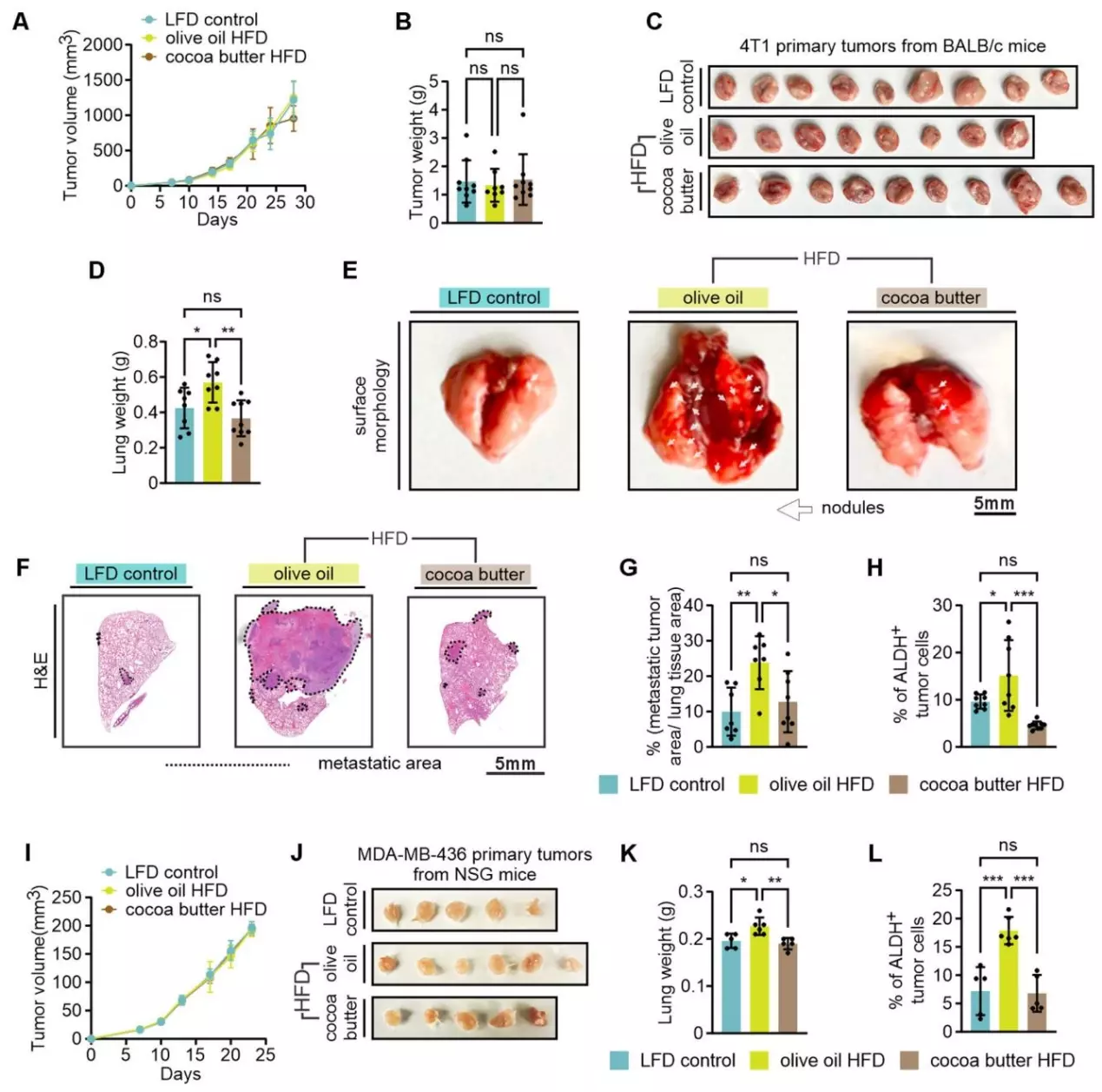
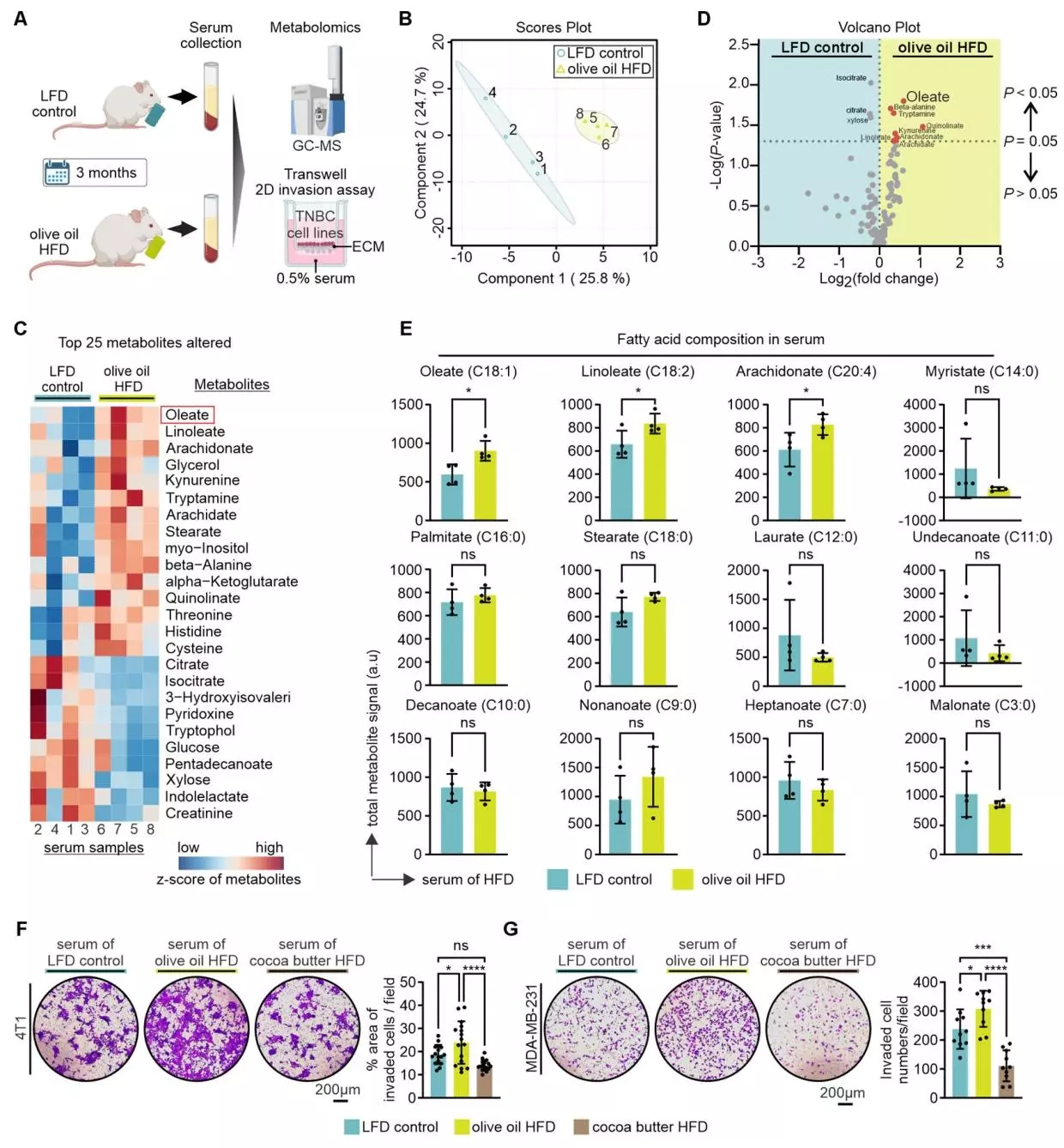
橄榄油高脂饮食喂养小鼠血清中升高的油酸(OA)增强TNBC侵袭
由于橄榄油中油酸含量较高,研究团队探究了橄榄油高脂饮食(HFD)诱导的肥胖是否通过升高血清油酸水平来促进三阴性乳腺癌(TNBC)转移。研究者们对橄榄油高脂饮食和低脂饮食喂养小鼠的血清进行代谢组学分析,并通过Transwell侵袭实验评估血清对TNBC细胞侵袭的影响。气相色谱-质谱(GC-MS)分析显示,橄榄油高脂饮食组小鼠血清代谢组学谱独特,不饱和脂肪酸(尤其是油酸、亚油酸、花生四烯酸)显著上调,其中油酸是与低脂饮食组相比最显著升高的代谢物,与可可脂高脂饮食组相比也显著升高;且油酸水平与亚油酸、甘油、花生四烯酸和肌醇等其他升高的代谢物呈正相关,涉及核苷酸生物合成、肌醇磷酸和不饱和脂质生物合成等通路;而饱和脂肪酸、氨基酸、糖酵解和三羧酸循环相关代谢物无显著差异。Transwell侵袭实验表明,橄榄油高脂饮食喂养小鼠的血清能显著促进4T1和MDA-MB-231TNBC细胞的侵袭,而可可脂高脂饮食和低脂饮食喂养小鼠的血清无此作用。上述结果表明橄榄油高脂饮食导致小鼠血清中油酸水平升高,且升高的血清油酸在促进TNBC转移中起关键作用。
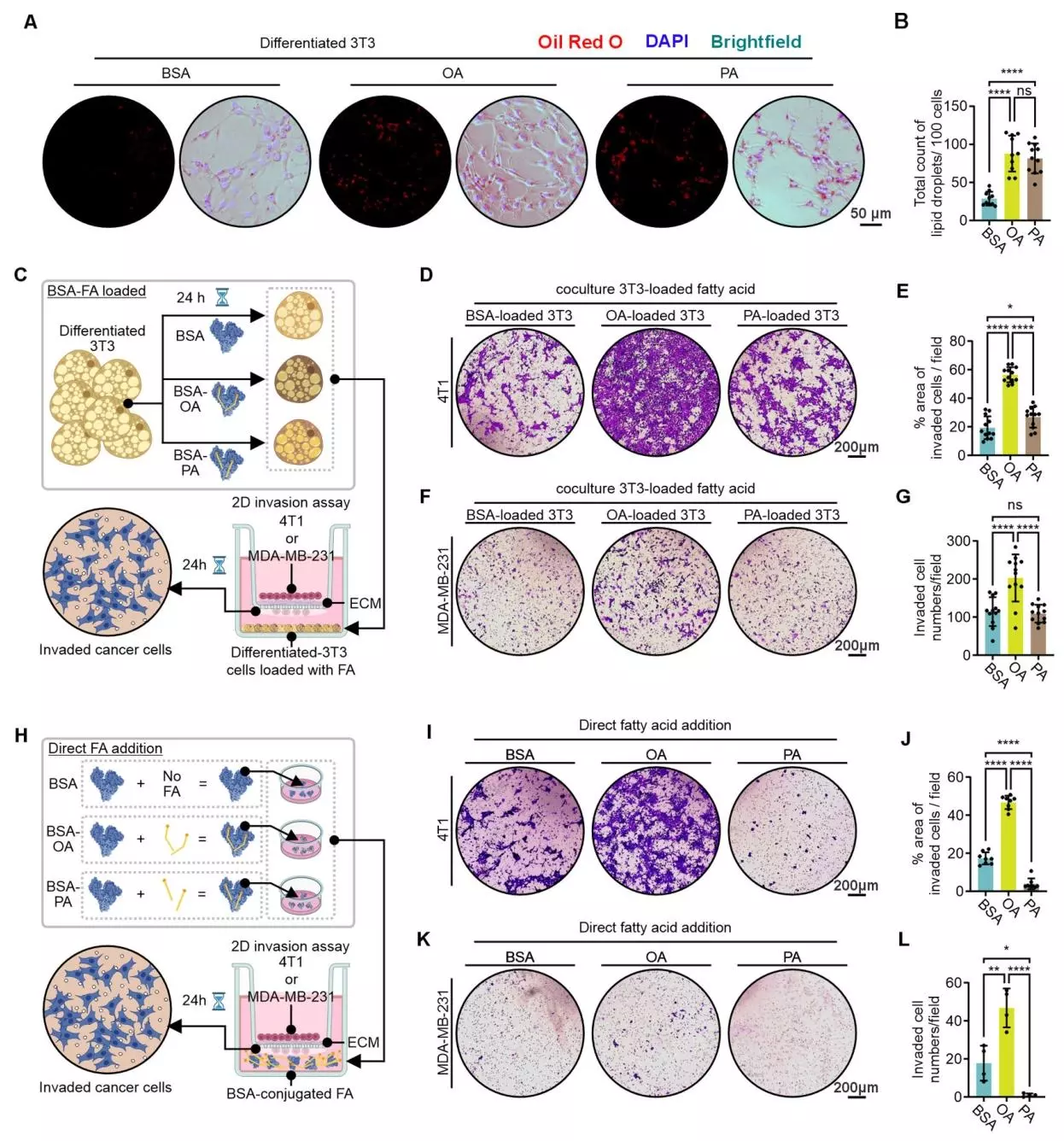
油酸在体外直接促进TNBC细胞侵袭
研究团队进一步探究了油酸在体外对TNBC细胞侵袭的影响,他们在3T3脂肪细胞中加入牛血清白蛋白(BSA)偶联的油酸、棕榈酸(PA)或单独的BSA,通过油红O染色观察脂质滴形成;建立体外共培养系统(TNBC细胞在上室胶原包被的插入物中,分化的脂肪细胞在下室),以及直接用油酸、棕榈酸或BSA处理TNBC细胞,评估对TNBC细胞侵袭的影响。结果显示油酸和棕榈酸均能诱导3T3脂肪细胞形成显著的脂质滴;与BSA或棕榈酸分化的脂肪细胞共培养相比,油酸分化的脂肪细胞能最强地增强4T1和MDA-MB-231细胞的侵袭。而直接用油酸处理TNBC细胞,能显著增强4T1和MDA-MB-231细胞的侵袭,棕榈酸无此作用;且油酸处理能显著增加TNBC细胞的脂质积累,促进细胞生长增殖,并增强4T1细胞中Bmi-1、Zeb2、Mmp9和Vimentin等肿瘤细胞迁移标志物的表达。这些结果证明油酸能直接在体外促进TNBC细胞侵袭,这与体内观察到的橄榄油高脂饮食的促转移作用一致。
油酸通过激活PKC-ALDH信号驱动TNBC细胞侵袭
之前的研究结果发现在喂食橄榄油高脂饮食(HFD)的小鼠中,观察到三阴性乳腺癌(TNBC)的乙醛脱氢酶(ALDH)活性升高且肺转移增加,这促使研究团队想要探究油酸(OA)是否通过激活ALDH信号来驱动三阴性乳腺癌细胞迁移。他们用不同浓度油酸及其他膳食脂肪酸(棕榈酸、亚油酸、花生四烯酸)处理4T1和MDA-MB-231细胞,检测ALDH活性;使用ALDH抑制剂(DEAB)和多种通路特异性抑制剂(如针对STAT3的S3I-201、针对脂肪酸氧化的Etomoxir、针对PKC的sotrastaurin等),探究油酸诱导TNBC细胞侵袭的分子机制;检测油酸处理后TNBC细胞中干细胞相关基因和PKC相关基因的表达及PKC蛋白水平。结果显示油酸以剂量依赖方式增加4T1细胞的ALDH活性,且在4T1和MDA-MB-231细胞中,油酸诱导的ALDH活性高于其他膳食脂肪酸;用DEAB抑制ALDH活性后,油酸诱导的4T1和MDA-MB-231细胞侵袭显著减少。通路抑制剂筛选显示,只有sotrastaurin(PKC抑制剂)能显著抑制油酸诱导的4T1细胞ALDH活性;油酸诱导的ALDH+细胞中,干细胞相关基因(如Aldh2、Vimentin等)和PKC相关基因(如PLCγ1、PKCε等)表达增强,且在4T1细胞中,油酸诱导的PKC(尤其是PKCε)蛋白表达增加;sotrastaurin能以剂量依赖方式抑制油酸诱导的ALDH活性,且不影响细胞存活,同时还能显著抑制油酸诱导的TNBC细胞侵袭及侵袭相关基因(如Vimentin)的表达。这说明油酸通过激活PKC-ALDH信号通路来驱动TNBC细胞侵袭,其中PKC的激活对OA/ALDH轴至关重要。
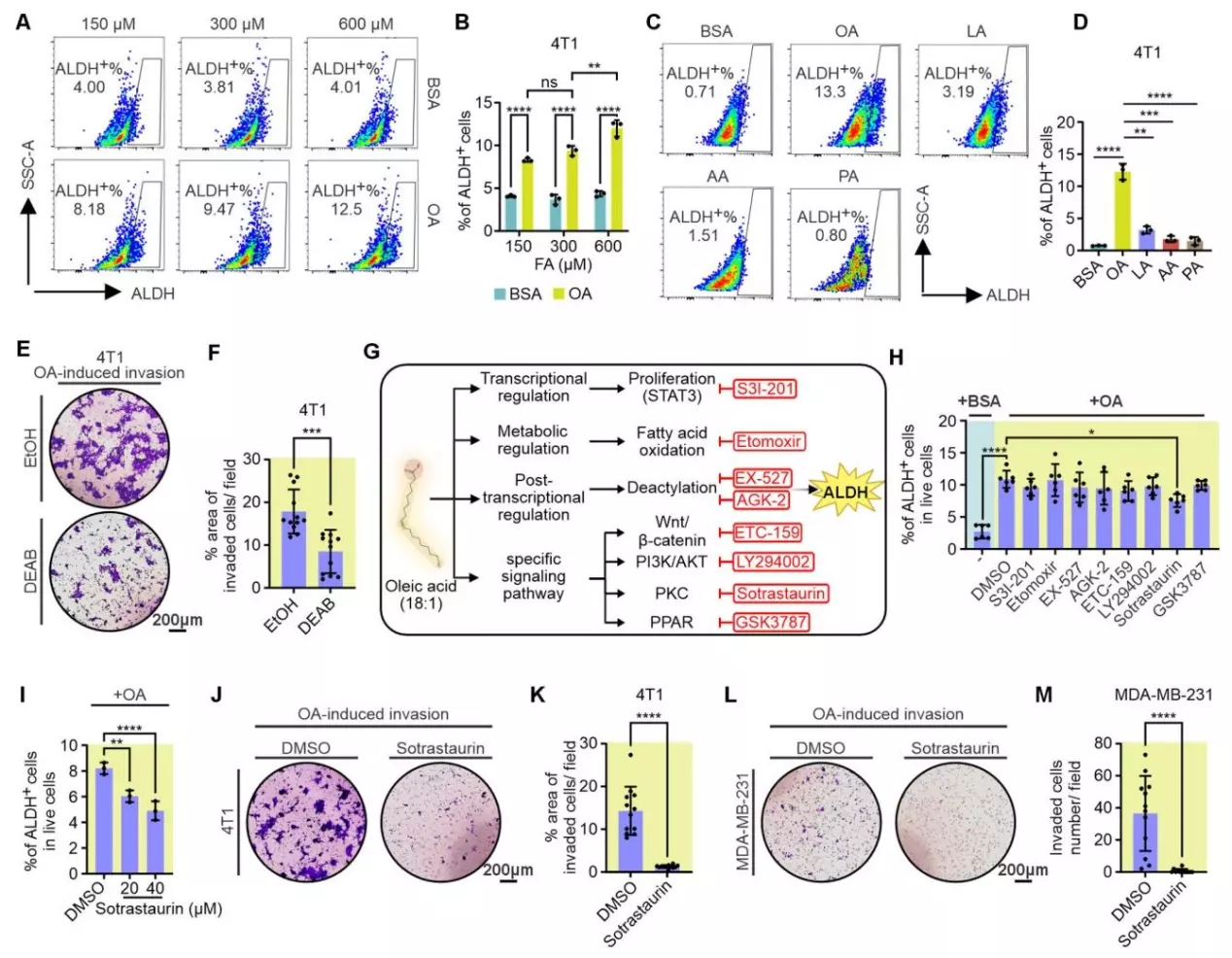
FABP5介导TNBC细胞中油酸诱导的PKC-ALDH激活
为探究油酸(OA)在三阴性乳腺癌(TNBC)中如何激活PKC,研究人员分别用油酸或单独的牛血清白蛋白(BSA)处理4T1细胞,并通过液相色谱-质谱(LC-MS)分析其非靶向脂质组学谱。结果显示,油酸处理显著增加4T1细胞中18:1脂肪酰基的整体水平,且这些脂肪酰基被整合到多种膜脂质(如PI、PC、DAG等)的sn-1和sn-2位置。FABP5是4T1和MDA-MB-231细胞中主要的FABP亚型,CCLE数据库也证实TNBC细胞系中FABP5高表达,而CD36和其他脂肪酸转运蛋白(FATPs)在TNBC细胞中未上调。FABP5敲除显著减少油酸介导的18:1脂肪酰基和DAG的整合,降低膜脂质(如PI、PC等)水平;Westernblotting分析显示FABP5敲除减弱了油酸诱导的4T1和MDA-MB-231细胞中PKCε的激活;ALDH活性和肿瘤侵袭实验表明,FABP5敲除大幅降低了油酸诱导的4T1和MDA-MB-231细胞的ALDH活性和Matrigel侵袭能力。这些结果表明FABP5在TNBC细胞中油酸诱导的PKC-ALDH激活过程中起关键介导作用,通过促进油酸整合到膜脂质中,进而激活PKC-ALDH信号通路,最终促进TNBC细胞侵袭。
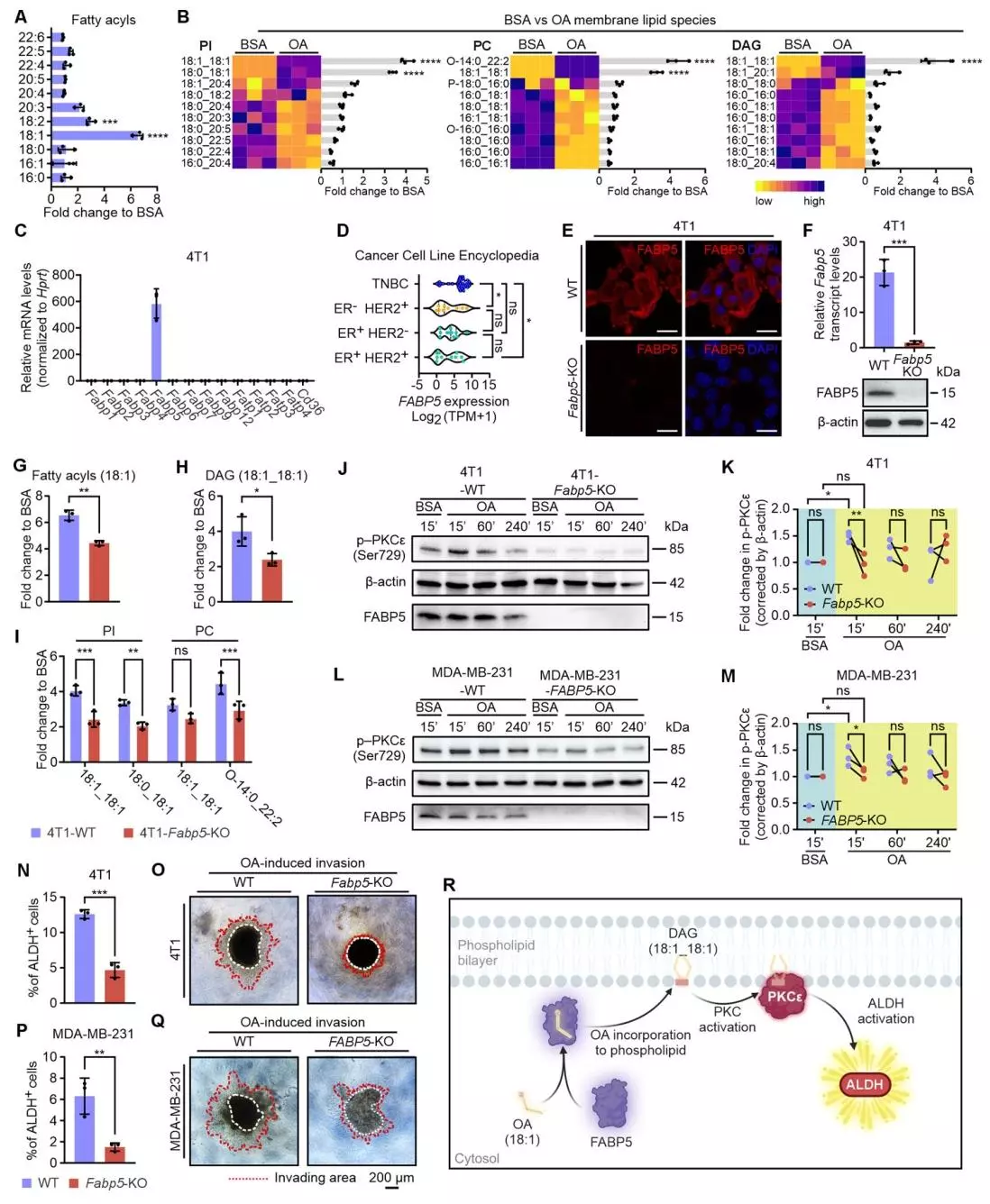
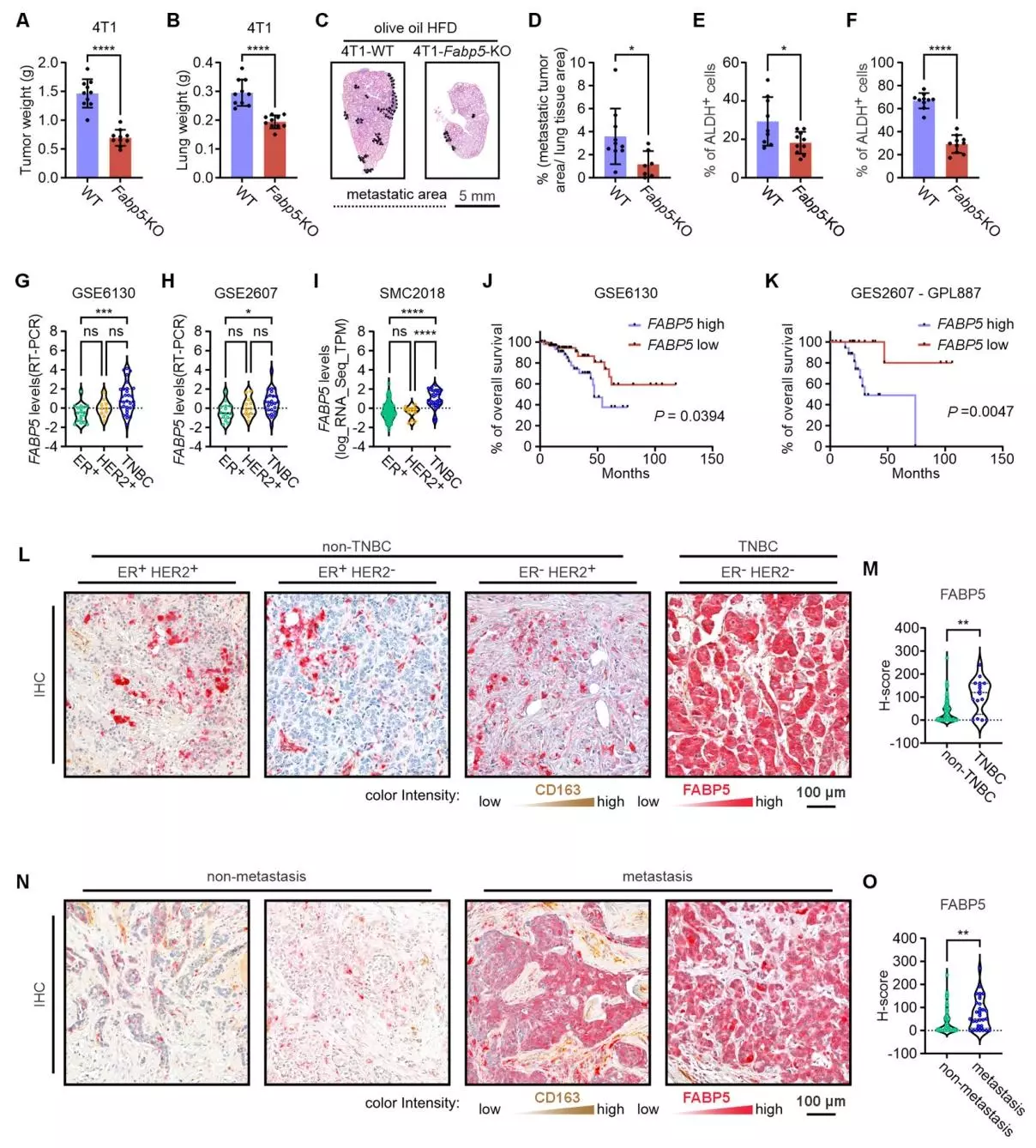
FABP5在小鼠模型中促进TNBC进展,且在人类研究中与TNBC不良预后相关
为进一步明确脂肪酸结合蛋白5(FABP5)在体内促进三阴性乳腺癌(TNBC)进展的关键作用,研究人员将野生型(WT)和FABP5敲除(KO)的4T1肿瘤细胞原位注射到喂食橄榄油高脂饮食(HFD)的BALB/c小鼠乳腺中,同时检测原发肿瘤生长情况和肺转移情况。在4T1模型中,FABP5敲除显著抑制肿瘤生长,减少肺重量和肺转移,降低原发肿瘤和转移肿瘤中的ALDH活性;在MDA-MB-231模型中,FABP5缺陷显著减少原发肿瘤生长、肺重量和转移,降低肿瘤ALDH活性,且不影响细胞增殖,但显著降低其侵袭能力。
研究人员还对公共人类乳腺癌数据库中不同分子亚型乳腺癌的FABP5表达,以及FABP5表达与总生存期的关系进行分析;并收集96例乳腺癌患者手术组织样本,分析FABPs的表达谱。在不同乳腺癌数据集(GSE6130、GSE2607、SMC2018)中,与ER+或HER2+乳腺癌相比,TNBC中FABP5表达显著更高;Kaplan-Meier分析显示,在包含多种乳腺癌亚型的数据集和仅针对TNBC样乳腺癌的数据集里,FABP5水平升高均与乳腺癌患者总生存期缩短相关。而人类组织样本分析发现FABP5主要定位于乳腺癌细胞(而非CD163+巨噬细胞),TNBC亚型FABP5表达显著高于非TNBC亚型;且高FABP5表达与乳腺癌转移呈正相关,而FABP4无此关联。由此可以得出,在TNBC进展中起关键作用,尤其是在驱动TNBC转移方面,可作为TNBC的预后标志物和潜在治疗靶点。
源井生物提供的支持
本研究中使用到的敲除细胞Fabp5 Knockout cell line(4T1)和FABP5 Knockout cell line(MDA-MB-231)由源井生物提供,且均通过蛋白质印迹法(WesternBlotting)在蛋白质水平上检测FABP5的敲除情况,为研究揭示FABP5作为TNBC的预后标志物和潜在治疗靶点提供重要工具。
源井生物目前拥有超8000种基因敲除细胞,价格低至¥4980,现货细胞最快一周达,进入红棉·万象全品类细胞库搜索您需要的细胞;如果细胞库中没有找到您需要的敲除细胞,源井生物还可以为您提供定制化基因敲除服务,借助源井生物自主开发的CRISPR-U™技术可将细胞基因编辑效率提升10-20倍, 为全球科研机构提供高效、稳定的基因功能研究工具。
参考文献
Avellino A, Jiang X, Lee M, Yu J, Liu S, Han X, Li J, Shilyansky J, Wang Z, Curry M, Xiong Y, Lizarraga IM, Huang Y, Sugg SL, Hao J, Li B. An Olive Oil-Based High-Fat Diet Promotes Obesity-Driven Metastasis of Triple-Negative Breast Cancer. Cancer Res. 2025 Sep 5:10.1158/0008-5472.CAN-25-0822. doi: 10.1158/0008-5472.CAN-25-0822. Epub ahead of print. PMID: 40911782; PMCID: PMC12502211.











