 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
基因敲除细胞系的前提条件性,是要一种用于消除某些组织(例如肝脏)中特定基因的技术。该技术对于研究个体基因在活生物体中的作用非常广泛。它与传统的基因敲除技术不同,因为它在特定的时间针对特定的基因,而不是从一开始就将其清除。而基因敲除技术的使用消除了许多传统基因敲除的副作用。在传统的基因敲除中,胚胎可能由于基因突变而死亡,这使科学家无法研究成年的基因细胞。然而某些细胞组织即使可以敲除也不能单独进行研究,因此该细胞在某些组织中必须是无活性的,而在其他组织中必须保持活性。利用这项技术,科学家可以在发育的特定阶段中基因敲除细胞系,并研究敲除一个组织中内的基因如何影响其他组织中的相同基因。
Easi-CRISPR用于使用长ssDNA供体创建敲入和条件敲除小鼠模型
基于CRISPR/Cas9的基因组编辑可以通过破坏基因序列轻松产生敲除小鼠的原代细胞,但是创建需要插入外源DNA(敲入)或替换基因组片段的模型效率非常低。这项研究中使用的大多数小鼠模型都涉及敲入(报道基因或重组酶)或基因替换(例如,含有侧翼为LoxP位点的外显子条件敲除等位基因)。已经报告了创建此模型的一些方法。这些方法使用双链DNA作为供体,但效率通常为1-10%,因此不适合常规使用。研究人员最近证明,长单链DNA(ssDNA)可以是非常有效敲除供体,无论是插入还是基因替换。研究人员称此方法为ssDNA insert-CRISPR(Easi-CRISPR)的有效补充,因为它是一种有效的技术(效率通常为30-60%,在某些情况下可达100%)。该协议将花费大约2个月的时间来生产创始人老鼠,从而研究起敲除小鼠的原代细胞和编辑。
CRISPR-Cas9核酸内切酶产生了基因敲除细胞系的条件,揭示了冠心病在秀丽隐杆线虫神经发育中的作用
基因敲除动物的细胞系是研究细胞和发育生物学基本机制的宝贵工具。研究人员通过操纵秀丽隐杆线虫的体细胞谱系中RNA指导的DNA核酸内切酶CRISPR-Cas9的表达,开发了一种条件敲除策略。研究人员表明,这种CRISPR-Cas9体细胞技术提供了一种快速有效的方法来在不同发育阶段的各种细胞类型中产生条件基因敲除。此外,研究人员证明,这种方法优于我们最近开发的体细胞TALEN技术,并且可以一步生成多个基因细胞的条件敲除。通过将这些技术与活细胞成像相结合,研究人员表明,与人类神经行为功能有异常相关的必需胚胎基因Coronin可以调节神经母细胞迁移和神经形成过程中中央线虫的肌动蛋白组织。和细胞形态。研究人员提出,体细胞CRISPR-Cas9平台中特别适合基因编辑条件的生物医学研究。
使用诱导性端粒/掩蔽蛋白CRISPR/Cas9敲除细胞对人端粒功能障碍进行的系统分析
CRISPR/Cas9基因敲除技术可以使用人体细胞对人类基因进行有效的功能丧失分析。但是,必需基因的研究需要条件敲除(KO)细胞。研究人员描述了可以诱导CRISPR KO人类细胞系产生的端粒/shelterin复合物。 TRF1,TRF2,RAP1,TIN2,TPP1和POT1的亚基与端粒相互作用或可以与其他端粒分离。几个亚基的纯合灭活在小鼠中是致命的。关于人类端粒调节子功能丧失的大多数研究都依赖于RNA干扰介导的基因敲除,这有其自身的局限性。我们的可诱导CRISPR方法使我们能够更方便地获得大量细胞系,其中必需的端粒调节剂已被灭活,用于生化和分子研究。我们的系统分析揭示了人类和小鼠端粒蛋白在DNA损伤反应,端粒长度和代谢控制方面的功能差异,从而为维持端粒提供了新的见解。
Ubigene的目标是简化基因组编辑。 Ubigene开发了CRISPR-U™(基于CRISPR/Cas9技术),在双链断裂方面比普通CRISPR/Cas9更有效,而CRISPR-U™可以大大提高同源重组的效率并轻松实现敲除(体内) (体外)点突变(PM)和敲入(KI)。借助CRISPR-U™,Ubigene已成功编辑了100多个细胞系上的基因。
Reference
Miura H, Quadros R M, Gurumurthy C B, et al. Easi -CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors[J]. Nature Protocols, 2018, 13(1): 195-215.
Shen Z, Zhang X, Chai Y, et al. Conditional knockouts generated by engineered CRISPR-Cas9 endonuclease reveal the roles of coronin in C. elegans neural development.[J]. Developmental Cell, 2014, 30(5): 625-636.
Kim H, Li F, He Q, et al. Systematic analysis of human telomeric dysfunction using inducible telosome/shelterin CRISPR/Cas9 knockout cells[J]. Cell discovery, 2017, 3(1).
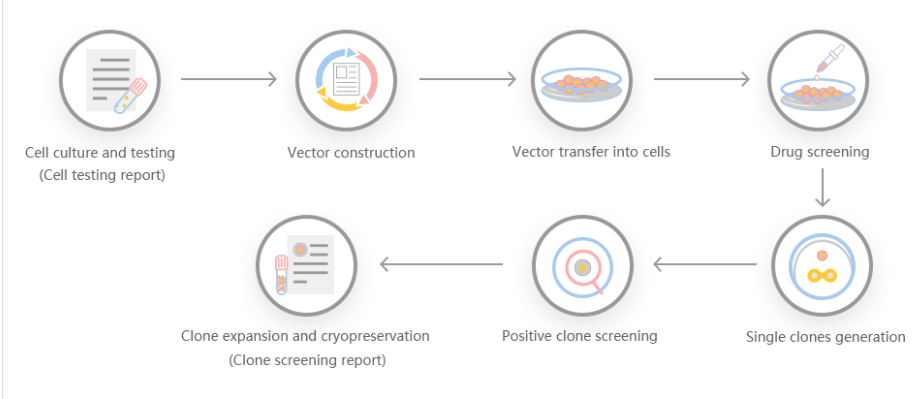
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。