 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
在日常生活中有三个区域可以鉴定出与酵母tRNA(His)鸟苷基转移酶(Thg1)具有序列相似性的基因,Thg1家族酶涉及从tRNA(His)成熟到5'端修复到基因敲除等多种过程。 tRNA的所有这些活动中都利用了Thg1家族酶催化3'-5'核苷酸的加成反应能力。尽管许多含Thg1的生物中只有一个与Thg1相关的基因,但某些真核微生物却拥有与Thg1序列相似的多个基因。
细菌tRNAHIS鸟苷基转移酶(Thg1)样蛋白的结构研究,在激活和核苷酸转移位点中具有的基因编辑技术
所有核苷酸聚合酶和转移酶均在5'至3'方向中催化核苷酸的添加。相反,tRNAHis胍基转移酶(Thg1)酶催化核苷酸向多核苷酸底物的反常添加(3'至5')。在真核生物中,Thg1酶利用3'–5'附加活性将G-1添加到tRNAHis的5'末端,这是组氨酸-tRNA合成酶对tRNA进行有效氨酰化所必需的修饰。 Thg1样蛋白(TLP)基因敲除大肠杆菌和线粒体中发现,并且在生化上不同于其真核Thg1对应物TLP催化截短的tRNA的5'端修复,其作用于广泛的tRNA底物,而不是表现出严格的特异性tRNAHis。两者合计,knockout bacteria这些数据表明TLPs在tRNAHis成熟途径的不同生物学的过程中起作用,也许在tRNA质量控制中。研究人员介绍了来自革兰氏阳性土壤细菌苏云金芽孢杆菌(BtTLP)的TLP的第一个晶体结构。该酶是类似于人THG1的四聚体,与它具有基本的结构相似性。用5'-单磷酸化的tRNA催化3'-5'反应首先需要一个激活步骤,即在第二个核苷酸基转移步骤之前生成5'-腺苷酸化的中间体,其中核苷酸被转移到tRNA的5'-末端。与人类THG1的早期特征一致,研究人员观察到了激活和核苷酸转移这两个步骤中涉及的核苷酸的独特结合位点。具有GTP的BtTLP复合物揭示了与GTP核苷酸在激活位点的新相互作用,这从先前解析的结构中看不出来。此外,BtTLP-ATP结构允许首次在激活位点直接观察ATP。 BtTLP结构数据,结合所选变体的动力学分析,提供了对关键残基在激活步骤中的作用的新见解。
酿酒酵母Thg1使用5'-焦磷酸盐去除控制核苷酸向tRNA的添加
在真核生物中,tRNA(His)鸟苷基转移酶(Thg1)催化3'-5'将单个鸟苷残基添加到tRNA(His)的-1位(G-1),跨过高度保守的73位腺苷( A73)。加入G-1后,Thg1从tRNA 5'末端去除焦磷酸,生成5'-单磷酸化含有G-1的tRNA。 5'-单磷酸化的G-1残基的存在,对于通过其组氨酸-tRNA合成酶识别tRNA(His)非常的重要。除单G-1加成反应外,Thg1还将多个G残基聚合到tRNA(His)变体的5'端。对于3'-5'聚合,Thg1使用tRNA(His)受体茎的3'末端作为模板。推测逆向聚合的机理涉及每个传入的NTP对3'-OH的亲核攻击,该3'-OH对通过前面的核苷酸添加而产生的完整5'-三磷酸酯进行了攻击。在5'-焦磷酸盐去除的3'-5'聚合酶反应之间存在竞争潜力,这可能确定了Thg1催化加成反应的结果,但尚未研究出任何Thg1酶在这些竞争反应之间的相互作用。研究人员建立了瞬态动力学测定法,以鉴定酵母Thg1具有一组tRNA(His)底物的焦磷酸盐去除与核苷酸添加了活性之间的关系,其中N-1:N73碱基的身份发生变化,以模仿N-1的各种产物Thg1催化的加成反应。研究人员证明5'-三磷酸的保留与有效的3'-5'逆向聚合相关。提出了一种动力学分配机制,该机制可防止野生型tRNA(His)-1位以外的核苷酸添加。
Thg1型3'-5'核酸聚合酶中经典RRM折叠棕榈结构域的存在以及GGDEF和CRISPR聚合酶结构域的起源
使用敏感的分布图比较结构预测的方法,我们显示出催化结构域Thg1包含RRM(铁氧还蛋白)折叠棕榈结构域,就像病毒RNA依赖性RNA聚合酶,逆转录酶,A和B族DNA聚合酶,腺苷酸环化酶,双鸟苷酸环化酶(GGDEF结构域)和CRISPR系统的预期聚合酶。研究人员表明,就像在这些聚合酶中一样,Thg1拥有一个带有三个酸性残基的活性位点,这些酸性残基螯合Mg ++阳离子。根据该研究人员的预测,Thg1类似于5'-3'聚合酶催化聚合反应,但利用传入的3'OH攻击延伸的多核苷酸末端生成的5'三磷酸。此外,研究人员还确定了Thg1独特这一组独特残基,研究人员预测这些残基包含第二个活性定位点,该位点催化最初的腺苷酸化引发了3'-5'聚合反应。从看到的信息显示来自保守基因邻域的背景Thg1资料,研究人员表明Thg1可能与多核苷酸激酶结合起作用,该多核苷酸激酶在RNA分子末端为其生成初始5'磷酸底物。除组氨酸tRNA成熟外,Thg1在生命的所有三个超级区域以及某些大型DNA病毒的代表中可能还具有其他RNA修复作用。研究人员还提供证据表明,在类似聚合酶的结构域,证实两人Thg1与GGDEF和CRISPR聚合酶蛋白催化结构域的密切相关。
根据这种关系和这些酶的系统发育模式,我们推断Thg1蛋白很可能代表同一类蛋白质的古生真核分支,从而产生了可移动的CRISPR聚合酶,并在细菌中产生了GGDEF结构域。 Thg1可能接近该酶家族的祖先版本,后者在最后一个通用祖先中可能在RNA修复中发挥了作用。
Ubigene开发了CRISPR-B™,可优化微生物基因编辑载体和工艺。效率和准确性比传统方法高得多。 CRISPR-B™可用于细菌和真菌的基因编辑。
Reference
Abad MG, Long Y, Willcox A, Gott JM, Gray MW, Jackman JE. A role for tRNA(His) guanylyltransferase (Thg1)-like proteins from Dictyostelium discoideum in mitochondrial 5'-tRNA editing. RNA. 2011;17(4):613-623. doi:10.1261/rna.2517111。
Hyde SJ, Rao BS, Eckenroth BE, Jackman JE, Doublié S. Structural studies of a bacterial tRNA(HIS) guanylyltransferase (Thg1)-like protein, with nucleotide in the activation and nucleotidyl transfer sites. PLoS One. 2013;8(7):e67465. Published 2013 Jul 3. doi:10.1371/journal.pone.0067465。
Smith BA, Jackman JE. Saccharomyces cerevisiae Thg1 uses 5'-pyrophosphate removal to control addition of nucleotides to tRNA(His.). Biochemistry. 2014;53(8):1380-1391. doi:10.1021/bi4014648。
Anantharaman V, Iyer LM, Aravind L. Presence of a classical RRM-fold palm domain in Thg1-type 3'- 5'nucleic acid polymerases and the origin of the GGDEF and CRISPR polymerase domains. Biol Direct. 2010;5:43. Published 2010 Jun 30. doi:10.1186/1745-6150-5-43。
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
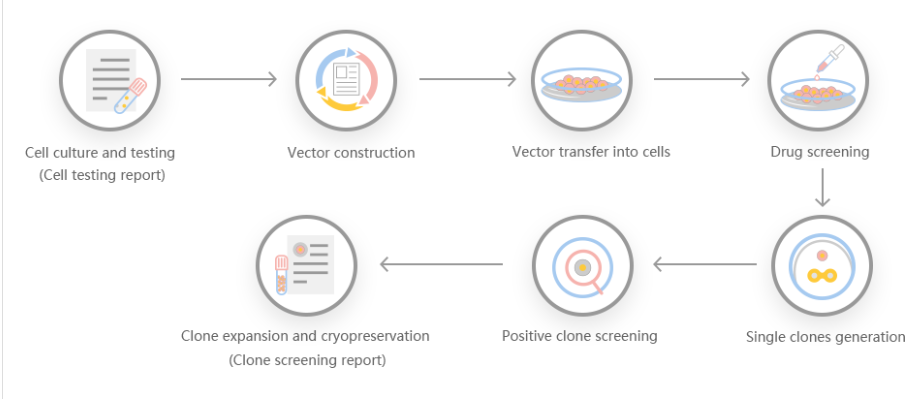
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。