 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
酿酒酵母是酵母的一种。自古以来,它就一直用于酿酒,烘焙和酿造。据信,它最初是从葡萄皮中分离出来的人们可以将酵母看作是一些深色水果(如李子)的皮肤上白色薄膜的成分;它存在于表皮的蜡中。它是分子和细胞生物学中研究最深入的真核生物模型之一,同时也可用作基因敲除大肠杆菌(Escherichia coli)的模型细菌。它是最常见的发酵类型微生物。
磷酸甘油酸突变酶敲除突变体酿酒酵母:生长调查和转录组分析
酿酒酵母是能够通过糖的异生作用来激活的,使其新陈代谢可以适应不同碳源的生长,并转变为C2或C3碳源(乙醇,乙酸盐或甘油)的非发酵生长。研究人员研究了编码磷酸甘油酸突变酶的糖酵解和糖异生基因GPM1缺失的反应。先前已证明,只有当甘油和乙醇均作为碳源存在时,带有GPM1的非功能性拷贝的酿酒酵母菌株才能生长,而添加葡萄糖显示出强烈抑制生长的作用。提示需要甘油来促进糖异生,而呼吸需要乙醇。研究人员通过发酵和转录组分析研究了GPM1敲除突变体的生长反应。此外,研究人员将生长结果与通过使用的基因组,促进新陈代谢模型进行模拟获得的结果然后再进行了比较,结果表明,甘油仅需少量即可用于生长。我们的发现强烈暗示了敲除突变体的生长能力严重受损,该突变体呈现出参与戊糖磷酸途径和乙醛酸分路的基因的转录水平增加。这些结果表明试图补偿由突变体内糖酵解/糖异生基因的缺失引起的能量失衡。
通过基于CRISPR的FDC1基因编辑能够减少酚类异味,酿酒酵母x多种啤酒酵母
当今的啤酒市场面临着减少传统啤酒风格消费和增加特种啤酒消费的挑战。尤其是啤酒(比尔森啤酒),其特征是清爽,独特的香气和味道,但非常均匀,因此很难与它们的销售竞争。现在已经提出了开发普通啤酒酵母的新变体,巴斯德酵母等夹杂着多种酿酒酵母。(Saccharomyces pastorianus)作为解决啤酒中产品多样化需求的解决方案。以前通过祖先亲本物种(酿酒酵母和欧亚酵母)杂交产生新的更大的酵母的努力产生了具有不同于自然生物多样性的芳香特征的菌株。不幸的是,这些新酵母除了具有理想的特性外,还继承了多余的特性。最值得注意的是它们的酚醛异味(POF)生产,这妨碍了它们在工业生产过程中的直接应用。研究人员描述了一种基于CRISPR的基因编辑策略,该策略可以系统地,精心地引入遗传上复杂的工业酿酒酵母菌株,桑巴酵母和FDC1基因中的自然突变。所得的顺式POF变异体显示出巨大的工业应用潜力,并使目前的大型啤酒产品组合多样化。
基于CRISPR / Cas9的酿酒酵母乳出口难以捉摸的机制探索
CRISPR/Cas9的基因组编辑可快速,同时修改酿酒酵母中的多个遗传基因座。这项技术被用于功能分析研究中,目的是确定迄今为止该酵母中乳酸输出的未知机制。构建了酿酒酵母菌株,该菌株在25个编码转运蛋白的基因中缺失,包括完整的水(甘油)蛋白家族和所有已知的羧酸转运蛋白。然后用干酪乳杆菌乳酸脱氢酶(LcLDH)的表达盒转化25缺失菌株。在厌氧,葡萄糖生长的分批培养中,该菌株的比生长速率(0.15 vs. 0.25 h-1)和生物量特异性乳酸产生速率(0.7 vs. 2.4 mmol g生物量-1 h-1)低于LcLDH-表达参考菌株。然而,在厌氧葡萄糖有限的恒化器培养物中两种菌株的比较(稀释率0.10 h-1)显示出相同的乳酸产生率。这些结果表明,尽管25个转运蛋白基因的缺失影响了最大的生长速率,但是当以固定的生长速率进行分析时,它并不影响乳酸盐的出口速率。 25缺失菌株为迈向“最小转运蛋白”酵母平台迈出了第一步,该平台可用于特异性(异源)转运蛋白的功能分析以及代谢工程策略的评估。
Reference
Papini M , Nookaew I , Scalcinati G , et al. Phosphoglycerate mutase knock-out mutant Saccharomyces cerevisiae: Physiological investigation and transcriptome analysis[J]. Biotechnology Journal, 2010, 5(10):1016-1027.
Mertens S , Gallone B , Steensels J , et al. Reducing phenolic off-flavors through CRISPR-based gene editing of the FDC1 gene in Saccharomyces cerevisiae x Saccharomyces eubayanus hybrid lager beer yeasts[J]. Plos One, 2019, 14(1).
Robert, Mans, Else-Jasmijn, et al. A CRISPR/Cas9-based exploration into the elusive mechanism for lactate export in Saccharomyces cerevisiae.[J]. FEMS yeast research, 2017.
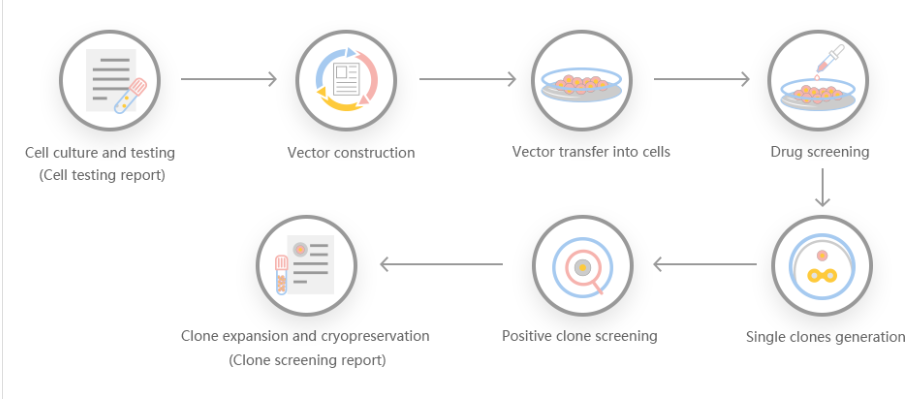
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。