 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
铜绿假单胞菌是一种常见的封装革兰氏阴性杆状细菌,可导致动植物(包括人类)患病。铜绿假单胞菌(Pseudomonas aeruginosa)是具有重要医学意义的物种,并且是具有多种耐药性的病原体。由于其普遍存在,固有的先进耐药机制以及与严重疾病(如呼吸机相关性肺炎和呼吸道炎症)等关系以及公认的败血症综合征与医院感染有关,因此这种细菌通常在环境中发现,例如铜绿假单胞菌是革兰氏阴性需氧杆状细菌,属于假单胞菌家族(一种γ-变形杆菌)。近年来,铜绿假单胞菌在CRISPR编辑领域变得越来越流行。它涉及基因敲除技术,基因敲入和细菌中的点突变。
CRISPR在铜绿假单胞菌中涉及标签基因插入和敲除的应用
铜绿假单胞菌既是原型多药抗性(MDR)病原体,又是CRISPR-Cas研究的模型物种。在包括I-F CRISPR的临床环境中,该技术可以轻松应用于铜绿假单胞菌的其他两种分离株。进一步开发了两步In-Del策略,其中涉及在所需的编辑位点附近插入标签,然后执行基因敲除以编辑缺少有效PAM(原型间隔子相邻基序)或必需基因敲除细胞的基因组位点。在三个增强氟喹诺酮类药物,耐药性突变中,与MexAB-OprM或MexEF-OprN的外排相比,gyrA突变引起更大的耐药性。这些结果促进了对临床铜绿假单胞菌菌株MDR发展的理解,并证明了天然CRISPR系统在AMR研究中的巨大潜力。尽管在各种模型菌株中都有完整的遗传操作工具,但是由于这些菌株的DNA稳态和细胞毒性的多样性,它们在医学,环境和工业意义上在“非模型”菌株中的应用常常受到影响,阻碍。CRISPR-Cas9/Cpf1系统的克隆。具有内置基因组靶向活性并广泛分布于原核生物中的天然CRISPR-Cas系统的使用为解决这些障碍提供了一种有前途且有效的方法。第一项由I-F CRISPR介导的基因组编辑技术的成功开发及其扩展到其他临床和环境铜绿假单胞菌分离株。敲除细菌为病原体抗性功能基因组学开辟了新途径。
铜绿假单胞菌的沉默和点突变有助于细菌生理学,药物靶标探索和代谢工程研究
假单胞菌物种具有重要的生物医学,生态和工业重要性。尽管有广泛的研究和广泛的应用,但是在假单胞菌属物种,特别是在人类主要病原体铜绿假单胞菌中的遗传操作仍是一项艰巨的努力。据报道,通过使用CRISPR/Cas9和噬菌体λ-Red重组系统已经开发了基因组编辑方法pCasPA/pACRISPR。该方法允许在铜绿假单胞菌中进行有效且无疤的遗传操作。通过工程化的胞苷脱氨酶APOBEC1和Cas9切口酶的融合,开发了一种碱基编辑系统pnCasPA-BEC,它可以敲除多种铜绿假单胞菌和敲除大肠杆菌,从而实现点突变中的高效基因。两种基因组编辑方法的应用将大大加速各种研究,例如细菌生理学研究,药物靶标发现和代谢工程。
以碱基对精度快速构建铜绿假单胞菌基因敲除
铜绿假单胞菌是用于研究群体感应,生物膜形成以及免疫系统较弱的患者医院感染的主要原因的模型生物。因此,就其遗传学而言,铜绿假单胞菌是研究最多的生物之一。然而,在铜绿假单胞菌中构建和替换基因KO是相对耗时的并且需要多个步骤,包括自杀载体的构建,缀合,抗生素抗性盒插入,失活和等位基因交换。甚至网关重组技术和直接转换的组合也至少需要两个星期。因此,开发了一种快速,简化的方法,无需直接创建兼容Gateway的自杀载体,即可通过直接转化在铜绿假单胞菌中创建干净的KO突变体。在这种方法中,要删除的基因/基因座的上游和下游序列通过聚合酶链反应(PCR)进行扩增,并与线性酶无缝融合。
References:
Zeling Xu, Ming Li, Yanran Li, Huiluo Cao, Hua Xiang, Aixin Yan. Native CRISPR-Cas mediated in situ genome editing reveals extensive resistance synergy in the clinical multidrug resistant Pseudomonas aeruginosa. bioRxiv 496711.
Weizhong Chen, Ya Zhang, Yifei Zhang, Yishuang Pi, Tongnian Gu, Liqiang Song, Yu Wang, Quan jiangJi. iScience, Volume 6, 31 August 2018, Pages 222-231.
Huang, Weiliang, and Angela Wilks. “A rapid seamless method for gene KO in Pseudomonas aeruginosa.” BMC microbiology vol. 17,1 199. 19 Sep. 2017, doi:10.1186/s12866-017-1112-5.
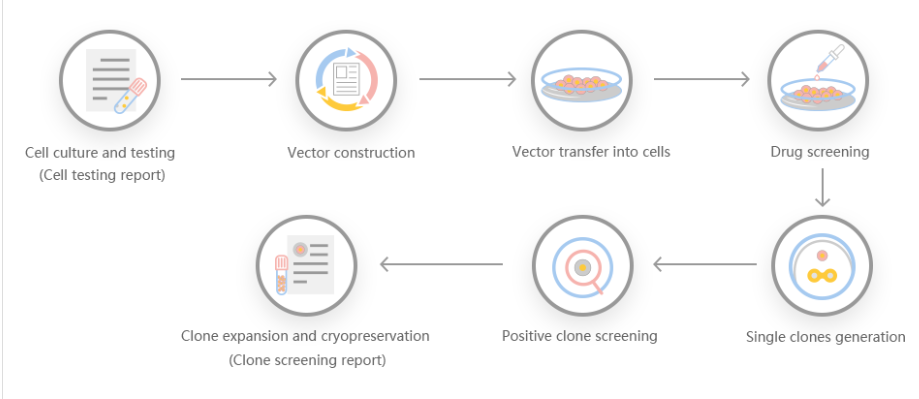
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。