 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
酵母是被归类为真菌界成员的真核单细胞微生物。第一种酵母起源于数亿年前,目前已鉴定出1,500种。据估计它们占所有描述的真菌种类的1%。大多数酵母通过有丝分裂无性繁殖,也有许多通过不对称分裂过程(即出芽)进行繁殖。通过发酵,酵母物种酿酒酵母将碳水化合物转化为二氧化碳和酒精。啤酒,葡萄酒和面包的历史与酵母发酵有关。它也是近代的细胞学,原代细胞研究的过程中最重要的模型生物,并且是研究最深入的真核微生物之一。研究人员已经使用它来收集有关真核细胞生物学以及最终人类生物学的信息。
用于可再生生物燃料和生化生产的非常规酵母的基因工程
解脂耶氏酵母是一种非致病性,二态性和严格需氧的酵母菌种。由于其独特的生理特征和代谢特性,这种非常规酵母不仅是研究真菌分化的基本性质的良好模型,而且还是生化生产和各种生物技术应用的有希望的微生物平台,需要广泛的基因敲除技术。然而,解脂耶氏酵母的基因操作由于缺乏有效和稳定的遗传转化系统以及非常高的非同源重组率而受到限制,这主要归因于KU70基因。研究人员报告了一种简便而快速的方案,用于解脂耶氏酵母Po1g中的有效遗传转化和基因缺失。首先,建立了将外源DNA有效转化为解脂耶氏酵母Po1g的方案。其次,为了获得用于进一步删除靶基因提高的双交换同源重组率,通过转化携带1kb同源臂的破坏盒来删除KU70基因。第三,为了证明在删除KU70基因后提高的基因删除效率,研究人员在KU70敲除平台菌株上使用相同的程序分别删除了11个编码醇脱氢酶和醇氧化酶的靶基因。观察到,精确同源重组的比率从缺失Po1g中的KU70基因的小于0.5%显着增加到针对Po1gKU70Δ中的11个靶基因的单基因缺失的33%-71%。构建携带潮霉素B抗性标记和Cre/LoxP系统的复制质粒,并通过表达Cre重组酶最终去除酵母敲除菌株中的选择标记基因,以促进多轮靶向遗传操作。所得的单基因缺失突变体在生物燃料和生物化学的生产中具有潜在的应用。
RNA引导的Cas9在酵母基因组中的组合代谢途径组装
酿酒酵母是生产谷物和纤维素乙醇,异丁醇,丁二醇,类异戊二烯和其他化学品的重要工业平台。成功生产菌株的构建通常涉及多个基因敲除和表达盒的染色体整合,以重定向代谢通量,以将糖和其他原料转化为所需产品。基于RNA指导的Cas9基因组编辑已在包括酿酒酵母在内的许多原核和真核宿主中得到证实,在其中它们还被用作代谢工程的工具。为了扩展RNA引导的Cas9作为代谢途径构建工具的利用,研究人员展示了多达17个重叠的编码β-胡萝卜素生物合成途径的DNA片段的直接组装和染色体整合。此外,研究人员为β-胡萝卜素生物合成途径生成了组合菌株文库,直接整合到酵母基因组中以创建多样化的菌株文库。这样就可以在稳定的染色体整合菌株中筛选组合文库,以快速提高产品滴度。这种途径组装的组合方法将大大加快目前S代谢工程的速度。酿酒酵母作为工业平台,并增加了可以同时进行酶筛选,表达优化和蛋白质工程评估的菌株数量,以实现新型工业发酵产品商业化所需的滴度,速率和产量。
开发用于CRISPR/Cas9系统的拟南芥酵母Rhodosporidium Toruloides基因组编辑
已研究了担子菌酵母圆核假单胞菌(R. toruloides)作为生产脂质和类胡萝卜素的有希望的宿主。然而,由于缺乏有效的遗传工具,对该酵母进行合理的操作仍然很困难。描述了簇状规则间隔的短回文重复序列(CRISPR/Cas9)系统的开发,用于在拟南芥中进行基因组编辑。首先,通过将含有密码子优化的Cas9基因的盒整合到基因组中,产生具有足够产量的金黄色葡萄球菌 Cas9蛋白的拟南芥菌株。同时,鉴定了两个U6基因,预测了两个U6启动子,并确认了具有U6b启动子的单向导RNA(sgRNA)的转录更好。接下来,设计分别针对CRTI,CAR2和CLYBL基因的sgRNA盒,将其转化为表达Cas9的菌株,并发现成功插入和缺失(indel)突变的转化子超过60%。此外,当sgRNA盒包含侧翼为基因CRTI的两个同源臂的供体DNA时,基因敲除会通过同源重组发生。因此,CRISPR/Cas9系统现在已被建立为鲁氏拟南芥中强大的基因组编辑工具,这应有助于功能基因组研究和先进的细胞工厂发展。
Reference
Yu A Q , Pratomo N , Ng T K , et al. Genetic Engineering of an Unconventional Yeast for Renewable Biofuel and Biochemical Production[J]. Journal of Visualized Experiments, 2016(115).
EauClaire, Steve, Zhang, et al. Combinatorial metabolic pathway assembly in the yeast genome with RNA-guided Cas9.[J]. Journal of Industrial Microbiology & Biotechnology, 2016.
Xiang, Jiao, Yue,et al. Developing a CRISPR/Cas9 system for genome editing in the basidiomycetous yeast Rhodosporidium toruloides.[J]. Biotechnology Journal, 2019.
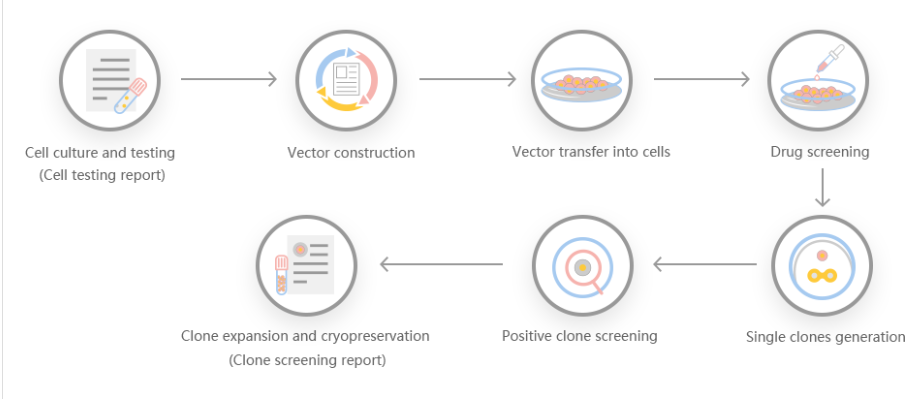
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。