 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
细胞系是由具有无限分裂能力的转化细胞群组成。这通常来源于实验室患者或动物的细胞系的致瘤起因。细胞系在研究中可能是无价的,整个医学领域都异常的重视。它们通常坚固并且需要相对简单的条件,从而进行组织培养。通过这种方式,这些类型的细胞最适合用于概念验证工作的基因敲除细胞系技术(例如生物打印设备和技术的开发和初始实施)。但是,尽管细胞系确实保留了其来源细胞类型的某些正常功能,但通常会大大降低其功能。
含有谷氨酰胺合成酶(GS)基因敲除的细胞系和使用该基因敲除的HEK293细胞系生产靶蛋白的方法
本发明涉及从转基因HEK293(人胚肾293)细胞系中敲除的新型GS(谷氨酰胺合成酶)基因和使用该转基因HEK293细胞系制备靶蛋白的方法。特别地,本发明人消除了HEK293细胞中GS的表达,以克服由GS的过表达引起的细胞系选择障碍,从而通过GS / MSX系统产生靶蛋白,从而提高了效率。因此,高产量靶蛋白的细胞系选择将增加,因此所选细胞系的蛋白产量显上升,这表明稳转细胞系的基因编辑技术可以有效地用于生产靶蛋白。
转基因细胞系网状细胞可以剖析宿主疟疾入侵的需求
这种无核细胞的遗传难治性阻碍了对宿主红细胞蛋白在疟疾感染中的作用进行了研究。而在研究人员的报告中,从体外分离出的永生红细胞系(BEL-A)分化出的网状细胞支持恶性疟原虫的成功入侵和细胞内发育。利用CRISPR介导的基因敲除和随后的互补作用,研究人员验证了红细胞受体西那平在恶性疟原虫侵袭中起到的重要作用,并通过受体的重新表达证明了对侵袭性细胞系基因编辑进行挽救。网织红细胞的成功侵袭补充了截短的突变体,消除了侵袭过程中basigin胞质域的功能作用。相反,据报道,参与侵袭并与basigin相互作用的亲环蛋白B的敲除不影响网织细胞的侵袭敏感性。这些数据建立了永生红细胞来源的网织红细胞作为强大的模型系统的用途,以探索有关恶性疟原虫入侵的宿主受体需求的假设。研究人员表明,来自永生红细胞的网状细胞支持恶性疟原虫的侵袭和发展,并使用CRISPR介导的基因敲除和侵袭受体的互补来证明该模型系统在疟疾侵袭研究中的实用性。
EndoC-βH1细胞系中的CRISPR/Cas9基因组编辑管道,用于研究与细胞功能有关的基因
2型糖尿病(T2D)是全球性的大流行病,具有很强的遗传成分,但是影响疾病风险的大多数致病基因都为未知的。现在,很清楚,胰岛β细胞是T2D发病机制的中心。迄今为止,用于研究T2D风险基因的体外基因敲除(KO)模型一直集中在啮齿动物β细胞上。但是,啮齿动物和人的细胞系之间存在重要的结构和功能差异。考虑到这一点,研究人员已经开发出了强大的管道,可以在真实的人类细胞系中(EndoC-βH1)中创建稳定的CRISPR/Cas9 KO。 KO流程包括双重慢病毒sgRNA策略,研究人员针对三个基因(INS,IDE,PAM)进行了概念验证。研究人员实现了所有靶基因mRNA水平的显着降低和蛋白质的完全消耗。使用这种双重sgRNA策略,可以从目标基因中切割出多达94 kb的DNA,每个sgRNA的编辑效率都超过了87.5%。脱靶序列没有特别的敲除和编辑。最重要的是,管道有不影响细胞的葡萄糖反应性胰岛素分泌。有趣的是,使用siRNA介导的敲除(KD)方法比较NEUROD1和SLC30A8的KO细胞系表现出表型差异。 NEUROD1-KO细胞不活跃,并显示出较高的内质网应激和凋亡标记。然而,NEUROD1-KD的促凋亡转录因子CHOP和基因表达谱仅适度升高,增幅为34%,表明慢性ER应激,而没有细胞死亡的证据。另一方面,与siRNA沉默相反,SLC30A8-KO细胞显示出K ATP通道基因表达没有降低。总体而言,这种在人的细胞系EndoC-βH1中有效创建稳定KO的策略将使人们更好地了解与编辑细胞功能异常有关的基因,与其潜在的功能机制和T2D发病原理。
由Ubigene开发的CRISPR-U™(基于CRISPR / Cas9技术)在双链断裂方面比普通CRISPR / Cas9更有效,而CRISPR-U™可以大大提高同源重组的效率,轻松实现敲除(KO)),体外和体内的点突变(PM)和敲入(KI)。借助CRISPR-U,Ubigene已成功编辑了100多个细胞系上的基因。
Reference
Gyun Min Lee, Da Young Yu, Soo Min Noh.Cell line containing a knockout of the glutamine synthetase (GS) gene and a method of producing target proteins using a GS knockout HEK293 cell line.2016.US Patent
Satchwell T J, Wright K E, Haydnsmith K L, et al. Genetic manipulation of cell line derived reticulocytes enables dissection of host malaria invasion requirements[J]. Nature Communications, 2019, 10(1): 3806-3806.
Grotz AK, Abaitua F, Navarro-Guerrero E, Hastoy B, Ebner D, Gloyn AL. A CRISPR/Cas9 genome editing pipeline in the EndoC-βH1 cell line to study genes implicated in beta cell function. Wellcome Open Res. 2020;4:150. Published 2020 Apr 29. doi:10.12688/wellcomeopenres.15447.2.
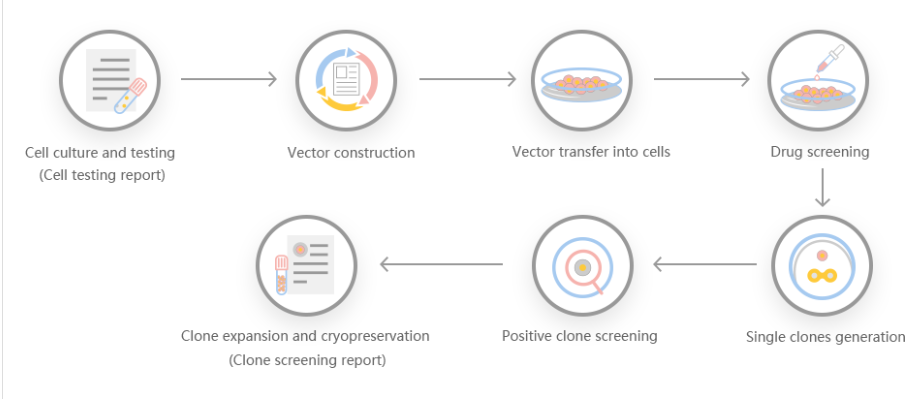
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。