 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
“基因魔剪”CRISPR/Cas9助力肝细胞癌(HCC)免疫治疗等研究
在世界范围内,肝癌是第六大最常见的癌症,也是第三大致死癌症。它最常见于撒哈拉以南的非洲和亚洲东部部分地区,包括中国、中国香港和中国台湾。肝癌的类型根据癌症起源的细胞类型分为5类,包括肝细胞癌(HCC)、肝纤维板层癌、胆管癌、血管肉瘤和肝母细胞瘤,其中最常见的是肝细胞癌。
免疫治疗已成为肝细胞癌综合治疗不可或缺的一部分。免疫疗法已被证明对早期HCC、晚期HCC或肝移植后HCC复发的患者有效。目前有许多不同类型的靶向药和免疫疗法。科学家们目前也在紧锣密鼓地研究这些药物的最佳使用方法,以及如何更好地将这些靶向药与其他治疗肝癌的方法结合使用。这些靶向物如下表所示:
| 免疫治疗及靶向药 | 靶点 |
|---|---|
| Nivolumab | PD-1 (PDCD1) |
| Pembrolizumab | PD-1 (PDCD1) |
| Cabozantinib | PD-L1 (CD274) |
| Ramucirumab | VEGFR (KDR) |
| HMBD-001 | HER3 (ERBB3) |
| A2AFP | AFP |
源井生物的KO现货库拥有近3000种KO细胞,覆盖多种药物靶点基因,包括上述的PDCD1、CD274、KDR、ERBB3基因,点击即可搜索现货>>
CRISPR/Cas9在肝癌模型中的应用
癌症涉及多个点突变、易位和染色体丢失与增加,所以确定癌症中的驱动基因突变是一个挑战。因此,为了更全面研究肝癌,有必要对肝癌的发展进行建模,并开发具有人类疾病特征的肝癌模型。CRISPR/Cas9由于其高效和直接的基因编辑能力,能有效加快这一构建过程。癌症模型大致可分为两类:体外和体内。常见的体外模型是可以无限传代的肝癌相关细胞系。通过使用CRISPR/Cas9技术敲除特定基因,模拟肝癌发展过程中的突变,从而构建特定的肝癌模型。体内肝癌模型通常使用小鼠构建,通过将CRISPR/Cas9系统传递到小鼠的特定器官或组织,再经诱导致癌突变或染色体重排来构建肝癌模型。肝癌细胞系由于其转染效率低、单克隆生长困难等特性,在众多细胞系中属于难以培养及编辑的细胞系。源井生物拥有12年基因编辑经验,独家研发CRISPR-UTM技术,10倍高效地进行细胞系基因编辑,即使是肝癌细胞(如Hep-G2、HuH7细胞)也能轻松进行编辑。现在更有开学促销,Hep-G2敲除细胞定制低至¥15,800元!如果您需要构建肝癌小鼠模型,源井生物可提供动物实验级别的高纯度、高滴度慢病毒和AAV,2680元起,快至3周交付!
案例分析
肝细胞癌治疗新靶点SNORD17与P53网络的复杂关系
肿瘤抑制因子p53在DNA损伤或癌基因异常激活的反应中被激活,诱导多种细胞过程,包括细胞周期阻滞、凋亡和衰老,研究表明p53在HCC的发展中发挥着关键作用。许多非编码RNA在p53信号网络中发挥重要作用,包括miRNA和lncRNA,然而小核仁RNA(Small nucleolar RNAs, snoRNAs)在p53调控网络中的作用还不太明确。针对这个问题,同济医院肝脏外科中心的研究团队通过使用CRISPR/Cas9技术对小核仁RNA SNORD17进行编辑,揭示了SNORD17和p53信号通路在肝细胞癌的中的调控作用,为肝细胞癌的治疗提供了一个新的潜在靶点。
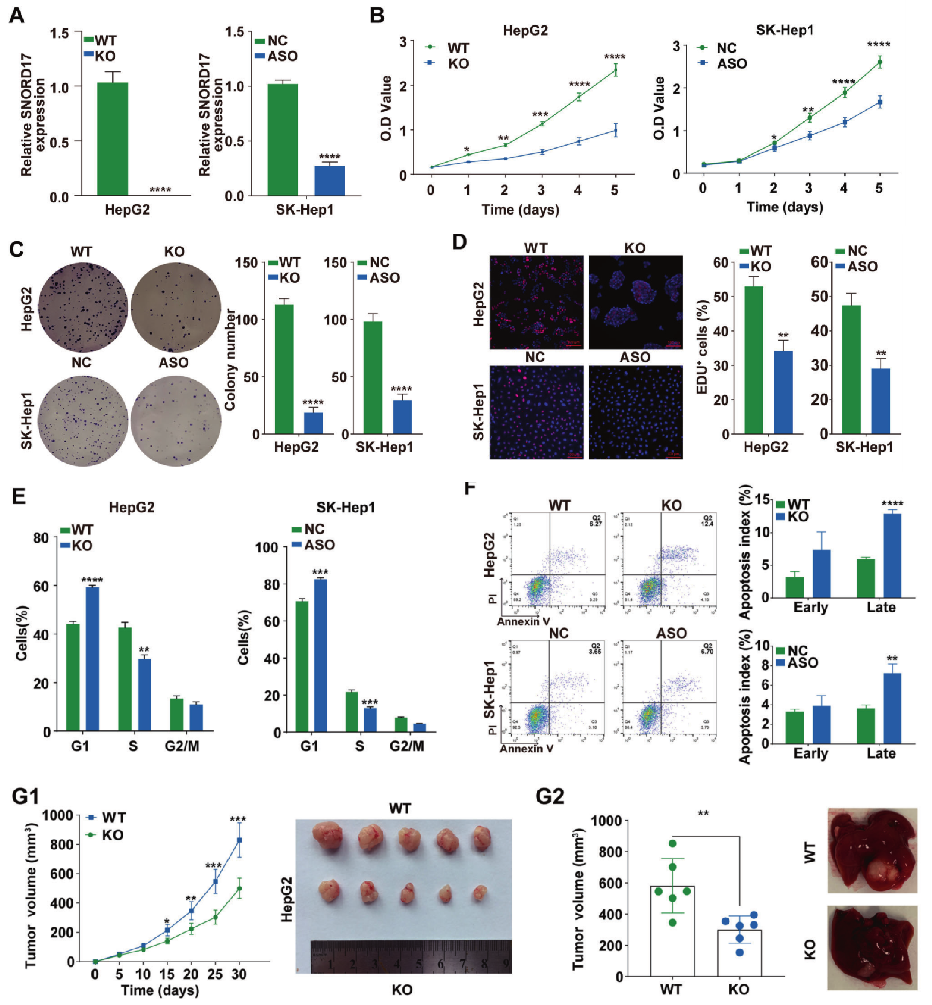
图1
为了探索SNORD17促进肝癌发展的分子机制,研究人员通过mRNA表达谱检测、Western Blot 检测、Luciferase报告基因检测、增殖、克隆形成实验发现p53可以通过调控SNORD17的表达进而影响HCC细胞生长。
综上所述,SNORD17通过与MYBBP1A结合并抑制其转移到核质,从而抑制乙酰基转移酶p300调节的p53乙酰化。SNORD17在HCC中调节p53的稳定性和活性,增加了p53调控网络的复杂性,有望成为HCC治疗的新靶点。同时该项研究也进一步证实了snoRNAs在肿瘤发生中的关键作用,并可作为各种癌症的预后标志物,这对后续的癌症治疗研究也起到了一定的借鉴作用。点击查看案例详情>>
CRISPR/cas9介导的NSD1敲除通过NSD1/H3/Wnt10b信号通路抑制HCC的发展
有研究表明,核受体结合的SET结构域蛋白1 (NSD1)的体细胞失调与HCC的肿瘤发生有关,提示NSD1可能是这种恶性肿瘤的预后靶点。因此,为了研究NSD1如何通过调控Wnt/β-catenin信号通路调控HCC进展,Zhang等研究人员利用CRISPR/Cas9基因组编辑系统构建NSD1基因敲除细胞株,通过肝癌细胞增殖、迁移和侵袭等一系列实验研究NSD1基因敲除细胞株,以及通过染色质免疫沉淀法(ChIP)研究NSD1基因对组蛋白H3、Wnt10b和Wnt/β-catenin信号通路的调控作用。结果表明NSD1基因敲除可以抑制肝癌细胞的增殖、迁移和侵袭能力。CRISPR/cas9介导的NSD1敲除促进了H3K27me3的甲基化,减少了H3K36me2的甲基化,从而抑制了Wnt10b的表达。结果表明,Wnt/β-catenin信号通路的失活抑制了肝癌细胞的增殖、迁移和侵袭。
CRISPR/cas9介导的外显子跳跃内在激活β-catenin信号有助于HCC中的免疫逃逸
最近有研究通过对临床样本的综合分析,发现了肝细胞癌(HCC)的分子和免疫学分类,而CTNNB1 (β-catenin)突变亚型表现出免疫抑制肿瘤微环境的独特特征。为了阐明分子机制,Masafumi Akasu等研究人员通过修改lentiGuide-Puro质粒(Nat方法),开发了一种高效的基于多重CRISPR/ cas9的外显子跳跃基因组工程系统,该系统由张峰实验室提供。利用该系统首次构建了β-catenin外显子3跳跃突变的人、小鼠肝癌细胞模型,促进核易位,激活Wnt/β-catenin信号通路。基因集富集分析表明,在激活β-catenin信号通路的HCC细胞中,免疫相关基因组下调。通过比较分析野生型和外显子3跳跃β-catenin的HCC细胞之间的基因表达谱,发现在人肝癌细胞和小鼠肝癌细胞中,4种细胞因子的表达水平普遍降低。373个人类HCC样本的公开外显子组和转录组数据显示,在具有β-catenin热点突变的HCC肿瘤中,两种候选细胞因子基因CCL20和CXCL2显著下调。T细胞杀伤试验和移植肿瘤组织的免疫组化分析表明,小鼠Ctnnb1Δex3肝癌细胞逃过了免疫监测。综上所述,该研究发现由β-catenin信号激活控制的细胞因子可能有助于免疫逃逸,并为β-catenin突变的HCC亚型的癌症免疫治疗提供了新的见解。
源井生物基于传统的CRISPR/Cas9技术进一步研发了CRISPR-U™独家专利技术,具有更高的基因编辑效率,目前源井生物已凭借该技术成功构建了拥有近3000种KO细胞的基因敲除细胞库,包括上文提及的相关基因敲除细胞系如CTNNB1基因敲除A549细胞系/CTNNB1基因敲除HEK293细胞系、WNT10B基因敲除A549细胞系/ WNT10B基因敲除HEK293细胞系、SNORD17 基因敲除Hep G2细胞系等,我们还筛选出NF-kB、Hedgehog、JAK-STAT、MAPK、Notch、PI3K-Akt、TGF-beta、Wnt 共8大热门信号通路其中近800种关键基因构建敲除细胞系,现低至8000即可一周内获得成功敲除的KO细胞,轻松实现各类研究。