 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
“基因敲除CHO细胞系”(中国仓鼠卵巢细胞)是源自中国仓鼠卵巢细胞的实验室培养的细胞系技术。中国仓鼠是一种流行的实验室哺乳动物,部分原因是它们的体积小且染色体数少,使其成为组织培养和放射学研究的良好模型。 CHO细胞是生物学,医学和药学研究中常用的哺乳动物细胞模型。另外,它们通常用于商业目的以产生治疗性重组蛋白。对治疗性蛋白质的需求不断增长,导致了在CHO表达系统中促进高质量和高生产率的技术的发展。已经建立了CHO培养过程,使用CHO细胞生产治疗性蛋白质的成本与微生物培养的成本相当。
使用CRISPR/Cas9和荧光富集产生三重敲除CHO细胞系
先前已经证明,CRISPR / Cas9基因编辑技术是用于CHO细胞基因破坏的有效工具。稳定的细胞系在这项研究中,研究人员通过在CHO细胞的多个环境被同时破坏FUT8,BAK和BAX,进一步证明了CRISPR/Cas9基因组编辑的适用性和效率。为了从转染的细胞库中分离出表达Cas9的细胞,GFP通过2A肽与Cas9核酸酶连接。使用这种方法,在三个基因组位点产生的平均插入缺失频率从富集前的11%增加到富集后的68%。尽管在富集的细胞池中存在大量的基因组编辑事件,但从脱靶预测然后进行深度测序均未观察到明显的脱靶效应。对富集的多重细胞进行单细胞分选,并对97个克隆进行深测序,发现有4个单基因,23个双基因和34个三基因破坏的细胞系。如预期所选的,对选定的潜在三方敲除克隆的进一步表征证实了Bak和Bax蛋白的去除并破坏了岩藻糖基化活性。与野生型CHO-S细胞相比,敲除细胞系显示出对凋亡的增强抵抗力。总之,与CRISPR/Cas9的多路复用可以进一步加速CHO细胞中的基因组工程工作。
敲除难以去除的CHO宿主细胞蛋白脂蛋白脂肪酶,以提高单克隆抗体制剂中山梨酸酯的稳定性
尽管大多数宿主细胞蛋白(HCP)杂质在典型的下游纯化过程中已被有效去除,但是一小部分HCP尤其具有挑战性。先前的研究已经确定了由于多种原因而具有挑战性的HCP。脂蛋白脂肪酶(LPL)是中国仓鼠卵巢(CHO)HCP,具有水解甘油三酸酯中的酯的功能。它是先前研究中确定的十种HCP之一,很容易保留在下游的加工中。由于聚山梨酯和甘油三酸酯之间的结构相似性,LPL可能会使最终产品配方中的聚山梨酯80(PS-80)和聚山梨酯20(PS-20)降解。在这项工作中,发现重组LPL在一系列mAb制剂的典型溶液条件下对PS-80和PS-20具有酶促活性。使用CRISPR和TALEN技术创建LPL基因敲除CHO细胞。与野生型样品相比,所得细胞培养物收获物证明聚山梨酯降解显着降低,而对细胞生存力没有显着影响。
优化CRISPR / Cas9策略,可在CHO细胞中进行同源性导向的转基因多靶点整合
特定于站点的整合已成为一种精准的中国仓鼠卵巢(CHO)细胞系工程和可预测的细胞系发育(CLD)的前途和策略中。具有同源性定向修复(HDR)途径的CRISPR / Cas9能够将转基因精确整合到目标基因组位点中。然而,对转基因的HDR介导的靶向整合(TI)固有的顽固性导致靶向效率低下,因此需要选择过程才能在CHO细胞中找到靶向整合体。研究人员使用基于启动子-Trap的单或双敲入(KI)监视系统探索了几个影响目标效率的参数。与传统的环形供体质粒相比,增加了单向导RNA识别序列对供体模板设计进行的简单更改,可显着提高KI效率(2.9–36.0倍),取决于整合位点和细胞培养模式,可提高KI效率。此外,顺序和同时进行的KI策略使我们无需额外的富集程序即可获得约1-4%的双KI细胞群体。因此,这种简单的优化策略不仅可以在CHO细胞中实现高效的CRISPR/Cas9介导的TI,而且还为在一个实验步骤中多重KI的适用性铺平了道路,而无需顺序和独立的CHO-CLD程序。
Ubigene具有400多种类型的原代细胞,包括上皮细胞,内皮细胞,平滑肌细胞和不同物种(例如人,大鼠和小鼠)的成纤维细胞。我们可以为每个主单元提供验证报告。我们的原代细胞已被许多研究机构和制药企业广泛使用。
Reference
Grav L M, Lee J S, Gerling S, et al. One‐step generation of triple knockout CHO cell lines using CRISPR/Cas9 and fluorescent enrichment[J]. Biotechnology Journal, 2015, 10(9): 1446-1456.
Chiu J, Valente K N, Levy N E, et al. Knockout of a difficult-to-remove CHO host cell protein, lipoprotein lipase, for improved polysorbate stability in monoclonal antibody formulations[J]. Biotechnology and Bioengineering, 2017, 114(5): 1006-1015.
Shin S W, Lee J S. Optimized CRISPR/Cas9 Strategy for Homology‐Directed Multiple Targeted Integration of Transgenes in CHO Cells[J]. Biotechnology and Bioengineering, 2020.
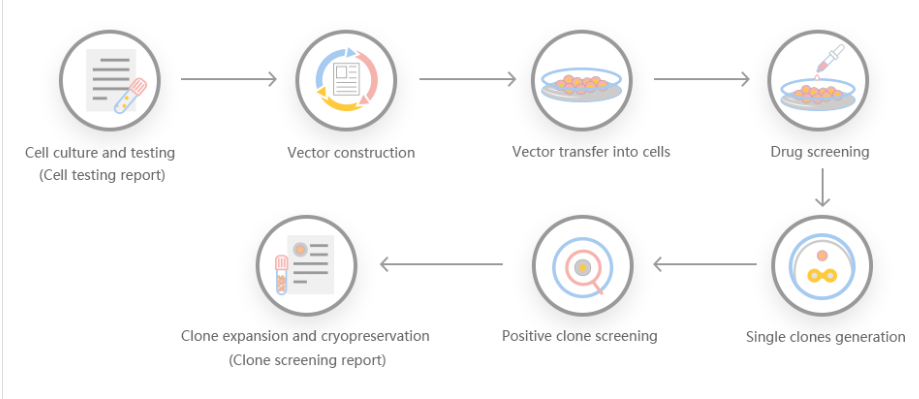
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。