 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
基因敲除被定义为使基因功能失活的突变。这种突变对现代技术和经典遗传研究(例如功能基因组学)非常有益。过去,转座诱变技术的通常用于敲除细菌基因。需要费力的筛选才能找到目的基因敲除。传统上,体外基因工程敲除其他生物的最初用途是改变质粒或细菌人工染色体(BAC)中包含的基因。然后,将这些修饰的构建体通过细胞培养技术转移到目标生物体中。同时,基因敲除策略也是工业界识别靶标微生物中新药靶标的有力工具。
敲除被广泛用于确定靶基因的功能,检测蛋白质产物,并与抑制其功能时可能发生的疾病有关。您可以使用分子技术,例如定点诱变或天然突变体(包括基于PCR的锌指核酸酶和Lambda(λ)Red Recombination,CRISPR/Cas9技术)进行选择。 CRISPR/Cas9系统由于其易用性和快速性而已成为最受欢迎的系统。 Numorus细菌已经过基因编辑以用于医学研究。
厌氧嗜热酵母JW/SL-YS485的L-乳酸脱氢酶的克隆及基因敲除消除乳酸的产生
PCR和Southern证实,在定点双交换事件发生后,嗜热厌氧细菌JW/SL-YS485的L-乳酸脱氢酶编码基因被克隆,测序,并用于获得L-ldh缺失突变菌株(TD1)。TD1菌株的生长速率和最终细胞密度类似于在葡萄糖和木糖上生长的野生型。在所有测试时间中,乳酸均低于TD1菌株对葡萄糖和木糖的检出限(0.3 mm),但在野生型菌株中很容易检测到。葡萄糖和木糖的平均最终浓度为8.1和1.8 mm。分别。消除作为发酵产物的乳酸会相应增加乙酸和乙醇的产率。此处报告的结果代表了使用代谢工程技术开发会不会产生有机酸的嗜热厌氧细菌菌株的一步,并支持该方法的实施是否具有下一步的可行性。
Schefflera CRISPR/Cas9基因敲除系统构建纤维素合成酶gRNA表达载体
CRISPR/Cas系统最早发现于细菌中,对入侵的病毒或噬菌体的DNA免疫。基于CRISPR/Cas系统的免疫机制,设计的CRISPR/Cas9基因编辑系统已被广泛用于拟南芥和水稻等高等植物的基因组功能研究,已成为真核基因编辑的主要工具。大肠杆菌以Li纤维素合成酶(CESA)为研究对象,构建了一个表达CESA-gRNA的CRISPR/Cas9基因敲除系统。使用LcCESA1基因外显子5'端第一个外显子区域的GN19 NGG序列设计gRNA引物。研究人员使用p201N-Cas9作为载体,使用Gibson Assembly Master Mix作为连接酶将CESA1-gRNA连接到p201N-Cas9,并通过Gibson Assembly技术构建了p201N-Cas9-CESA1-gRNA载体。根据插入载体的序列,研究人员设计了两种测试引物。通过PCR扩增鉴定出适当大小的序列。插入序列的测序结果证实了gRNA已正确连接到载体。定向编辑CESA基因的p201N-Cas9-gRNA载体对于确定百合中的Li纤维素合成酶的功能具有重要意义。
福尔马林杀死和aroA基因敲除安圭弧菌疫苗对比目鱼的保护作用比较
木质素是多酚杂聚物,占木质纤维素的18%至35%,被认为可以防止纤维素生物燃料的商业化。从自然降解的玉米秸秆中分离出了多粘芽孢杆菌CR1,证明使用木质素作为唯一的碳源可以产生酒精。 P. polymyxa CR1的基因组测序和比较基因组学确定了两个同源物,Dyp型过氧化物酶和漆酶,它们先前与其他细菌的木质素代谢有关。所鉴定基因的敲除突变体没有生长缺陷。 Polymyxa CR1无法代谢木质素的常见芳香族中间体,这表明细菌已采用了新的分解代谢途径。为了鉴定涉及木质素代谢的基因,产生并筛选了转座子文库。
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因细胞敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促红细胞生成素在人体内稳定表达的机制。
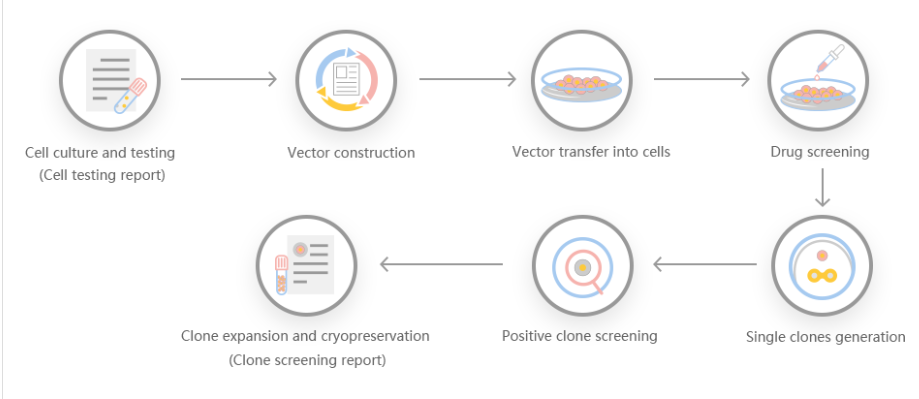
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
References:
1. GAN Shi-Hu, CUI Xiao-Teng, MA Jin-Zheng, FANG Li-Jiao, LIU Ming-Xia, REN Yuan-Yuan, CAO Xiao-Na, YANG Jie, SU Chao. 2.Using CRISPR-Cas9 gene-editing technology to knock out the Tudor-SN gene of H9c2 cells to inhibit cell cycle arrest and proliferation. Chinese Journal of Biochemistry and Molecular Biology, 2018.07.10.
2. Deng Qin, Liu Cheng, Zhang Jing, Li Gang. The effect of knocking out C3G on the proliferation and apoptosis of H9C2 cardiomyocytes. Chinese Journal of Cell Biology: 1-6[2020-06-09].
3. HU Su-lei, LI Gang, FU Yan-bo, DENG Qin, LIU Cheng. Dock180 knockout inhibits proliferation and promotes apoptosis of rat derived H9C2 cardiomyocytes strain. Basic & Clinical Medicine. 2017, 37(4).
源井生物是海外归国人员和生物科技领域行业精英联合创建的高科技企业,坐落于广州高新技术产业的示范基地——科学城。源井生物拥有1000平方的实验室和办公区域,包含基因编辑技术平台,细胞生物学技术平台和斑马鱼研究技术平台。源井生物是以提供基因编辑载体/病毒/细胞,原代细胞和斑马鱼相关产品及服务的高科技企业,旨在为客户提供更好的细胞或动物水平研究的基因编辑工具。
让基因编辑更简单,是源井生物的企业目标。CRISPR-U™是源井生物自主研发的基因编辑技术(基于CRISPR /
Cas9技术),CRISPR-U™技术比普通CRISPR/Cas9技术的基因切割效率更高,同时可以大幅度提升同源重组效率,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。利用CRISPR-U™的技术优势,源井生物已成功在超过70种细胞系上实现基因编辑。
CRISPR-B™是源井生物在基于Red/ET重组系统和CRISPR/Cas9基因编辑系统基础上,通过自主研发优化基因编辑载体和基因编辑流程,在基因编辑效率和准确性均远高于传统方法的一项创新性技术。该技术可以广泛应用于细菌和真菌的基因编辑,轻松实现细胞和动物水平的基因敲除(KO)、基因点突变(PM)和基因敲入(KI)。
源井生物拥有超过400种的原代细胞产品,包括人、大鼠和小鼠等不同物种、不同组织来源的上皮细胞,内皮细胞,平滑肌细胞和成纤维细胞等,同时针对每种细胞均可以提供严格的质量鉴定报告,产品已广泛应用到知名科研院所和制药企业。
一、基因编辑技术平台
——聚焦于CRISPR-U™和CRISPR-B™基因编辑技术的应用
1、平台可提供各类型的基因编辑载体,应用于不同生物的基因编辑;
2、平台可提供多类型的病毒包装,包括慢病毒,腺病毒和腺相关病毒等相关服务;
3、平台可提供高质量的基因敲除,基因点突变和基因敲入稳转细胞株技术服务。
二、细胞生物学技术平台
——聚焦于原代细胞的科研工具供应商
1、平台可提供超过400种原代细胞研用细胞库;
2、平台可提供不同细胞类型所需要的培养方案和相关培养产品;
3、平台可提供细胞分离,提取,鉴定等常规细胞生物学技术服务。
务实,高效,坦诚和守信是源井生物的企业准则,我们立志于服务好每一位选择源井,信任源井的客户,为客户提供有价值的产品和服务而不懈努力。