从科学问题到实验设计:以CRISPR文库筛选解析细胞焦亡调控网络为例


从科学问题到实验设计:以CRISPR文库筛选解析细胞焦亡调控网络为例
引言:从好奇到问题,为什么细胞会选择死亡?
科学研究常常始于一个简单却深刻的问题。在免疫学和细胞死亡研究中,这个问题可以被提出为:当细胞面对同样的病原刺激时,为什么有的细胞会迅速死亡,而另一些却能够幸存?近年来,随着对细胞程序性死亡研究的深入,细胞焦亡(pyroptosis)逐渐被广泛关注。焦亡不同于经典的凋亡,也区别于被动性的坏死,其独特之处在于炎症性反应。焦亡的分子特征是 Gasdermin 蛋白在炎症性半胱天冬酶的作用下被切割,裂解产生的 N 端片段能够嵌入细胞膜并形成孔洞,导致细胞迅速肿胀、破裂,并释放 IL-1β、IL-18 等炎症因子。
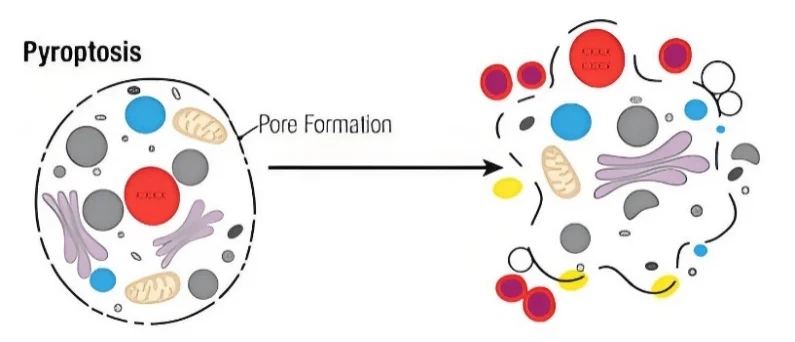
图1. 细胞焦亡
细胞焦亡在抵御细胞内病原体(细菌、病毒、真菌或原生动物)时发挥重要作用,它通过触发强烈的局部炎症反应来增强免疫防御。然而,焦亡若被过度激活,则可能引发组织损伤与慢性炎症,甚至参与某些自身免疫疾病和神经退行性疾病的发生。因此,一个亟待回答的核心问题是:细胞焦亡的发生究竟是如何受到调控的?又有哪些基因决定了细胞在遭遇病原体或应激条件时,选择走向焦亡通路?
传统分子生物学方法往往以单基因为研究单位,难以有效回答这些系统性问题。要揭示焦亡的调控机制,需要更高通量、无偏倚的方法。CRISPR 文库筛选技术正是这样一种强有力的工具,它能够在一次实验中对数万个基因进行扰动,并通过表型选择来快速定位关键因子。本文以“细胞焦亡调控基因的筛选”为例,展示如何从科学问题出发,设计基于 CRISPR 文库的系统性实验,并总结出一种可扩展的方法论框架。
一、从问题到实验:如何找出焦亡的调控因子
科学问题的提出只是研究的起点,关键在于如何将问题转化为可操作的实验路径。以焦亡为例,研究者首先需要明确研究对象的核心特征,即其作为一种炎症性程序性细胞死亡方式,主要表现为细胞膜破裂、炎症因子释放和强烈的免疫激活。围绕这一特征,研究目标可以进一步聚焦到“识别影响焦亡发生的调控因子”这一任务上。
1. 拆解焦亡路径:上游信号到下游执行
要实现这一目标,需要将复杂的生物学过程分解为不同的环节。上游涉及炎症小体的识别与组装(如 NLRP3、AIM2、NLRC4),中游包括炎症性半胱天冬酶的激活(Caspase-1/4/5/11),下游则是 Gasdermin 蛋白的裂解与膜孔形成,以及伴随的炎症因子 IL-1β/IL-18 的成熟与释放。研究者需要明确在这些环节中,哪些分子尚未被系统性探索。
2. 选择CRISPR 文库:从表型到关键基因
CRISPR 文库筛选为这一科学问题提供了天然契合的研究工具。焦亡具有鲜明的二元性表型(死亡或存活),这一特征使其特别适合以生存为基础的筛选策略。在文库筛选得到候选基因后,还需通过单基因敲除、蛋白检测和功能实验加以验证,最终重建调控网络。
由此,原始科学问题被转化为一条清晰的研究路径:通过焦亡诱导建立筛选条件 → 进行 CRISPR 文库实验 → 分析测序结果并识别候选基因 → 逐一验证并构建调控网络。
二、焦亡揭秘:细胞膜破裂背后的分子故事
要合理设计实验,首先必须深入理解细胞焦亡本身的生物学内涵。焦亡是一种依赖炎症性半胱天冬酶的程序性细胞死亡方式,其核心机制是 Gasdermin 蛋白的裂解与膜孔形成。该过程最终导致细胞膨胀、膜破裂,并伴随促炎因子 IL-1β 和 IL-18 的释放,从而在局部乃至系统范围内触发炎症反应。焦亡主要通过两条途径发生:
- - 经典通路 (Canonical Pathway):该途径依赖于半胱天冬酶-1(Caspase-1)的激活。病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)被细胞内的炎症小体(如NLRP3、AIM2)识别,随后炎症小体募集并激活Caspase-1。活化的Caspase-1会裂解前体形式的IL-1β和IL-18,使其成熟并释放,同时切割 Gasdermin家族的关键执行蛋白GSDMD。GSDMD被切割后产生的N端片段(GSDMD-N)寡聚化并插入细胞膜,形成孔洞,导致细胞内容物外泄和细胞裂解。
- - 非经典通路 (Non-canonical Pathway):这一途径独立于Caspase-1,主要由胞内脂多糖(LPS)直接激活Caspase-4/5/11 19。活化的Caspase-4/5/11随后直接切割GSDMD,触发与经典通路相似的细胞膜穿孔和焦亡。
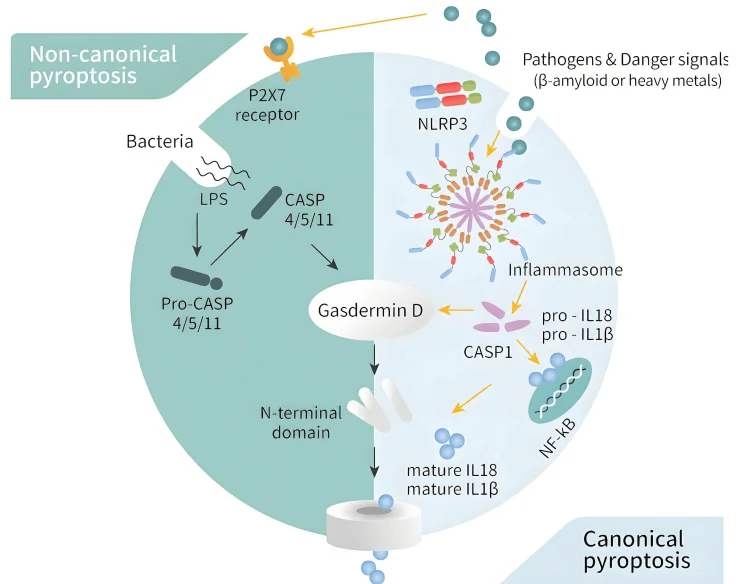
图2. 细胞焦亡的两大核心通路
从分子机制角度看,焦亡过程包括炎症小体的激活、caspase 的活化、Gasdermin 蛋白裂解以及最终的细胞膜破裂和促炎因子释放。炎症小体如 NLRP3、AIM2、NLRC4 能够识别病原体或细胞应激信号,从而招募并激活 Caspase-1;在人细胞中,Caspase-4/5 则可通过非经典途径介导焦亡,而在小鼠细胞中,Caspase-11 扮演类似角色。被 Caspase 切割的 GSDMD 释放出 N 端片段后,可在膜上形成直径约 10–20 nm 的孔洞,导致离子失衡、细胞肿胀与破裂,同时伴随 IL-1β 和 IL-18 等炎症因子被动释放。
看得见的死亡,膜破裂与炎症因子释放:
实验上,焦亡具有明确的检测标志。细胞膜破裂可通过 LDH 释放量或 PI/SYTOX 染色进行监测,炎症小体组装可通过 ASC speck 的形成观察,而 IL-1β 和 IL-18 的分泌则可通过 ELISA 定量分析。这些指标不仅能够明确焦亡发生的时间和程度,也为后续基因筛选和机制验证提供了可靠的表型依据。
凋亡 vs 焦亡
与细胞凋亡相比,焦亡的表型更加明显。凋亡细胞体积缩小、膜保持完整、DNA 片段化且不触发炎症反应,而焦亡细胞则表现为细胞膨胀、膜破裂并释放大量炎症因子,引发强烈免疫激活。这些显著差异使得焦亡成为研究炎症性细胞死亡及其调控网络的理想模型。
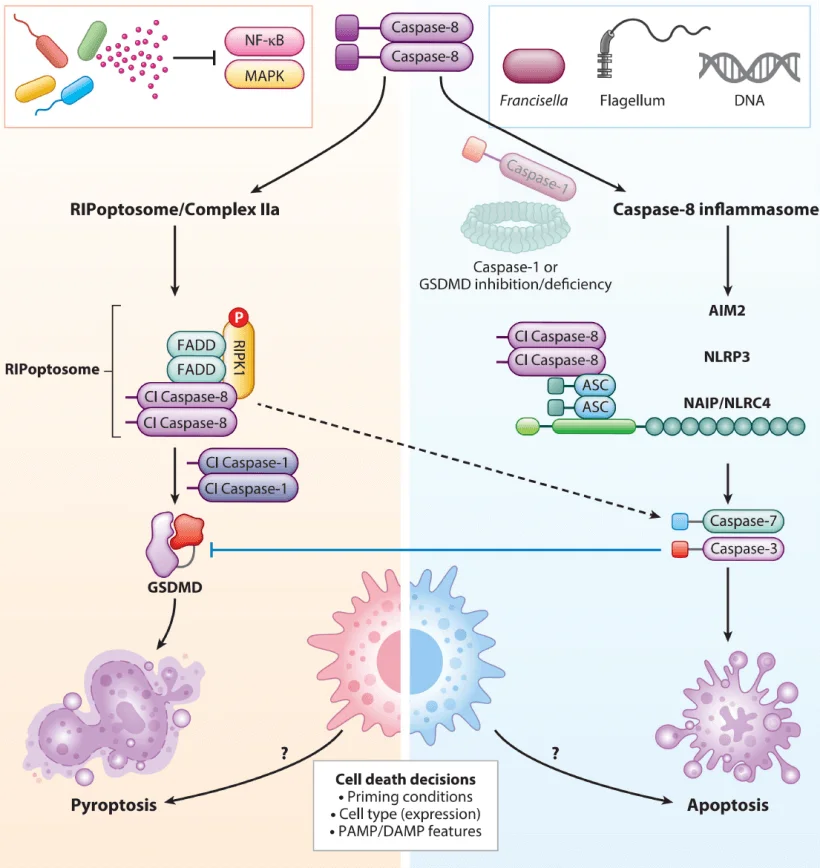
图3. 细胞焦亡与细胞凋亡主要区别(Annu.Rev. Microbiol.2023.77:45 1-77)
三、CRISPR 文库如何锁定关键基因
CRISPR-Cas9 技术通过 Cas9 蛋白在gRNA 的引导下切割目标 DNA,从而实现基因敲除。当该技术被扩展为文库筛选时,研究者可以在一次实验中对全基因组范围内的基因功能进行系统性评估。一个典型的 CRISPR 文库包含数万条 sgRNA,每个基因通常对应 3–6 条独立的靶点序列。在筛选实验中,文库通过慢病毒感染方式导入稳定表达 Cas9 的细胞群体,随后在特定选择压力下(如焦亡诱导)进行筛选。
由于焦亡的表型具有鲜明的生死二分性,存活群体中的 sgRNA 会因特定基因的缺失而富集。通过提取基因组 DNA、扩增 sgRNA 片段并进行高通量测序,可以统计 sgRNA 的丰度变化,最终推断出潜在的关键调控因子。焦亡筛选的适用性尤其体现在三个方面:首先,其二元性表型使生存类筛选非常高效;其次,CRISPR 文库的无偏性使得已知与未知的基因调控因子都可能被捕获;最后,该策略可推广到凋亡、铁死亡、自噬甚至药物耐受等多种生物学过程。
四、从设计到落地:高效筛选焦亡调控网络的实验策略
在设计基于 CRISPR 文库的焦亡筛选实验时,研究目标应聚焦于绘制完整的调控网络,涵盖正调控与负调控因子。细胞模型方面,THP-1 单核细胞是研究焦亡的经典模型,常用诱导条件包括 LPS + Nigericin 以激活 NLRP3 炎症小体,或电转染 LPS 来模拟非经典途径。
文库选择通常采用全基因组敲除文库,如 Brunello 或 GeCKO v2,以保证覆盖度和代表性。在体外实验中,覆盖度需维持在500 X以上,而在流式分选实验中,300x的覆盖度则较为常见。筛选策略可以根据实验目标分为两类:其一是基于存活与死亡差异的生存筛选,适合快速初筛;其二是基于流式分选的精细筛选,通过膜通透性染料、Caspase-1 激活探针或 ASC speck 标志来区分不同阶段的焦亡细胞,从而捕捉负调控因子与阶段性调控机制。
为确保筛选结果可靠,实验设计中需控制感染多重性(低MOI,确保单细胞仅携带一个 sgRNA),并通过抗性筛选去除未感染细胞。同时,需保留初始输入样本作为参照,以便后续的统计学分析。
五、关键环节揭秘:如何让筛选实验精准可靠
实验实施过程中,首先需要建立 Cas9 稳定表达的细胞株,保证高效的基因编辑能力。随后进行文库感染与扩增,确保 sgRNA 的分布均一与覆盖度充足。焦亡诱导条件需要预先优化,以确定合适的时间窗口。通常在刺激 30–90 分钟时,能够观察到典型的膜破裂与炎症因子释放。
在分群收集环节,可直接分离存活群体,或通过流式分选获得早期与晚期焦亡群体,以满足不同研究目的。接下来的步骤包括基因组 DNA 提取、sgRNA 扩增、测序与数据分析。常用的统计分析工具如 MAGeCK,能够结合多条 sgRNA 的富集信号,输出候选基因名单。
质控关键点:质控环节至关重要。研究者需通过 Gini 系数检测文库分布的均一性,并通过阳性对照基因(如 NLRP3、CASP1、GSDMD)的显著富集情况验证筛选有效性。同时,实验重复间的相关性分析也是结果可靠性的必要保障。
六、从候选到真相:逐一验证焦亡调控因子
文库筛选的直接产物是一份候选基因清单,但这些结果需要通过后续实验加以验证。首先,可以针对候选基因设计多条 sgRNA,建立单基因敲除株,并通过蛋白检测(Western Blot)确认编辑效率。其次,在相同的焦亡诱导条件下,检测 LDH 释放、IL-1β 水平及炎症小体组装情况,比较与文库筛选结果是否一致。
进一步的机制研究可以通过时间序列实验来揭示候选基因在焦亡不同阶段的作用,或结合药理学工具进行定位,例如利用 MCC950 阻断 NLRP3,或利用 Disulfiram 抑制 GSDMD,从而明确候选基因在调控通路中的作用环节。跨模型验证亦不可或缺,例如在不同细胞系或动物模型中重复实验,以评估结果的普适性。
七、通用方法论:用焦亡案例构建系统研究框架
通过细胞焦亡的案例,可以总结出一套通用的方法论框架。首先,明确科学问题并定义清晰表型,这是筛选实验成功的前提。其次,在设计实验时需要合理选择筛选方式与覆盖度,确保结果既具备广度,又具备分辨率。再次,严谨的质控与合理的对照设置是保证实验数据可靠性的核心。最后,文库筛选结果应被视为假设生成的起点,而非终点,必须通过独立实验验证与跨体系扩展来增强可信度。
这一框架不仅适用于焦亡研究,也同样适用于凋亡、铁死亡、自噬等其他程序性细胞死亡形式的探索,甚至可以扩展到药物耐受与疾病机制的研究。
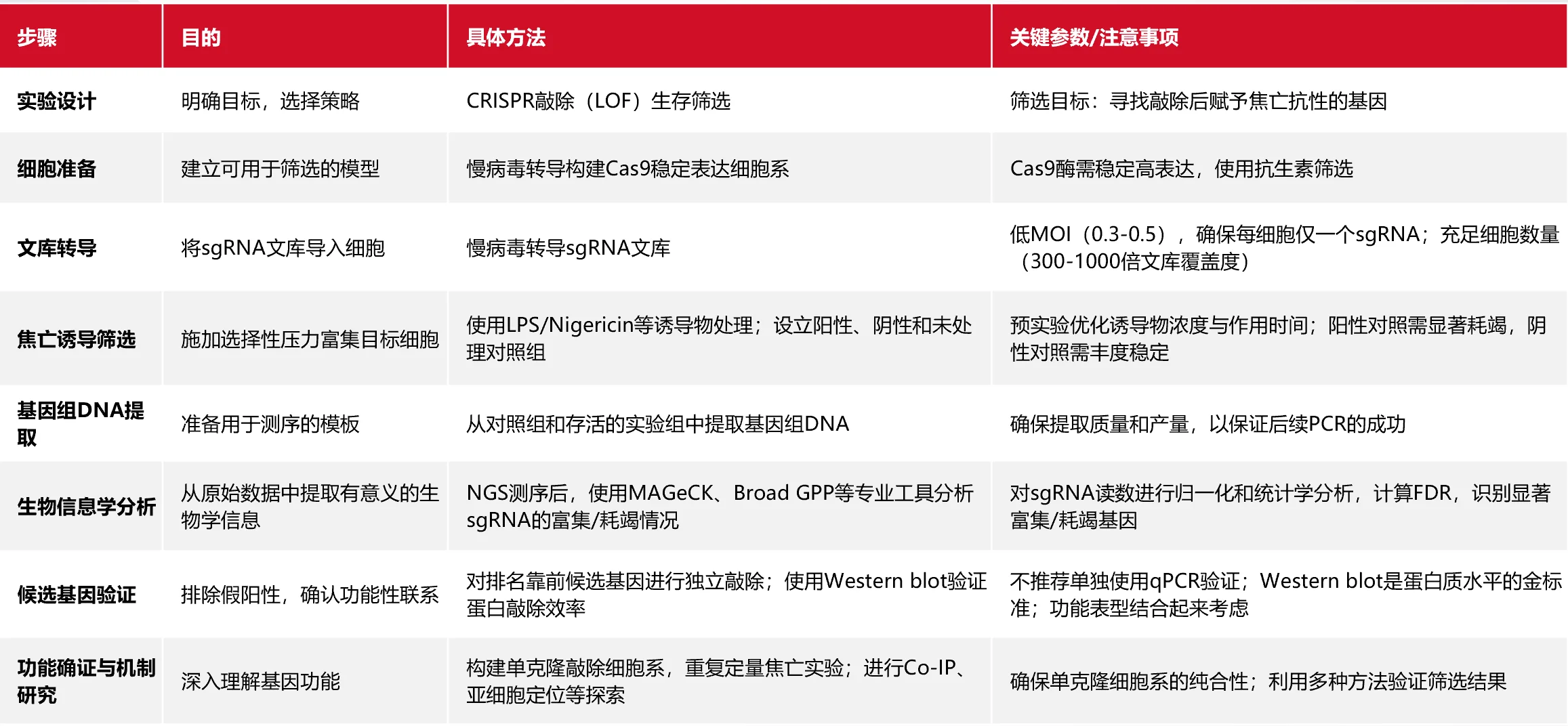
图4. 方法论总结
结语
科学研究的本质在于从问题出发,找到合适的工具并设计合理的实验来寻求答案。以细胞焦亡为例,CRISPR 文库筛选技术不仅帮助我们识别新的调控因子,还提供了一种可借鉴的方法论路径:明确问题、匹配工具、控制变量、验证假设、再到应用转化。这一思路同样适用于其他复杂生物过程的研究。从基础机制的探索,到疾病病理的解析,再到新靶点的发现与药物研发,CRISPR 文库筛选正在成为连接基础研究与临床应用的重要桥梁。
源井生物:体外+体内 CRISPR 筛选全流程
源井生物CRISPR 文库体外+体内筛选服务,搭载全新 iScreenAnlys™ 文库分析平台,从筛选设计到数据解析全流程加速:体外筛选低至¥1.5W、快至6周即可交付;体内筛选真实还原肿瘤微环境;文库分析平台零代码上手,一键生成期刊级图表。助力科研团队更快、更稳、更高效地发现高价值靶点!联系我们获取更多技术支持>>
参考文献
1.Galluzzi, L., Vitale, I., and Aaronson, S. A., et al. (2018). Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ, 25(3), 486-548.
2.Frank, D., & Kagan, V. (2018). Pyroptosis: The Cell’s Self-Destruct Pathway. Springer.
3.Liu, Y., Li, S., and Chen, S., et al. (2024). S-palmitoylation of GSDMD by DHHC7 facilitates its membrane translocation and pyroptotic cell death. Nat Cell Biol, 26(2), 272-286.
4.Herrmann BI, Grayczyk JP, Brodsky IE. Collab or Cancel? Bacterial Influencers of Inflammasome Signaling. Annu Rev Microbiol. 2023 Sep 15;77:451-477.
5.Doudna, J. A., & Charpentier, E. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213), 1258096.
6.Shalem, O., Sanjana, N. E., Hartenian, E., et al. (2014). Genome-scale CRISPR-Cas9 knockout screening in human cells. Science, 343(6166), 84-87.











