 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
Nature子刊!|源井基因编辑细菌—揭示分泌素的膜易位机制

细菌II型分泌系统(T2SS)广泛存在于多种变形菌中,包括非致病性大肠杆菌(E. coli)、产肠毒素大肠杆菌(ETEC)、肠致病性大肠杆菌(EPEC)等。T2SS底物在非致病菌中可促进细菌从环境中吸收营养物质或与植物、动物共生;而在致病菌中,T2SS底物可帮助粘附宿主,使宿主细胞中毒,抑制宿主免疫功能,引起多种疾病。由于T2SS底物功能多样,且与毒力和疾病密切相关,因此了解其结构和作用机制对了解细菌功能和制定抗菌策略是十分必要的。
徐州医科大学石小东课题组在nature communications发表了题为Membrane translocation process revealed by in situ structures of type II secretion system secretins(IF=16.6)的研究论文,该研究采用冷冻断层三维成像技术(cryo-ET),在野生型及敲除GspS蛋白的大肠杆菌(由源井生物构建)中,解析了大肠杆菌T2SS两种类型分泌素(克雷伯菌型分泌素GspDα和弧菌型分泌素GspDβ)的原位结构,并分别揭示出这两种分泌素的易位机制[1]。
作者首先对过表达GspDα的大肠杆菌细胞进行cryo-ET成像,但只在细菌内膜上观察到GspDα多聚体的颗粒,其俯视图和侧视图均清晰可见(图1a-d) 。进一步的观察发现,并非所有GspDα颗粒都是垂直插入内膜的,有些GspDα颗粒则是以一定的倾斜角度插入内膜(图1e-g)。作者一共框出32,000个在内膜上的GspDα颗粒,通过采用C15对称性进行数据计算,最终解析出GspDα在内膜上分辨率为9 Å的原位结构。该结构中,可以清晰地识别出N0-N3结构域,其中的N0结构域在GspDα的冷冻电镜单颗粒结构中是缺失的。最为重要的是,原位结构显示,GspDα在内膜上以两种不同的构象存在(图2b-c)。通过对GspDα在内膜上的运动轨迹进行分析,作者推测其可以围绕膜接触点在一定范围内摆动,即GspDα可以在两种构象之间转换。这些结果表明,在内膜上的GspDα多聚体处于一种可活动的、不稳定的状态,有助于其进一步被运输到外膜。
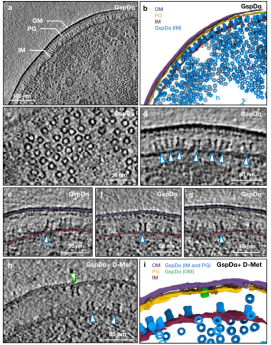
图1 GspDα分泌素在大肠杆菌胞外被膜上的可视化
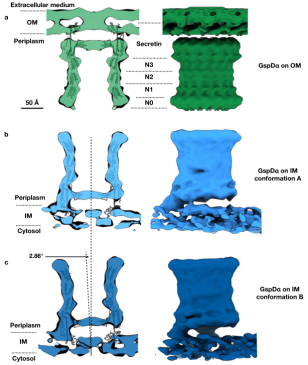
图2 GspDα分泌素在细菌内膜和外膜上的原位结构
为了证实是否由于肽聚糖网状结构的孔径太小,使得GspDα多聚体无法通过并转运到外膜,而是附着于内膜上,作者通过减少肽聚糖交联来研究其对GspDα外膜靶向的影响。先前的研究表明,大肠杆菌在含有高浓度D-蛋氨酸的培养基中生长会降低肽聚糖的交联,因此,作者在对D-蛋氨酸处理之后的GspDα过表达细胞进行了cryo-ET成像。结果显示,D-蛋氨酸处理成功使得部分GspDα颗粒出现在外膜上(图1h)。作者收集了在外膜上的GspDα颗粒进行了数据计算,解析出GspDα在外膜上的原位结构。结果表明,GspDα在外膜上只有一种构象,和外膜形成均匀分布的连接(图2a)。
GspDβ作为GspDα的同源物,其结构与GspDα相似,但膜的邻近侧有两处不同,可能会产生不同的跨膜区域和膜相互作用。此外,GspDβ具有不同的外膜靶向机制,称为先导蛋白的GspS可以结合到GspDβ的S结构域,并将GspDβ转运到外膜。因此,为了在外膜上观察GspDβ颗粒并验证GspS是否与GspDβ形成复合体,作者进行了两个实验。一种是在野生型大肠杆菌迷你细胞中诱导GspDβ和GspS表达,另一种是仅诱导GspDβ表达。
研究结果显示,同时过表达GspDβ和GspS之后,GspDβ颗粒位于外膜上(图3a),通过对514这样的颗粒采用C15对称性进行数据计算,发现GspS电子密度包围在GspDβ外侧,表明二者在外膜上以GspDβ-GspS复合体的形式存在(图3b)。当仅诱导GspDβ表达时,绝大部分GspDβ颗粒位于细菌的外膜上(图3c),少部分GspDβ颗粒位于细菌的内膜上(图3d)。通过挑选外膜上的颗粒进行计算,解析出来的结构依然是GspDβ-GspS复合体。上述这些结果表明,当GspS与GspDβ一起过表达时,它们在外膜上形成复合体。在不表达外源GspS的情况下,仅过表达GspDβ时,大肠杆菌内源性的GspS足以将GspDβ定位到外膜,然后附着在GspDβ上。
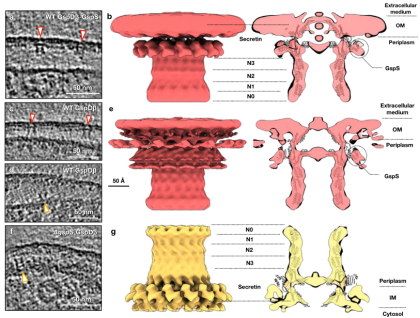
图3 GspDβ分泌素在细菌内膜和外膜上的原位结构
之前的生物化学研究结果表明,当GspS被敲除后,GspDβ会在细菌内膜上形成多聚体。为了在内膜上看到GspDβ,作者在敲除GspS的大肠杆菌细胞中过表达了GspDβ。结果显示,GspDβ颗粒全部出现在内膜上(图3f),在其原位结构中,观察不到GspS密度(图3g)。这些结果表明,当GspS被敲除后,GspDβ可以在细菌内膜上自组装成具有稳定构象的多聚体。
这项研究捕获到大肠杆菌T2SS两种分泌素在膜易位过程中的原位结构,揭示出两种不同的分泌素易位机制,增加了对T2SS分泌素的膜相互作用及其膜易位过程的认识,为分泌素生物生成过程提供了新的视角。
参考文献:
[1] Yu Z, Wu Y, Chen M, et al. Membrane translocation process revealed by in situ structures of type II secretion system secretins[J]. Nature Communications, 2023, 14(1): 4025.