 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
HuH-7细胞的定义:
HuH-7是一种人类肝细胞癌细胞系,最初于1982年从一名56岁的日本男性的肝脏肿瘤中取出。HuH-7是成人肝细胞癌细胞系,已在以下领域中广泛使用丙型肝炎和登革热病毒研究,有时通过使用CRISPR/Cas9技术创建CRISPR敲除细胞。近年来,出于研究目的,尤其是在涉及丙型肝炎基因敲除的研究中,HuH-7细胞主要在实验室中生长。 Huh7细胞系的引入允许筛选针对实验室培养的丙型肝炎病毒的候选药物,并允许开发针对丙型肝炎的新药物。
HuH-7是由上皮样和致瘤细胞组成的永生细胞系。大多数的HuH-7细胞是高度异质的,染色体数在55至63之间。这些细胞粘附在烧瓶或平板的表面。根据以前的研究,假设HuH-7细胞可以产生甲胎蛋白,胰酶α抗体,血浆铜蓝蛋白,纤维蛋白原,纤连蛋白等。因此,基因编辑敲除细胞HuH-7在涉及相关研究的过程中会有所帮助这些蛋白质。
基因编辑在HuH-7细胞系中的应用:
1.HuH-7人肝细胞株中CYP3A5 * 3的CRISPR / Cas9遗传修饰HuH-7细胞系衍生自肝癌,可以将细胞培养物中的底物MDZ转化为其代谢产物。然而,HuH-7细胞在MDZ代谢方面不是很有效,因为它们对于慢速代谢CYP3A5 * 3等位基因是纯合的。因此,需要开发一种基因敲除和点突变肝细胞系,以模拟与细胞培养物中CYP3A5 * 1基因型相关的药物快速代谢。研究人员假设,通过将HuH-7细胞系遗传修饰为代谢活性更高的CYP3A5 * 1/*1或*1/*3基因型,这些细胞将具有增加的MDZ和Tac代谢活性。为了验证这一假设,他们使用了CRISPR/Cas9生物工程技术来开发和表征新的细胞系,然后从表型上评估了基因型对MDZ和Tac代谢的影响。这些新改造的细胞可以在未来的研究中用作亲本细胞系,以评估其他遗传变异与药物代谢和其他药物代谢的关联。
2. HBV特异性gRNA和Cas9的共表达在体外抑制了HBV蛋白的产生
为了检查聚簇的规则间隔的短回文重复序列CRISPR/Cas9系统是否可以切割HBV基因组,我们设计了8种针对A基因型HBV的gRNA。利用HBV特异性gRNA,CRISPR/Cas9系统显着降低了HBV核心和表面的产生被HBV表达载体转染的HuH-7细胞中的蛋白,这产生了过表达的HuH-7细胞系。在八个筛选的gRNA中,鉴定出两个有效的。有趣的是,靶向保守的HBV序列的一种gRNA对抗不同的基因型。使用流体动力学-HBV持久性小鼠模型,研究人员进一步证明了该系统可以裂解含肝内HBV基因组的质粒并促进其在体内的清除,从而降低血清表面抗原水平。这些数据表明,CRISPR/Cas9系统可能在体外和体内破坏表达HBV的模板,表明其在消除持久性HBV感染方面的潜力。
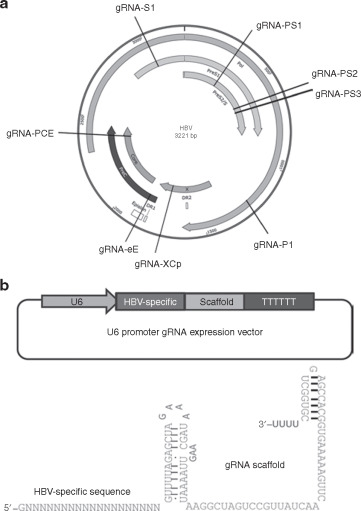
3.双gRNA引导的CRISPR/Cas9系统抑制乙型肝炎病毒复制
使用PCR和测序方法在与双gRNA和HBV表达载体共转染的HuH-7细胞中检测HBV表达载体的破坏,并用KCl沉淀,PSAD消化,滚动法检测HepAD38细胞DNA的破坏。环扩增和定量PCR相结合的方法。这些gRNA的细胞毒性通过线粒体四唑鎓测定法进行评估。结果表明CRISPR/Cas9系统可以有效破坏HBV表达模板(基因型A-D),而没有明显的细胞毒性。它可能是根除慢性HBV感染患者中持久性HBV DNA的潜在方法。
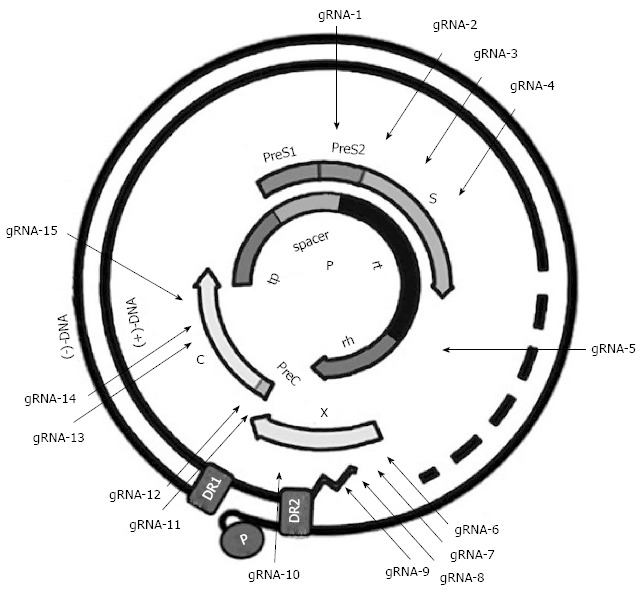
4.CRISPR/Cas9基因组编辑方法可作为对抗人类病毒的武器
治愈慢性HBV感染需要从感染细胞中特异性清除持久性HBV DNA。Linetal(2014)设计了八种针对HBV的gRNA,显示CRISPR/Cas9系统显着降低了转染了HBV表达载体的HuH-7细胞中HBV核心和HBsAg蛋白的产生。此外,该系统可以切割含有肝内HBV基因组的质粒,并在小鼠模型中促进其体内清除,从而导致血清HBsAg水平降低。
基因敲除切割效率不仅可以让人具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用基因敲除切割效率系统产生基因编辑细胞系,对GLUL基因组位点进行靶向测序,产生了EPO的稳转细胞系,并发现重组促进红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因稳转敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
References:
1. Yan-Mei Ji, Xue-Feng Zhou, Jun Zhang, Xiang Zheng, Sheng-Bao Li, Zhi-Qiang Wei, Tao Liu, Dong-Liang Cheng, Ping Liu, Kuncheng Song, Tao Tan, Hua Zhu, Jia-Long Guo. DEPTOR suppresses the progression of esophageal squamous cell carcinoma and predicts poor prognosis. 2016 Mar 22; 7(12): 14188–14198. Published online 2016 Feb 16.
2. Qiu BQ, Lin XH, Ye XD, et al. Long non-coding RNA PSMA3-AS1 promotes malignant phenotypes of esophageal cancer by modulating the miR-101/EZH2 axis as a ceRNA. Aging (Albany NY). 2020;12(2):1843‐1856.
3. Zhao, Wen-Si et al. “Genome-scale CRISPR activation screening identifies a role of ELAVL2-CDKN1A axis in paclitaxel resistance in esophageal squamous cell carcinoma.” American journal of cancer research vol. 9,6 1183-1200. 1 Jun. 2019