 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
HEK293细胞系,又称hek293、hek293、293细胞,是1973年产生的人胚肾293细胞。顾名思义,它们是一种典型的细胞系,起源于人体胚胎肾细胞。最初,这些细胞是从健康流产的胎儿中合法提取的。多年来,HEK293细胞系被认为是由成纤维细胞或上皮细胞的转化而产生的。尽管这些物质在肾脏中很丰富,但最初的腺病毒转化效率很低。因此,研究人员开始怀疑产生HEK 293细胞系的细胞是否异常。随后,我们进行了一系列的实验来分析细胞的基因组和转录体。结果表明,HEK 293与肾上腺细胞的hek293模式相似,具有多种神经元特性。因此,HEK 293细胞被认为是肾上腺细胞的体外模型,而不是典型的肾细胞。
从细胞结构上看,HEK 293细胞是亚三倍体,仅含有人类单倍体配子染色体数的1/3。此外,这些胚胎肾细胞在组织培养中生长。到目前为止,HEK 293细胞已在细胞研究中广泛应用多年。它们的生长相对可靠,更有可能进行转染。
HEK 293细胞在培养过程中可以直接生长和定向生长。在基因表达中,它们通常被用作宿主。此外,该细胞系由于其可通过磷酸钙法等多种技术进行转染而得到广泛应用,其转染效率接近100%。
HEK 293细胞系的应用:
HEK 293细胞系可用于多种研究。例如,它可用于研究药物对钠通道的影响、可确定的RNA干扰系统和蛋白质中的核输出信号等。
更具体地说,HEK 293细胞被用于腺病毒载体的繁殖。利用病毒进化目标基因并将其转移到细胞中是一种有效的方法。然而,由于病毒作为病原体的特性,它们也会带来风险。因此,为了繁殖这种病毒载体,需要一种能够表达缺失基因的细胞系。由于HEK 293细胞含有许多腺病毒基因,因此利用它们来传播这些基因所在的腺病毒载体是非常理想的。
CRISPR/Cas介导的HEK293细胞四重基因敲除提高蛋白和病毒产量
CRISPR/Cas9利用gRNA识别靶序列,引导Cas9内切酶切断PAM上游,导致靶位点DNA双链断裂。为了修复DSB,细胞使用自己的DNA修复机制,通过同源定向修复(HDR)或非同源末端连接(NHEJ)来添加、删除或替换DNA序列片段。
研究人员利用CRISPR/Cas技术敲除了4个促凋亡基因(Caspase3、Caspase6、Caspase7和AIF1),成功地在HEK293细胞中产生了抗凋亡细胞系。细胞凋亡在病理生理学中起着重要作用。然而,从生物制药的角度来看,病毒包装或蛋白质表达过程中宿主细胞的主动凋亡是不可取的,因为它降低了病毒或蛋白质的生产效率。与野生型细胞相比,编辑后的细胞株具有更高的促凋亡蛋白表达水平,携带这些蛋白的病毒的包装效率也更高。这种基因编辑细胞不仅产生了抗凋亡细胞系,可以用来产生凋亡诱导蛋白或表达这些蛋白的病毒,而且还为构建其他抗凋亡细胞系提供了方法。
HEK293细胞不仅具有生成蛋白基化谱和建立调控记录的能力,而且具有多种优势,是一种特别有吸引力的重组蛋白表达系统。首先,它在谷氨酸上羧基化,在酪氨酸上硫酸化。第二,操作简单,通过瞬时基因表达可以快速产生重组蛋白。第三,可用于稳定的重组蛋白生产。一些研究人员利用CRISPR/Cas9系统产生GLUL-KO-HEK293细胞系,对GLUL基因组位点进行靶向测序,产生产生产生EPO的HEK293细胞,并发现重组促红细胞生成素在人体内稳定表达的机制。
源井生物根据客户需求,结合靶基因的情况进行基因敲除方案设计。
方案1:小片段基因敲除方案,gRNA设在外显子2两端的内含子中,敲除外显子编码碱基数为非3倍数,敲除后可造成移码。
方案2:移码基因敲除方案,gRNA设在外显子上,缺失的碱基数为非3倍数,敲除后可发生移码突变。
方案3:大片段基因敲除方案,将整个基因的编码序列敲除,达到大片段敲除的效果。
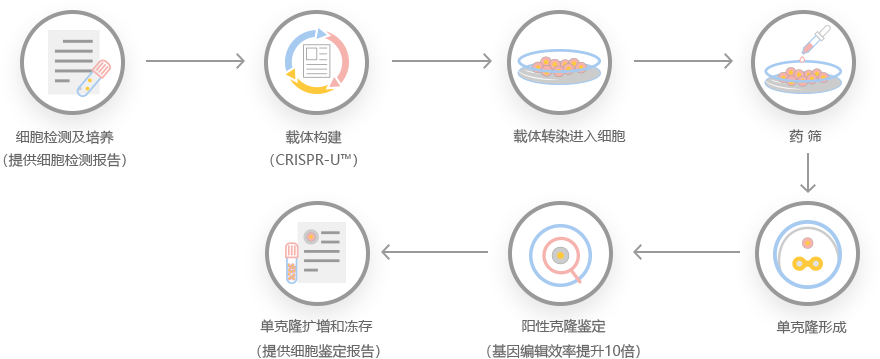
服务流程及质量控制:
Refrence:
hin, C.L., Goh, J.B., Srinivasan, H. et al. A human expression system based on HEK293 for the stable production of recombinant erythropoietin. Sci Rep 9, 16768 (2019).
Z. Dong, Z. Hu, Q. Qin, F. Dong, L. Huang, J. Long, P. Chen, C. Lu and M. Pan, CRISPR/Cas9‐mediated disruption of the immediate early‐0 and 2 as a therapeutic approach to Bombyx mori nucleopolyhedrovirus in transgenic silkworm, Insect Molecular Biology, 28, 1, (112-122), (2018).