 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
独家创新CRISPR技术,编辑效率高10倍以上;超200种细胞的5000多例基因编辑成功案例,服务范围覆盖全球。
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
独家KO细胞库,超5000种覆8大信号通路、近150种疾病、近1500种基因。
干货必看!如何提高CRISPR文库筛选靶点的准确性?

CRISPR文库自从出道以来,一直是靶点筛选界的“当红明星”,许多同学都想蹭蹭这波热度,给自己的文章锦上添花。然而小源总是收到反馈:为什么我筛选出来的靶点不够准确呢?
其实,文库筛选的准确性会受到诸多因素的影响,每个环节都要牢牢把控!下面,小源给大家介绍一下实验中会影响靶点准确度的几个环节以及相应的提高方法:
1. 文库质粒的覆盖率和均一性
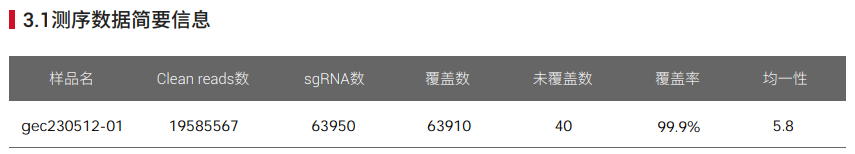
图1.人全基因组文库质粒A库(双质粒系统)
覆盖率是NGS检测到的gRNA数量除以文库理论清单中sgRNA的数量,最大值为100%,越接近100%越好。
均一性是指不同gRNA的丰度差异,理想的文库每条gRNA丰度一致,实际文库gRNA丰度都会存在差异,用skew ratio表示,是累积分布达到 90% 时对应的gRNA数目与累积分布达到10%时对应的比值(即90%分位数和10% gRNA数目的比值),最小值为1,也是越接近1越好。
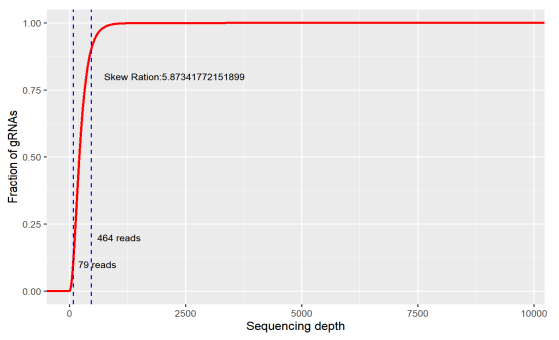
图2. 均一性斜率
如果文库覆盖率太低,还没开始筛已经少了一大波sgRNA,要是你的理想靶点恰好在里面,就失之交臂了。或着均一性太差,大量的sgRNA只有极低的读数,在实验过程中容易丢失,也会影响最终的结果。
那么文库质粒的覆盖率和均一性要如何保障呢?目前常用的文库基本都有现货产品,免去了定制,只需要扩增,扩增环节一定要注意:1)选择电转方法,根据文库大小重复多次电转操作;2)选择转化效率≥109cfu/ug超级感受态细胞用于电转 3)计算转化效率要求菌落数量≥文库gRNA数量X500。
2. 文库病毒感染效率
和常规构建稳转株时感染病毒不同的是,文库病毒感染细胞时,感染效率并不是越高越好。因为病毒量多时,一个细胞可能进入多个sgRNA病毒,最终富集的细胞难以分辨是哪条sgRNA起的作用,可能导致分析结果的不准确性。
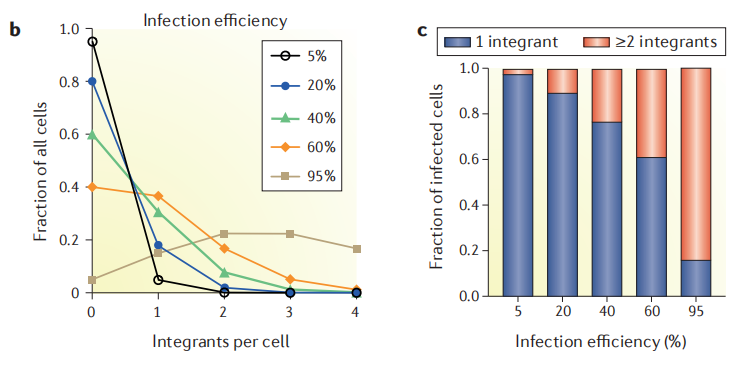
图3.不同感染效率对应每个细胞整合的sgRNA拷贝数[1]
从图中可以看出,感染效率越低,单个细胞中出现2个及以上的sgRNA拷贝数情况越少,但是太低的转染效率反过来也会对感染时所需的细胞数量要求过大,所以需要选择一个折中的数据。绝大部分文献推荐的感染效率为30%,即Infect MOI为0.3。
3. 细胞实验覆盖度
很多同学都有疑问,我应该要用多少的细胞量来做文库筛选实验呢?
举个例子,如果一个文库病毒包含30000条sgRNA,根据上一步的感染效率要求,需要控制仅30%的细胞被病毒感染成功,那么假设感染成功的细胞恰好是30000个,未感染的细胞则是70000个,感染时总的细胞数量就需要100000。这个极端的案例中,感染后的细胞数量正好和sgRNA的数量一致,这不仅要求每个细胞只进1种病毒,还要求1种病毒只进一个细胞,从概率学的角度来看是几乎不可能发生的。即使能,每种sgRNA只有一个细胞,也很容易在传代过程中丢失。目前关于CRISPR 筛选的指南建议文库的细胞实验覆盖度在200X到 1000X之间,但缺乏准确的指示应在给定文库中使用哪种覆盖度[2]。
以下汇总了近几年文库筛选文献中使用的细胞覆盖度,包括全基因组文库和亚文库,正向筛选和负向筛选,涵盖肿瘤耐药性研究、合成致死基因对、病毒感染靶点和解毒剂药物开发等应用。大部分是选择的500X覆盖度,也有200X,400X等。
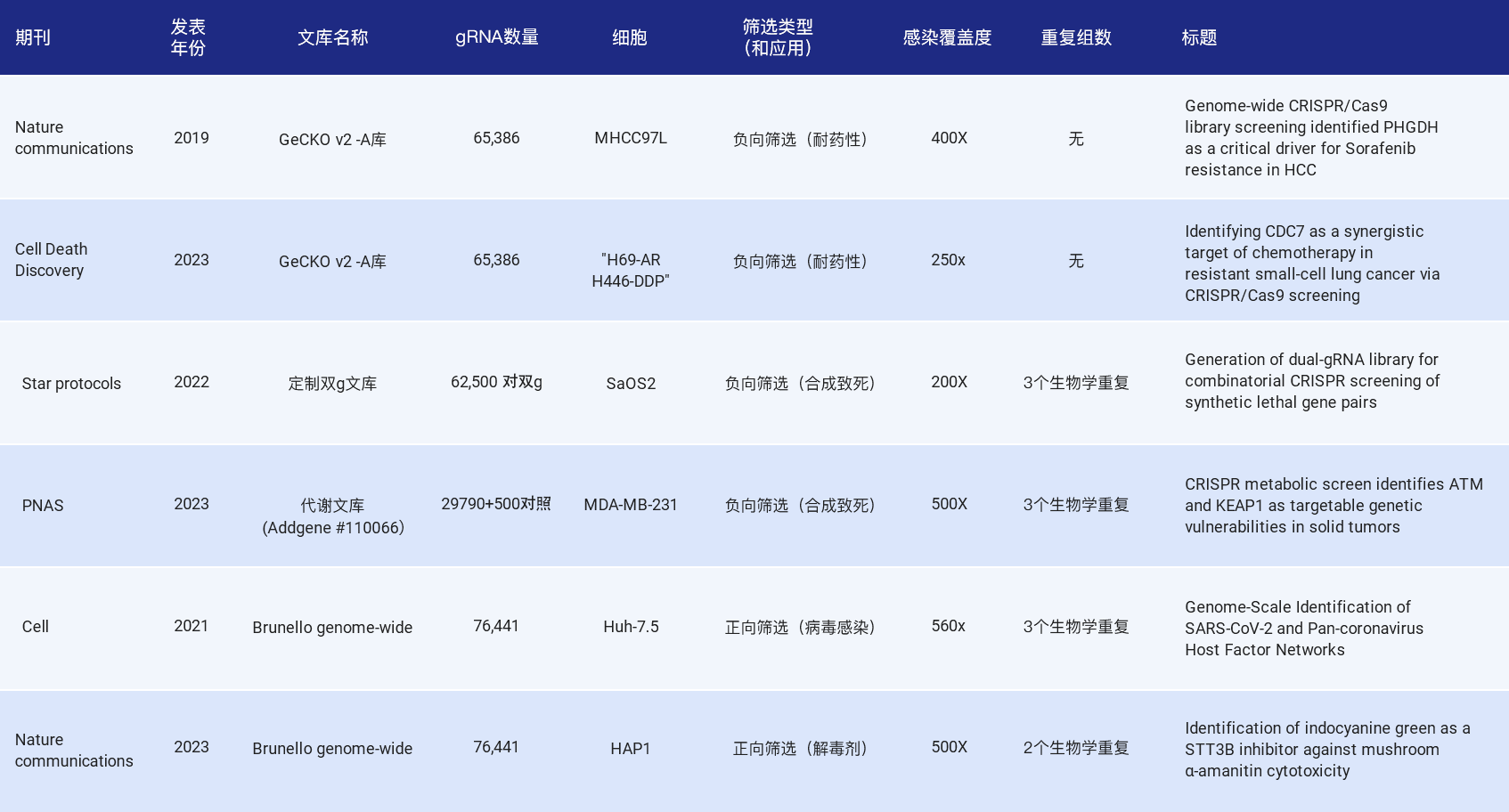
表1.CRISPR文库筛选细胞覆盖度引文节选[3,4,5,6,7,8]
为什么大部分文章推荐的是500X呢,研究人员根据细胞传代模型,当传代时细胞覆盖度低时(如50X),会导致每次传代随机丢失一些sgRNA,影响文库的分布和最终dropout和enrichment的错误解释,当细胞覆盖度>500X时,这种噪声可以大大减轻(图4)。同样的道理,富集后提取细胞基因组以及最终的NGS测序也要保证相应的实验覆盖度。
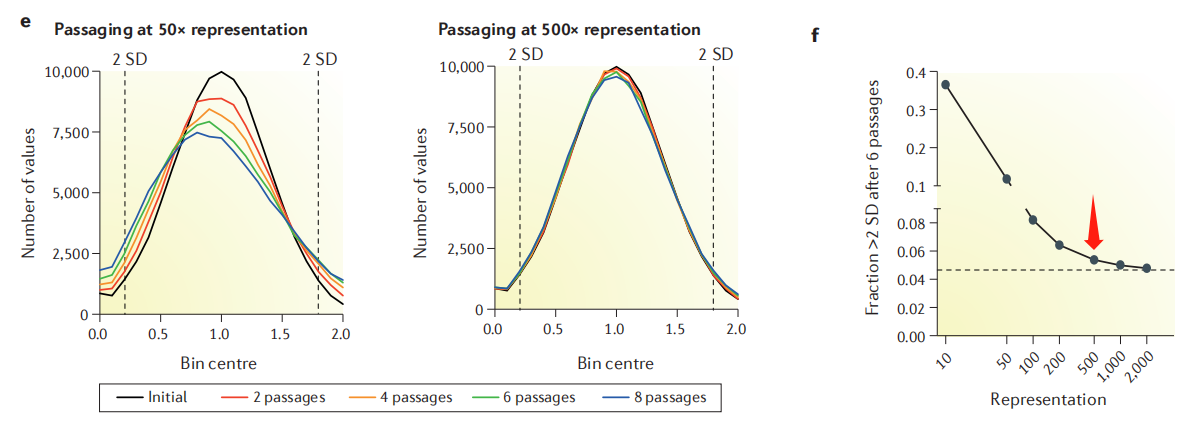
图4.细胞传代覆盖度对文库分布的影响
精准的实验数据来自于每个环节的层层把握,一旦某个步骤不够严谨就有可能导致实验结果不理想,庞大的文库筛选实验尤甚。
参考文献:
[1] Doench J G. Am I ready for CRISPR? A user's guide to genetic screens[J]. Nature Reviews Genetics, 2018, 19(2): 67-80.
[2] Diehl V, Wegner M, Grumati P, et al. Minimized combinatorial CRISPR screens identify genetic interactions in autophagy[J]. Nucleic acids research, 2021, 49(10): 5684-5704.
[3] Wei L, Lee D, Law C T, et al. Genome-wide CRISPR/Cas9 library screening identified PHGDH as a critical driver for Sorafenib resistance in HCC[J]. Nature communications, 2019, 10(1): 4681.
[4] Deng L, Yang L, Zhu S, et al. Identifying CDC7 as a synergistic target of chemotherapy in resistant small-cell lung cancer via CRISPR/Cas9 screening[J]. Cell Death Discovery, 2023, 9(1): 40.
[5] Tang S, Wu X, Liu J, et al. Generation of dual-gRNA library for combinatorial CRISPR screening of synthetic lethal gene pairs[J]. STAR protocols, 2022, 3(3): 101556.
[6] Li H, Liu Y, Xiao Y, et al. CRISPR metabolic screen identifies ATM and KEAP1 as targetable genetic vulnerabilities in solid tumors[J]. Proceedings of the National Academy of Sciences, 2023, 120(6): e2212072120.
[7] Schneider W M, Luna J M, Hoffmann H H, et al. Genome-scale identification of SARS-CoV-2 and pan-coronavirus host factor networks[J]. Cell, 2021, 184(1): 120-132. e14.
[8] Wang B, Wan A H, Xu Y, et al. Identification of indocyanine green as a STT3B inhibitor against mushroom α-amanitin cytotoxicity[J]. Nature Communications, 2023, 14(1): 2241.