《STTT》|源井生物的敲除细胞模型助力揭示NINJ1在流感PANoptosis中的关键作用


《STTT》|源井生物的敲除细胞模型助力揭示NINJ1在流感PANoptosis中的关键作用
2025年9月,中日友好医院曹彬教授团队在 Signal Transduction and Targeted Therapy 在线发表最新研究成果,系统阐述了跨膜蛋白 Ninjurin-1(NINJ1) 在甲型流感病毒(IAV)感染过程中发挥的关键作用。源井生物为该研究提供了NINJ1 Knockout cell line (A549)、NINJ1 Knockout cell line (THP-1)敲除细胞系模型支持。
研究发现,NINJ1并不决定IAV感染诱导的PANoptosis(细胞程序性坏死复合途径)的发生与进程,但却是最终细胞膜破裂及损伤相关分子模式(DAMPs)释放的关键执行分子。其活化导致炎症因子的释放,并部分调控IL-1β的分泌,从而加剧宿主炎症反应。在小鼠模型中,NINJ1缺失显著减轻了流感病毒感染引起的肺组织免疫病理损伤,并提高了存活率。同时,单细胞测序分析揭示:单核/巨噬细胞中NINJ1的高表达与COVID-19患者的疾病严重程度及不良预后密切相关。该研究不仅揭示了NINJ1作为病毒感染下游关键效应分子的作用机制,也提示其作为病毒性肺炎潜在治疗靶点和生物标志物的应用前景。这一发现为理解病毒感染相关的PANoptosis和炎症反应提供了新的视角,并为未来临床干预策略的发展奠定了重要基础。

一、研究背景
甲型流感病毒(IAV)感染导致的重症肺炎,其核心病理机制之一是宿主过度激活的炎性细胞死亡通路所引发的免疫病理性损伤。近年来提出的 PANoptosis 概念,指的是细胞焦亡、凋亡和坏死性凋亡三种程序性细胞死亡通路的整合激活。该过程常伴随大量细胞裂解和胞内内容物释放,继而诱发剧烈的炎症反应并加重组织损伤。
现有的干预策略大多聚焦于PANoptosis的上游调控分子(如 ZBP1)或特定通路的执行蛋白(如 GSDMD、GSDME、MLKL)。然而,动物实验显示,这些干预靶点的保护效果并不一致:一方面,阻断单一通路可能因多条死亡通路之间的功能冗余而失效;另一方面,过度抑制关键分子还可能削弱机体必需的抗病毒免疫反应,从而产生负面效应。NINJ1(Ninjurin-1) 是近年来被鉴定出的跨膜蛋白,在多种细胞死亡类型中均被证实能够介导质膜破裂,是执行细胞破裂的重要分子。然而,其在IAV感染诱导的PANoptosis这一复杂病理过程中的具体作用及机制,尚未得到系统阐明。
二、研究结果
1. IAV感染诱导NINJ1表达上调,并与疾病严重程度相关
研究首先证实,IAV感染能够显著上调 NINJ1 的表达。具体表现为:在小鼠肺组织及骨髓来源的巨噬细胞(BMDMs)中,NINJ1水平均明显升高。单细胞转录组测序进一步揭示,这一上调主要集中在髓系细胞群体(如巨噬细胞和中性粒细胞)中。值得注意的是,在致死剂量感染条件下,NINJ1的表达远高于非致死剂量感染,提示其表达水平与疾病严重程度密切相关。
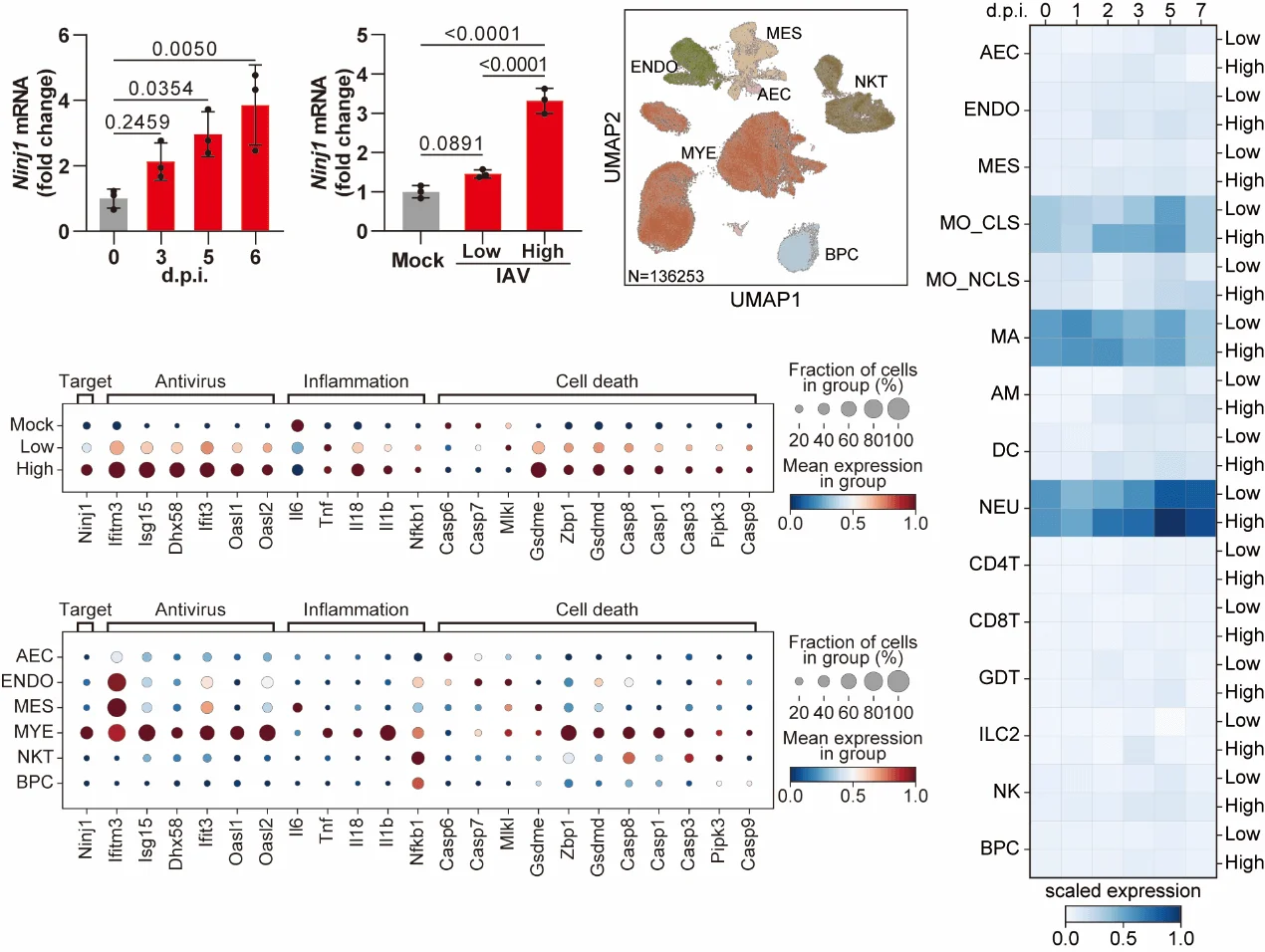
2. NINJ1寡聚化与PANoptosis进程同步,并介导细胞裂解
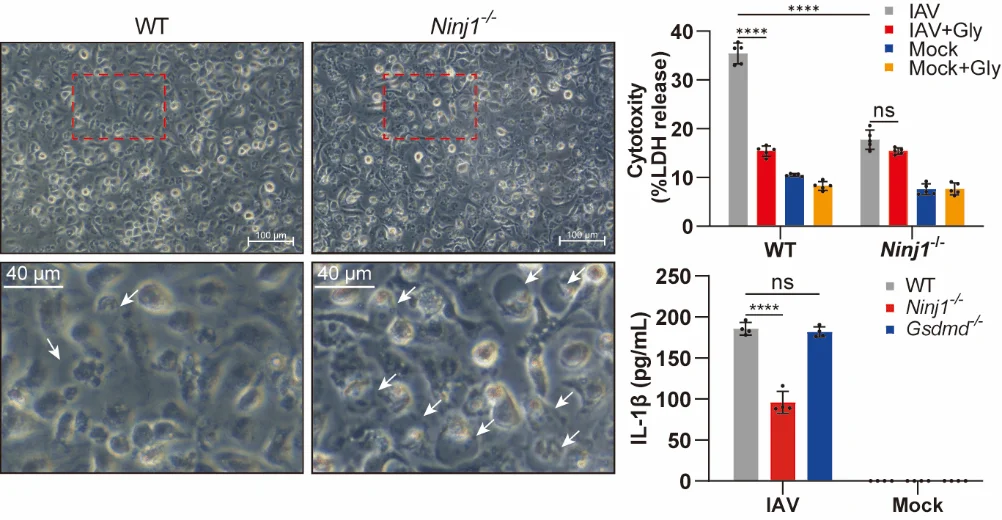
在IAV感染的骨髓来源巨噬细胞(BMDMs)中,研究发现 NINJ1的寡聚化(其活化标志) 与PANoptosis相关分子事件高度同步,包括 GSDMD切割、MLKL磷酸化和Caspase激活。这一结果提示,NINJ1的活化与PANoptosis的进程密切耦合。通过Ninj1⁻/⁻细胞进一步验证,研究团队确认 NINJ1是IAV诱导细胞膜破裂及DAMPs(如LDH、HMGB1)释放的必要分子。然而,NINJ1缺失并未影响细胞死亡的总体发生率,说明其主要功能是执行细胞死亡的终末破裂步骤,而非启动程序性死亡信号。
一个关键发现是,在IAV诱导的PANoptosis背景下,NINJ1缺失可显著降低IL-1β的释放,而GSDMD缺失并不产生类似效应。这表明,在PANoptosis过程中,细胞因子的释放调控机制具有 通路特异性,与经典焦亡模型中“GSDMD主导IL-1β释放”的认识存在差异。
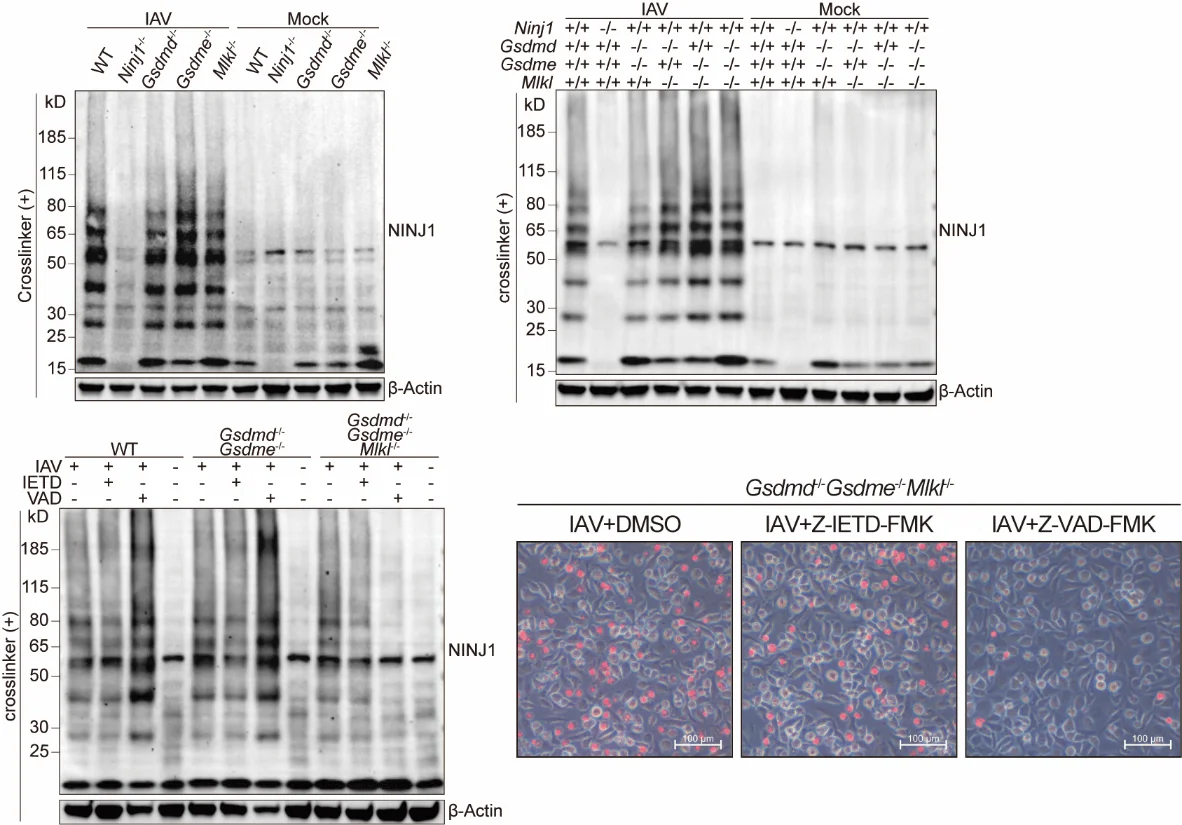
3. NINJ1的激活依赖于ZBP1,且可由任一PANoptosis通路触发
已有研究表明,ZBP1通过感知病毒Z-RNA可启动流感感染中的细胞死亡。本研究进一步证实,NINJ1的寡聚化及其介导的细胞破裂完全依赖于ZBP1。然而,机制探索显示:即便在 Gsdmd、Gsdme 和 Mlkl 同时敲除的条件下,焦亡与坏死性凋亡通路均被阻断,残余的凋亡通路依然能够激活NINJ1并触发细胞裂解。只有在进一步应用caspase抑制剂阻断凋亡时,NINJ1的寡聚化与活化才被完全抑制。
这一结果表明,PANoptosis中的三条经典细胞死亡通路在激活NINJ1时具有高度冗余性:任何一条通路的激活都足以驱动最终的细胞膜破裂。因此,在PANoptosis背景下,凋亡的激活并不等同于传统意义上的“非炎性细胞死亡”,而是能够通过NINJ1转化为炎性、破裂性的死亡过程。
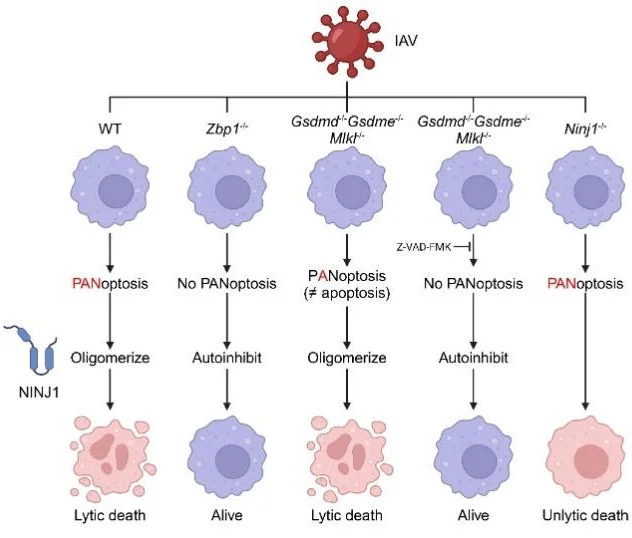
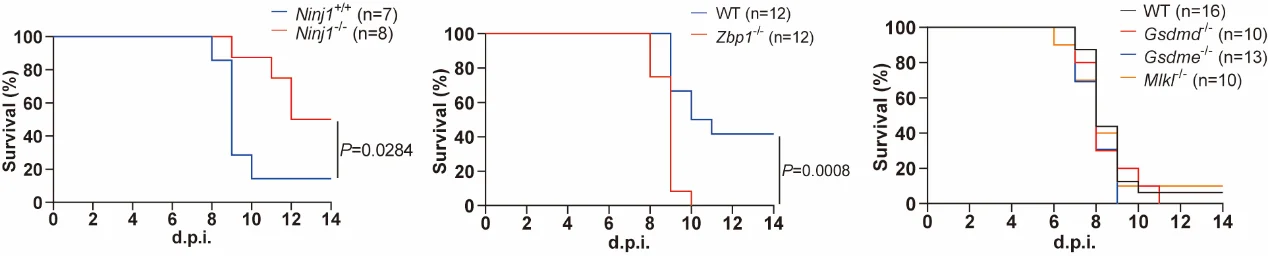
4. 动物模型验证:NINJ1缺失提供独特保护表型
在体内实验中,Ninj1⁻/⁻ 小鼠在致死剂量IAV攻击下表现出 显著提高的生存率和减轻的肺组织病理损伤。支气管肺泡灌洗液(BALF)分析显示,其 蛋白渗漏 及关键炎症因子(IL-1β、IL-6、TNF-α)水平均明显下降,而肺部病毒载量并未受到影响。有趣的是,与此前文献报道不符,在本研究的实验条件下,Gsdmd⁻/⁻、Gsdme⁻/⁻ 或 Mlkl⁻/⁻ 小鼠均未表现出生存优势。这一结果提示,在PANoptosis这一整合通路中,单一分支的抑制容易因其他通路的代偿而失效。而 NINJ1作为多条通路的共同下游执行分子,其靶向干预可能提供更为有效的体内保护。
与Zbp1⁻/⁻ 小鼠的对比进一步凸显了NINJ1的优势:虽然Zbp1⁻/⁻ 小鼠在感染中也能存活,但其肺病毒载量显著升高,提示抗病毒免疫受损;相较之下,Ninj1⁻/⁻ 小鼠不仅减轻炎症反应,还保持了正常的病毒清除能力,展现出更为理想的保护表型。
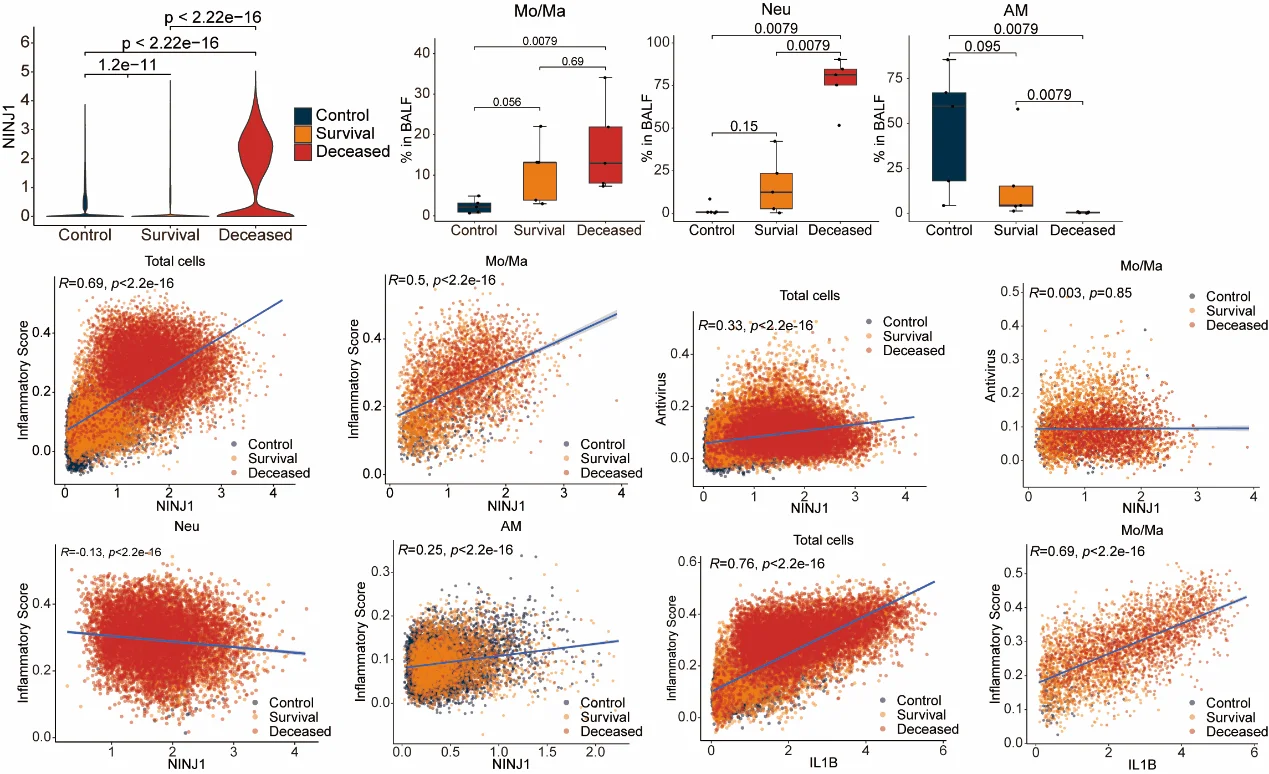
5. 临床相关性:NINJ1表达与COVID-19重症程度相关
通过对重症COVID-19患者支气管肺泡灌洗液(BALF)的单细胞转录组数据进行分析,研究发现 NINJ1在单核/巨噬细胞中的表达水平与疾病严重程度及炎症反应呈正相关。
这一结果提示,NINJ1的作用并不仅限于流感感染,而可能代表 重症病毒性肺炎中普遍存在的关键机制。其在多种病毒相关炎症病理中的一致性关联,也进一步强化了NINJ1作为潜在治疗靶点与生物标志物的临床价值。
三、研究意义与展望
本研究系统阐明了 NINJ1在IAV诱导的PANoptosis中的关键作用,并为未来重症病毒性肺炎的治疗探索提供了新方向:
- 1. 明确了功能机制:NINJ1是介导PANoptosis最终细胞裂解的核心分子,其激活具有通路冗余性,能够整合多条程序性细胞死亡信号。
- 2. 揭示了独特现象:在PANoptosis背景下,单一凋亡通路的激活即可通过NINJ1引发炎性细胞破裂;同时,NINJ1参与调控部分不依赖GSDMD的IL-1β释放,丰富了对炎性细胞死亡调控机制的理解。
- 3. 提出了潜在治疗靶点:与靶向上游分子或特定执行蛋白相比,NINJ1的干预不仅能够有效缓解免疫病理损伤,还能最大程度保留抗病毒免疫功能,显示出更优的治疗潜力。
- 4. 提供了临床线索:NINJ1在髓系细胞中的表达水平与疾病严重程度密切相关,具备作为病毒性肺炎预后生物标志物的应用价值。
展望未来,研究可进一步聚焦以下方向:
- 1. 开发特异性靶向NINJ1的抑制剂(如中和抗体、小分子抑制剂),探索其在病毒感染相关炎症中的干预效果;
- 2. 验证NINJ1在更广泛的病毒性肺炎模型(包括SARS-CoV-2感染)中的作用与治疗潜力;
- 3. 深入解析NINJ1在不同细胞类型(如中性粒细胞)中的功能差异,拓展对其免疫学作用的系统性认知。
该研究不仅为理解PANoptosis的分子执行机制提供了新视角,也为重症病毒性肺炎的临床防治开辟了新的可能路径。
四、源井生物提供的支持
在此次曹彬教授团队发表于 Signal Transduction and Targeted Therapy 的研究中,源井生物提供的NINJ1 Knockout cell line (A549)、NINJ1 Knockout cell line (THP-1)敲除细胞系模型支持,为阐明NINJ1在IAV诱导的PANoptosis中介导细胞裂解和炎症反应的机制发挥了重要作用。目前,源井生物已建立超8000种KO细胞系资源库,价格低至 ¥4980。如果您在细胞库中未能找到所需的敲除细胞模型,我们还可为您提供定制化敲除细胞构建服务。依托自主研发的 CRISPR-U™创新技术,源井生物在细胞构建效率上实现突破:与传统方法相比,敲除效率可提升至97%,为您的科研项目提供更高效、更可靠的技术支持。
参考文献
Xu, Y., Zheng, Y., Liu, Y. et al. Ninjurin-1 mediates cell lysis and detrimental inflammation of PANoptosis during influenza A virus infection. Sig Transduct Target Ther 10, 307 (2025). https://doi.org/10.1038/s41392-025-02391-9











