源井为突破癌症靶向“瓶颈”赋能,实现实体瘤精准成像与治疗


源井为突破癌症靶向“瓶颈”赋能—肽两亲性分子“搭便车”内源性脂蛋白,实现实体瘤精准成像与治疗
在癌症诊疗领域,纳米材料与生物分子的体内相互作用直接决定其生物命运,是影响诊疗效果的关键因素。2025 年,Li Xiang 等人在《Advanced Materials》发表题为 “ Peptide Amphiphiles Hitchhike on Endogenous Biomolecules for Enhanced Cancer Imaging and Therapy ” 的研究,揭示了自组装肽两亲性分子(PA)纳米结构可通过与内源性生物分子动态相互作用,借助天然生理过程实现对多种实体肿瘤的靶向。 研究中关键的敲除细胞LDLR Knockout cell line(Hela) 和人宫颈癌细胞(Hela)均由源井生物提供,为研究PA与内源性脂蛋白结合作用研究提供了核心细胞工具。该研究表明在血液循环中,这些自组装PA纳米结构主要与脂蛋白发生解组装和重组,从而延长血液循环时间,显著提升肿瘤部位的聚集和滞留效果。机制研究中,PA通过与细胞膜组装而无需依赖特定受体即可进入癌细胞,研究开发的自组装谷氨酸肽(SA-E)在多种异种移植瘤、同种异体瘤、患者来源异种移植瘤及转基因啮齿动物模型中均表现出特异性聚集。此外,SA-E能有效递送高活性化疗药物至不同同种异体瘤和异种移植瘤,同时降低副作用。 凭借其模块化设计和普遍适用的肿瘤聚集机制,SA-E为癌症成像和治疗领域提供了极具应用前景的平台 。

一、研究背景
肽两亲性分子(PAs)凭借疏水、静电及氢键作用,可在水溶液中自组装形成纳米结构,且具备良好的生物可降解性、生物相容性与低免疫原性,在药物递送、分子成像和组织工程等生物医学领域应用前景广阔。
然而, 当前领域研究多聚焦于提升 PA 组装体在生物环境中的结构稳定性,以确保其在体内完整发挥作用,却忽视了其与生物系统的动态相互作用 。同时,尽管纳米材料与生物分子的相互作用(即纳米 - 生物相互作用)对纳米材料体内生物命运的重要性已得到广泛证实,例如纳米材料表面吸附的补体蛋白会使其被网状内皮系统快速清除,而与白蛋白或载脂蛋白 E 结合则能改善血液循环并实现受体介导的癌细胞摄取,但这种 相互作用在自组装纳米材料(如 PA 纳米结构)中的研究仍十分有限。
鉴于此, 本研究深入探索 PA 与内源性生物分子及细胞的相互作用,及其对癌症靶向能力和生物分布的影响,旨在为开发更高效的癌症诊疗策略提供理论基础与实验依据。
二、研究亮点
PA 纳米结构在血浆中的稳定性差异显著
研究团队设计了两种具有不同亲水部分的 PA——SA-E 和 SA-K(Self-Assembly Lysine),二者均含促进自组装的共同基序(GGGHAANG,N 端棕榈酸修饰),仅亲水部分分别含三个谷氨酸(E)和赖氨酸(K),并通过近红外荧光染料(ICG)标记以追踪其在体内的行为。
为探究SA-E和SA-K结构差异对稳定性的影响,研究团队通过透射电子显微镜(TEM)观察,SA-E 自组装形成直径约 5-10nm 的球形胶束,SA-K 则主要形成直径约 10nm、长度达数百纳米的棒状胶束,仅含少量球形胶束。利用荧光实验验证,在10% 人血浆中,SA-E 的 ICG 荧光强度增幅约为 SA-K 的 3 倍,且反应更迅速;荧光偏振实验显示 SA-K 的各向异性显著高于 SA-E, 表明 SA-K 胶束结构更刚性、稳定性更强。 随后进行分子动力学(MD)模拟,结果显示 SA-E 最终形成球形团块,SA-K 则基本保持初始管状结构; SA-K 的分子间接触数量更多、均方根偏差(RMSD)更小,进一步证实SA-K相较于SA-E,分子间相互作用更强,结构更稳定 。
为进一步明确SA-E 和 SA-K与血浆成分相互作用的差异,研究团队通过快速蛋白液相色谱(FPLC)和质谱分析,发现 SA-E 在血浆中会快速解体,并优先与脂蛋白(尤其是高密度脂蛋白 HDL)结合,结合比例达 65.3%(其中 HDL 占 59.8%),与白蛋白结合比例为 34.7%;而 SA-K 因结构稳定,与血浆成分的结合程度显著较低,结合效率约为 SA-E 的 1/4.5。此外,不含 N 端脂质修饰的 No-SA 在血浆中 95.3% 保持未结合状态,仅少量与白蛋白(4.2%)和 HDL(0.5%)结合。 上述结果表明,PA优先与血浆中的脂蛋白结合,且由于结构稳定性的影响,SA-E与脂蛋白的结合程度更高。
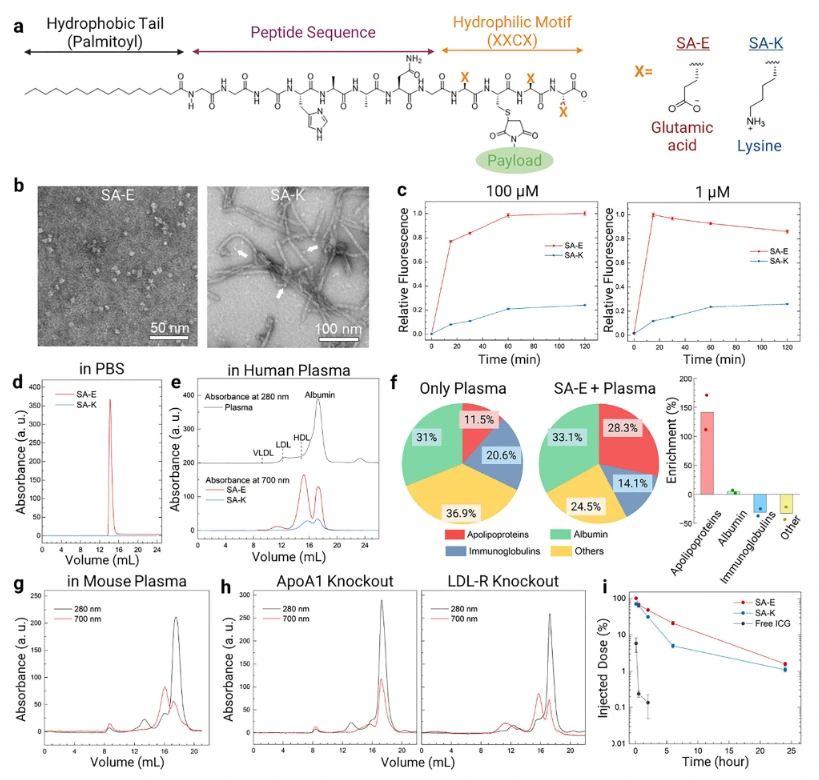
图1
PA 与脂蛋白结合后血液循环时间延长,且不依赖特定受体实现细胞内化
研究团队在野生型小鼠、ApoA1 基因敲除小鼠(HDL 水平显著降低)、LDL-R 基因敲除小鼠体内注射SA-E。1 小时后,野生型小鼠血浆中 65.8% 的 SA-E 与脂蛋白结合(HDL 占 55.2%),34.2% 与白蛋白结合,且 98.9% 的 SA-E 荧光信号存在于血浆中,极少被血细胞摄取。在 ApoA1 基因敲除小鼠中,SA-E 与 HDL 的结合率降至 16.7%,与白蛋白结合率升至 75.4%;在 LDL-R 基因敲除小鼠中,SA-E 与脂蛋白总结合率略升至 73%,但仍以 HDL 结合为主(44.4%)。
通过测定SA-E、SA-K以及No-SA各时间段的血药浓度,SA-E 注射 6 小时后仍有 21% 的注射剂量在循环中,血药浓度 - 时间曲线下面积(AUC)是 SA-K 的 2.1 倍,血液循环时间显著延长;而 SA-K 注射 6 小时后仅 5% 的剂量留存,游离 ICG 则在 30 分钟内降至注射剂量的 1% 以下,6 小时后完全检测不到。No-SA 虽比游离 ICG 循环时间长,但 6 小时后仅约 2.5% 留存,进一步证明 PA 与脂蛋白结合对延长血液循环的关键作用 。
为研究SA-E 和 SA-K细胞内化的效率,研究团队采用 Cy5 标记的 PA 进行细胞实验,发现 SA-E 和 SA-K 均能快速结合 4T1 小鼠乳腺癌细胞膜,随后被细胞内化,且 SA-K 因带正电,摄取量约为 SA-E 的 3 倍。内体染色实验显示 SA-E 与内体荧光信号的皮尔逊相关系数达 0.605±0.02, 证明其主要通过内吞途径进入细胞 。
研究团队进一步研究发现,无胎牛血清(FBS)的培养基中 SA-E 摄取量反而升高 1.6 倍,说明 FBS 生物分子与细胞膜存在竞争性结合;在 LDL-R 敲除 HeLa 细胞和 SR-B1 敲除 TRAMP-C2 细胞中,SA-E 摄取量无显著变化,排除了依赖这两种脂蛋白受体的可能。抑制剂实验显示,wortmannin和甲基 -β- 环糊精可显著降低 SA-E 摄取, Filipin也有一定抑制作用,表明 SA-E 主要通过结合细胞膜胆固醇富集的脂筏区域实现内化,不依赖特定表面受体 。
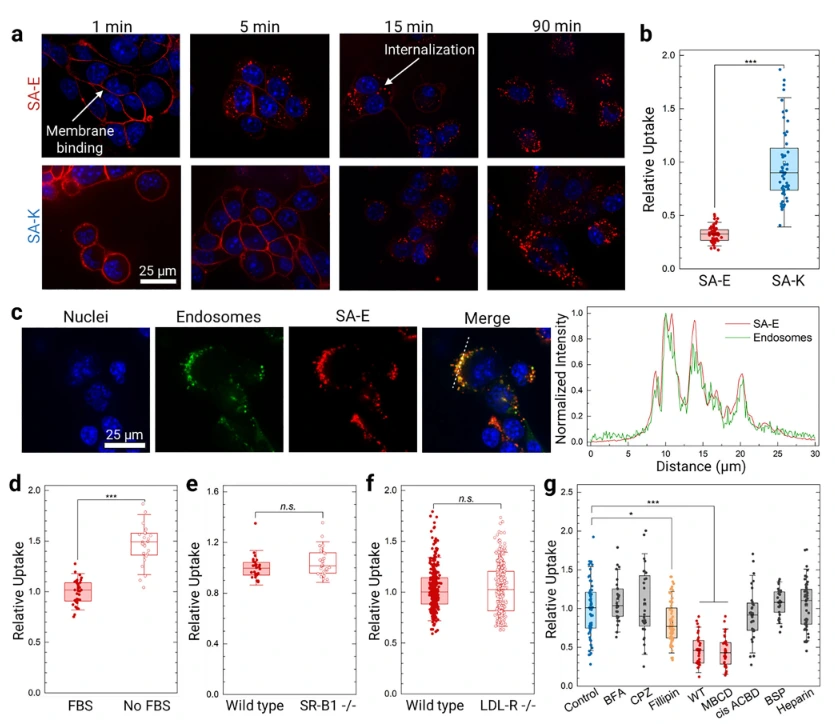
图2
SA-E 实现广谱肿瘤靶向,兼具成像与治疗价值
为进一步确认SA-E 和 SA-K在肿瘤中蓄积和滞留情况,研究团队采用 4T1 乳腺癌荷瘤小鼠模型,发现SA-E 的肿瘤蓄积量显著高于 SA-K 和游离 ICG,注射 11 小时后肿瘤荧光信号达峰值,2 周后仍可检测到,且 2 天内正常组织背景信号基本清除,肿瘤与背景信号比(TBR)维持在 2.5 以上,最高达 5-6;根据生物分布实验显示,SA-E 在肿瘤中的浓度(1.9%±0.4% ID/g 组织)显著高于肝脏(0.8%±0.1% ID/g 组织)及其他器官,肿瘤与肝脏信号比达 4.1,而 SA-K 仅为 1.4。在大鼠 RG2 胶质母细胞瘤模型中,SA-E 在肿瘤中的信号强度是邻近健康脑组织的 16 倍,且与 mCherry 标记的 RG2 癌细胞完全重叠,共聚焦成像显示 SA-E 均匀分布于肿瘤组织,清晰勾勒肿瘤边界,无健康脑组织摄取。流式细胞术分析表明,肿瘤微环境中 70% 的 RG2 癌细胞摄取 SA-E,而白细胞和肿瘤基质细胞的摄取率仅为 35%-40%, 上述实验证实,SA-E能够在肿瘤高效富集和长时间滞留。
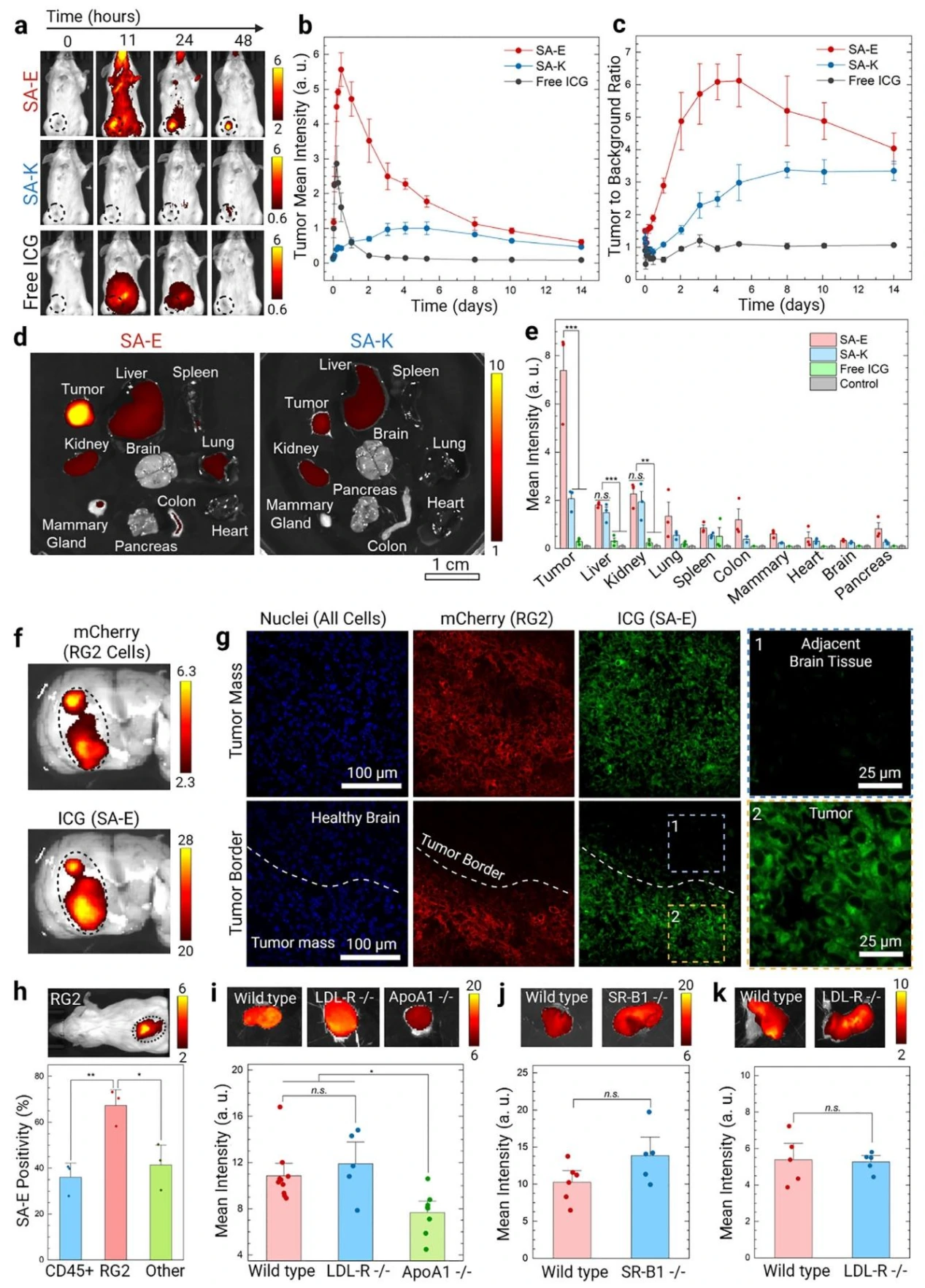
图3
为了研究SA-E对肿瘤的普遍靶向能力,研究团队利用 13 种不同类型的肿瘤模型(涵盖异种移植、同源移植、转基因和患者来源异种移植模型,涉及乳腺、结肠、黑色素瘤、肺、胰腺、宫颈、前列腺和脑等 8 种组织来源)进行研究,SA-E均表现出高度特异性的肿瘤蓄积。在 MMTV-PyMT 转基因乳腺癌小鼠中,SA-E 可识别 71 天大的早期微小病灶,并持续追踪至 85 天肿瘤增大;在 APCmin 转基因结肠癌小鼠中,能 100% 检测到小肠腺瘤(71/71)和结肠息肉(4/4),且病灶大小与 SA-E 信号呈良好线性相关(R=0.9913),可识别小于 1mm² 的微小病灶, 这些结果表明,SA-E具有广谱肿瘤细胞的特异靶向能力。
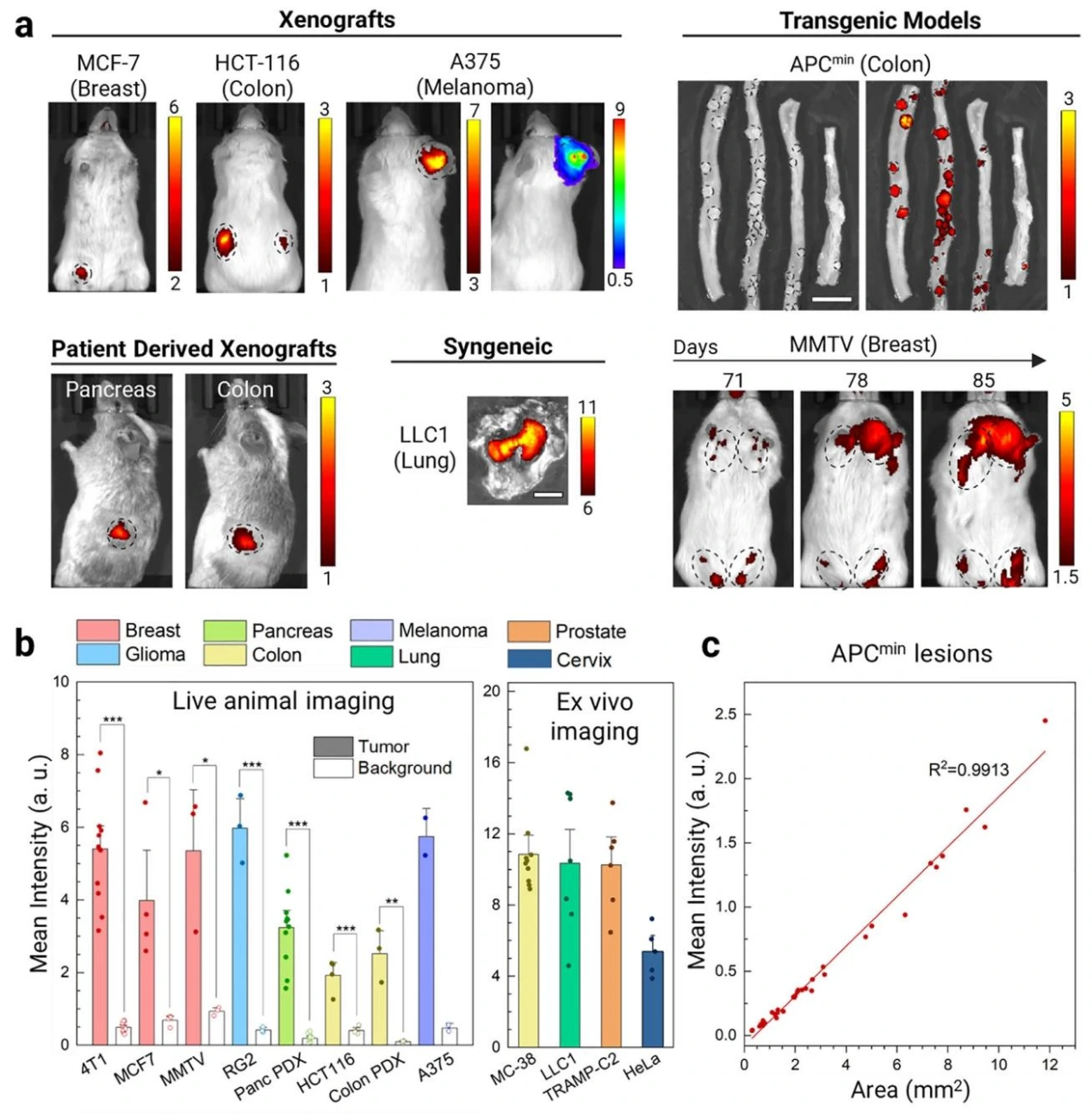
图4
总结以上结果发现,SA-E结合脂蛋白后,能够特异靶向肿瘤细胞并长时间蓄积,这促使研究团队想要探究SA-E作为高效低毒的化疗递送方式的可能性。研究团队将高毒性化疗药物单甲基奥瑞他汀 E(MMAE)通过组织蛋白酶 B 可切割连接子(vcMMAE)与 SA-E 偶联,形成 SA-E-MMAE。TEM 显示其仍为球形胶束,荧光偏振和 FPLC 实验证实其在血浆中仍能解体并与 HDL 结合,结构稳定性未受显著影响。在 4T1 荷瘤小鼠模型中,SA-E-MMAE(0.6mg/kg,5 次注射)可抑制 75% 的肿瘤生长,且无显著体重下降;而游离 MMAE 在 0.3mg/kg 剂量时因毒性过大,注射 3 次后需终止治疗。在 RG2 荷瘤小鼠中,SA-E-MMAE(1mg/kg,5 次注射)可抑制 80% 的肿瘤生长;在 HCT-116 结直肠癌模型中,SA-E-MMAE(0.8mg/kg,5 次注射)使肿瘤体积从 150mm³ 降至 40mm³,且 1 只小鼠在 120 天内保持无瘤状态,显著延长生存期。
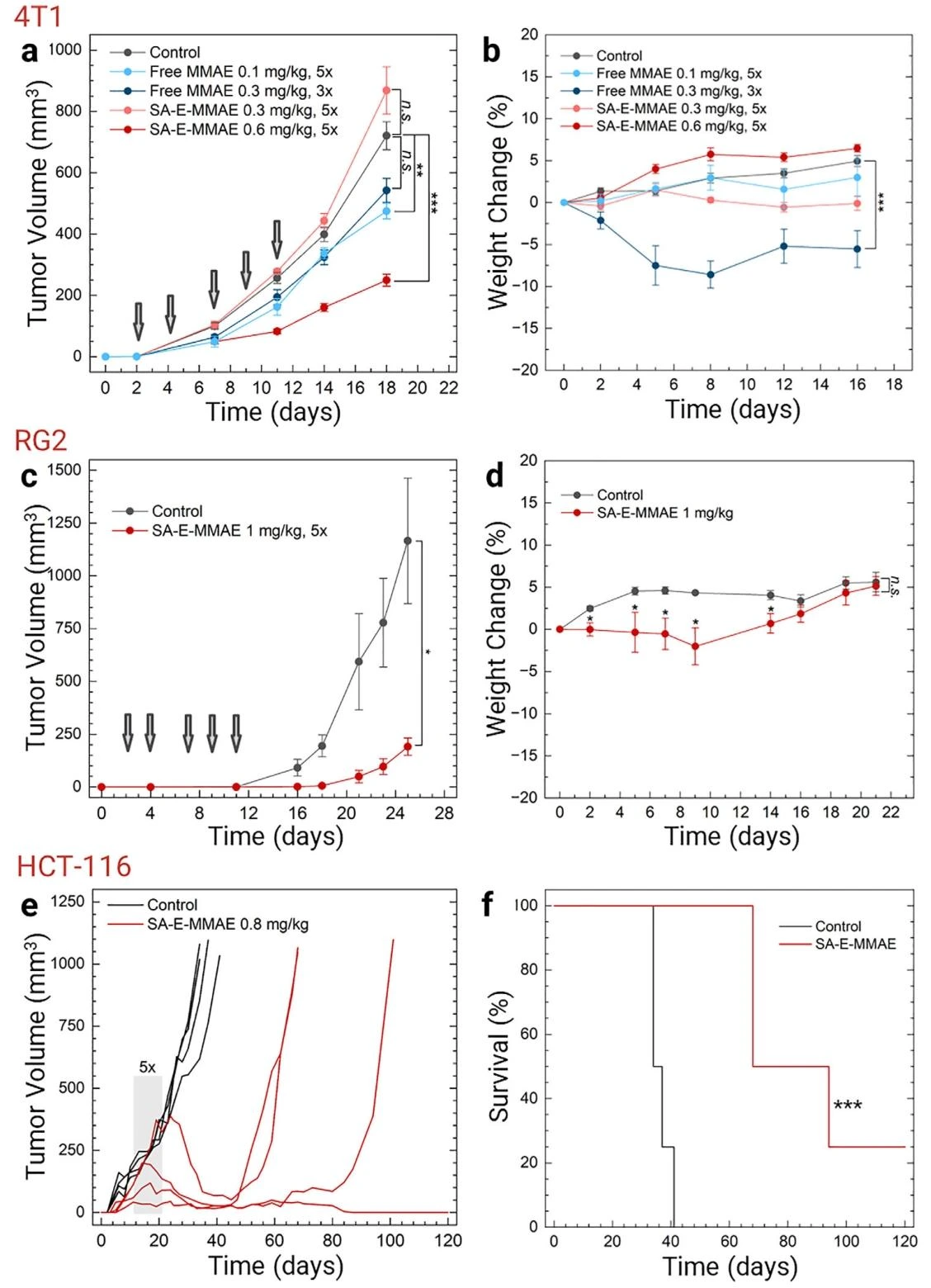
图5
三、全文总结
该研究首次揭示弱组装 PA 通过 “循环中解聚 - 与内源性脂蛋白组装 - 延长循环 - 肿瘤微环境中脂质筏介导内化” 的动态机制实现广谱肿瘤靶向,突破传统纳米材料依赖结构稳定性或特定受体的靶向模式;SA-E 兼具简单模块化设计、生物相容性高、广谱肿瘤靶向、早期成像能力及高效低毒药物递送特性,为癌症精准成像与治疗提供了新型通用平台。
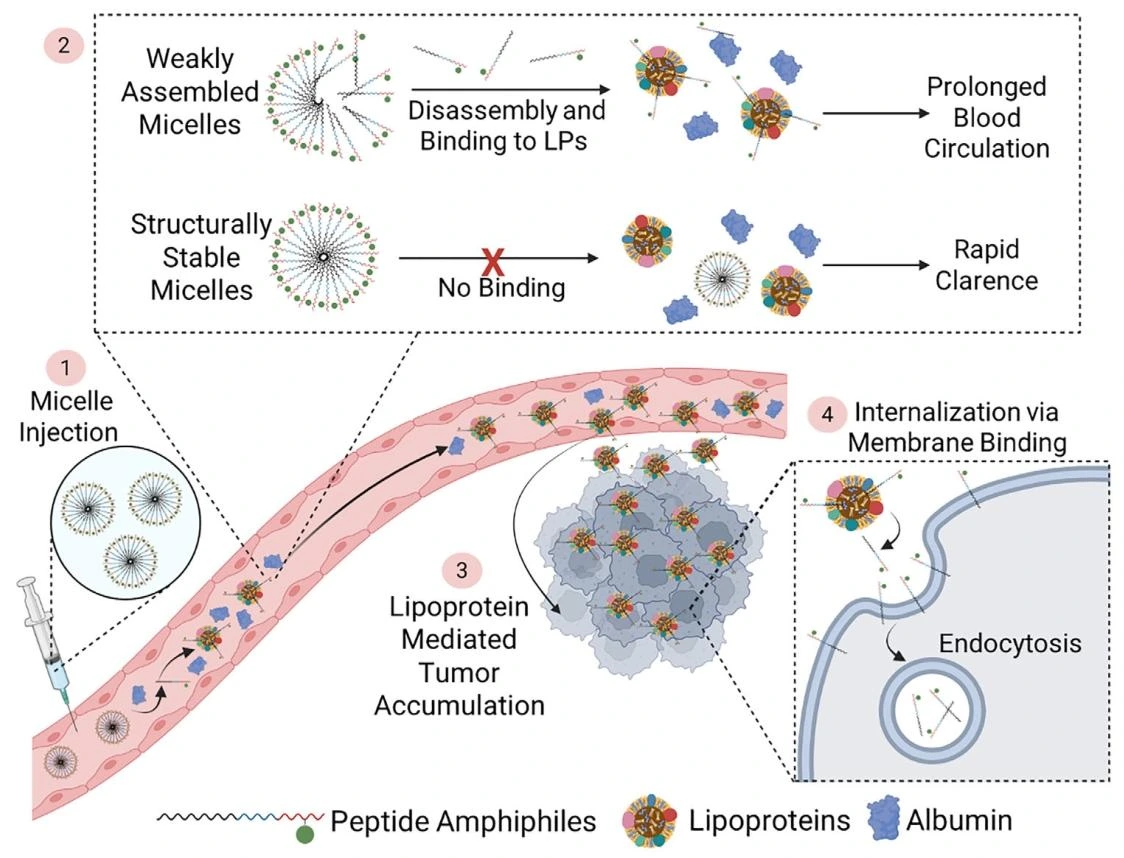
PA 的癌细胞内化机制
四、源井生物提供的支持
本研究中使用到的 关键细胞工具LDLR Knockout cell line (HeLa) 和人宫颈癌细胞(Hela)由源井生物提供 ,助力研究发现SA-E 主要通过结合细胞膜胆固醇富集的脂筏区域实现内化,不依赖特定表面受体。
如果你想高效构建一个基因敲除细胞系,欢迎选择源井生物 KO细胞构建服务 。源井生物拥有 超8000例基因敲除成功案例 ,借助自主开发的技术可将细胞基因编辑效率 提升10-20倍 ,交付的细胞均通过Sanger测序和PCR验证。我们还有大量现货细胞供您挑选,现在正值双11特惠季, 8000+现货KO细胞 低至 ¥4980 ,最快 1周到手 ,时间不等人,进入 红棉·万象全品类细胞库 搜索您需要的细胞。
参考文献
Xiang L, Stewart MR, Mooney K, Dai M, Drennan S, Holland S, Quentel A, Sabuncu S, Kingston BR, Dengos I, Bonic K, Goncalves F, Yi X, Ranganathan S, Branchaud BP, Muldoon LL, Barajas RF, Fischer JM, Yildirim A. Peptide Amphiphiles Hitchhike on Endogenous Biomolecules for Enhanced Cancer Imaging and Therapy.
bioRxiv [Preprint]. 2025 May 17:2024.02.21.580762. doi: 10.1101/2024.02.21.580762. Update in: Adv Mater. 2025 Oct 4:e09359. doi: 10.1002/adma.202509359. PMID: 40462899; PMCID: PMC12132515.











