CRISPR-StAR新技术助力实现体内高分辨率文库筛选


CRISPR-StAR新技术助力实现体内高分辨率文库筛选
长期以来,在复杂的活体模型(如小鼠)中进行大规模、高分辨率的遗传筛选是一个巨大挑战。传统的体内CRISPR筛选往往受限于体内递送效率低、细胞代表性不足、以及无法解析精细的表型差异。尤其在肿瘤领域中,肿瘤细胞体内存活的异质性、不同细胞的增殖优势以及微环境的复杂性使得研究人员无法获得稳定且可复现的基因筛选结果。
2024年12月奥地利科学院分子生物技术研究所Ulrich Elling及其团队在《 Nature Biotechnology 》上发表了一项重磅技术突破-CRISPR-StAR(CRISPR-Stochastic Activation by Recombination)。这一技术基于诱导CreERT2发生重组的单sgRNA表达模式与唯一标识码绑定后,可实现成瘤后同一细胞克隆内生成内部对照,能够最大程度保持实验环境一致,减少由于细胞异质性和瓶颈效应引起的噪声干扰。这项技术为生命科学和医学领域在复杂体内环境中的基因功能研究开辟了新的可能性,标志着CRISPR基因筛选技术向高分辨率、低噪声方向迈出了重要一步。

一、研究背景
在传统CRISPR文库筛选中,需要确保至少500×的细胞覆盖度,以便于在统计学上获得可靠结果。然而在小鼠体内成瘤实验中,细胞在移植后的存活率极低,仅有一小部分细胞能够成功存活并形成肿瘤。例如在本文章中,注射约100万个细胞后,不同肿瘤细胞系形成的肿瘤仅检测出4800-20500个唯一标识码(UMIs,每个载体携带一个标识码)。这种细胞数量的骤减导致许多sgRNA被随机“丢失”,使数据结果充满偶然性,并难以识别真正有功能的基因。
不同细胞克隆在体内表现出显著的增殖差异,一部分细胞由于肿瘤微环境优势(如营养获取、氧供应)能快速扩张,而其他细胞则生长缓慢或完全停滞。正如本文研究的数据显示,肿瘤中约50%的质量仅由不到4%的细胞克隆贡献,这种高度偏倚的生长模式使得实验数据充满噪声,无法有效区分真正的基因效应。
因此,数据噪声过大是体内CRISPR筛选无法回避的问题。即使在理想条件下,基因敲除的效果通常也很微弱,传统方法检测到的富集/耗竭信号强度仅在20倍左右。然而,体内数据的波动范围却可能达到数千倍,远远超出筛选信号的实际水平。这种噪声的存在使得传统分析无法稳定地区分必需基因和非必需基因,甚至可能产生大量假阳/阴性结果。
二、技术创新:CRISPR-StAR突破体内筛选瓶颈
CRISPR-StAR的核心在于随机激活sgRNA的机制(图1d)。具体来说,通过他莫昔芬诱导CreERT2重组酶发挥作用,sgRNA会产生两种不同的不可逆重组:一种是删除抑制元件,使sgRNA进入“激活”状态;另一种则是删除 tracr RNA 序列,使其处于“非活跃”状态。 CRISPR-StAR通过在同一细胞克隆内设置对照组,巧妙地消除了细胞外部环境(如氧气、营养供应、免疫压力)和内部差异的干扰,从而显著提高了筛选结果的准确性与可重复性。
实验数据显示,与传统方法相比,CRISPR-StAR在低覆盖度(如4个细胞/sgRNA)条件下依然表现出高度一致性,相关性系数高达0.68,而传统方法在相同条件下仅为0.07(图1e-f)。更重要的是, CRISPR-StAR能够在高度异质性的体内肿瘤模型中精确区分必需基因与非必需基因,显著降低了假阳性与假阴性的发生率 。
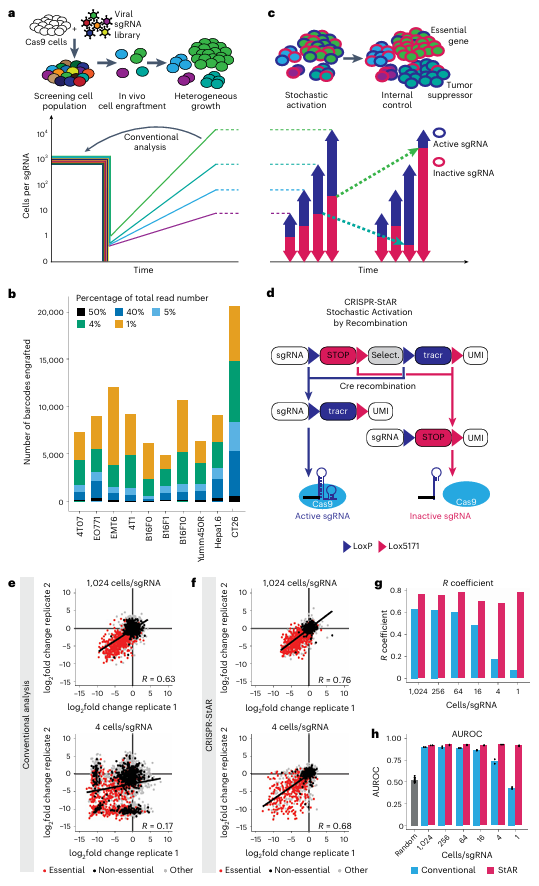
图1. CRISPR-StAR克服了实验中的高噪声
三、性能验证:CRISPR-StAR的体内外筛选测试
为了确保CRISPR-StAR 在各种细胞系、物种和整合位点中始终以稳定的比例激活。文章中选择改进后的StAR 4GN载体,以在体外实现活性与非活性sgRNA的最终比率为55-45%(图.2a)。
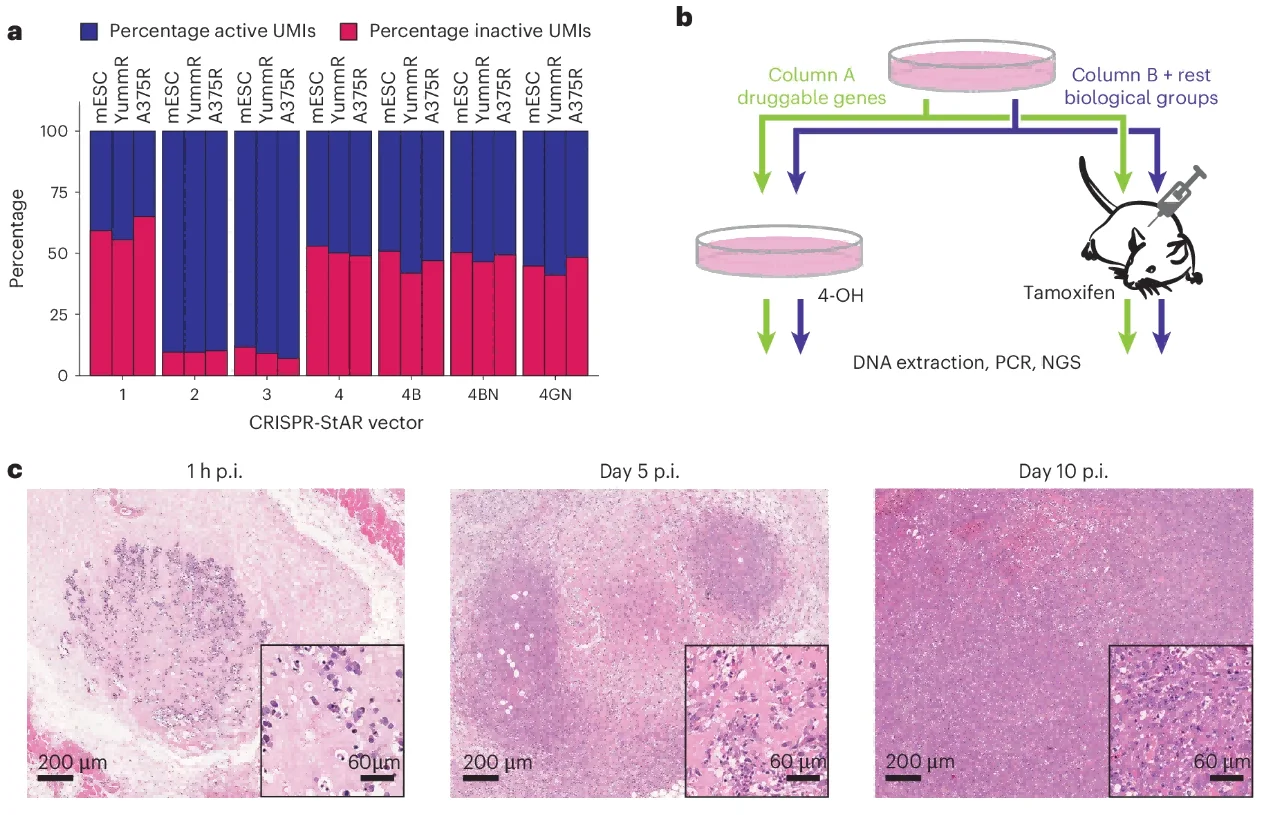
图2. CRISPR-StAR体内优化策略
因明显较低的植入率和相当大的生长异质性,研究人员使用Yumm1.7 450R小鼠黑色素瘤细胞分别在体外和体内构建靶向全基因组的CRISPR-StAR 文库筛选模型。相较于传统文库筛选分析方式,CRISPR-StAR独特的内部对照分析在体外模型中同样很好的区分必需基因和非必需基因(图3a, c)。而在评估分析体内模型时,CRISPR-StAR的性能明显更优。与传统分析相比,体外靶向耗竭的基因与对照之间的区分性更好(图3d),并具有更高的统计学意义。与之前数据一致(图1e,f),这种良好分离主要是由数据噪声显著减少驱动的,而不是未能获得必需基因的耗竭。
此外,CRISPR-StAR 的另一个优点是内部对照克服了批次效应。研究人员比较相隔2年的两个独立实验中的重叠基因发现,传统CRISPR筛选的相关性系数仅为0.17,几乎无法获得可靠结果。而CRISPR-StAR在相同条件下依然保持了高达0.68的相关性,显示出极强的抗噪声能力(图3e)。此外,通过计算ROC曲线和AUROC值,CRISPR-StAR在基因富集和耗竭的准确性上显著优于传统分析方法(图3f-h)。
总之,这些数据表明,与传统方法不同,CRISPR-StAR能够在肿瘤完全建立后再激活sgRNA表达,从而排除了细胞移植和早期存活差异对实验结果的干扰。
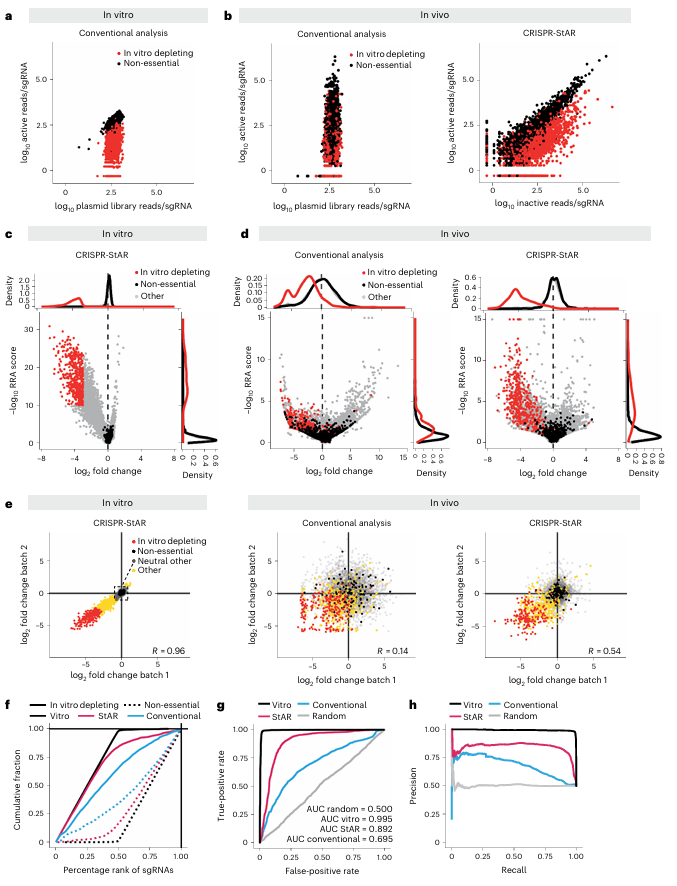
图3. 传统分析方式与CRISPR-StAR分析测试
四、技术优势:CRISPR-StAR揭示体内特异性命中
研究人员应用靶向全基因组的CRISPR-StAR文库,成功揭示了BRAF抑制剂耐药小鼠黑色素瘤模型中线粒体功能对肿瘤细胞存活的关键作用。与传统体外筛选不同,在体内条件下,黑色素瘤细胞对线粒体氧化磷酸化通路表现出强烈依赖性(图4.a, b)。 这一发现表明,肿瘤细胞在体内微环境中无法完全依赖糖酵解供能,而是需要通过线粒体进行高效的能量代谢以维持快速增殖。在传统的体外筛选中,这些基因往往因营养环境的不同而未能被识别,体现了体内微环境对肿瘤基因功能的深刻影响。
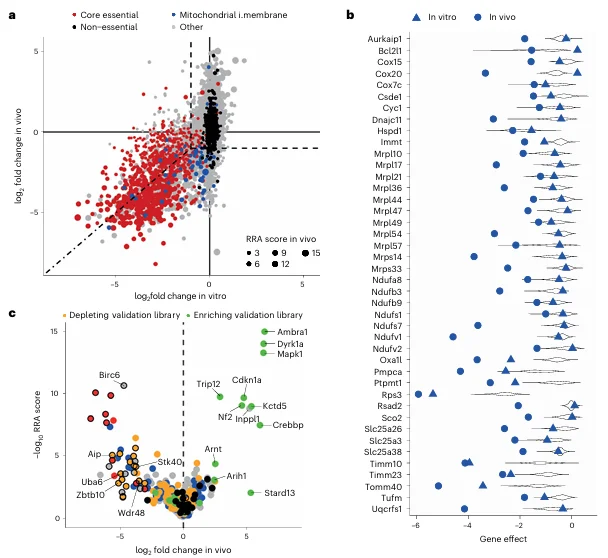
图4. 难治性黑色素瘤中体内特异性命中
此外,CRISPR-StAR还揭示了一些特异性的肿瘤抑制因子,如Stk40和Zbtb10,这些基因的缺失在体内导致肿瘤细胞选择性富集,并在人源肿瘤细胞中也具有显著的体内特异性(图5)。
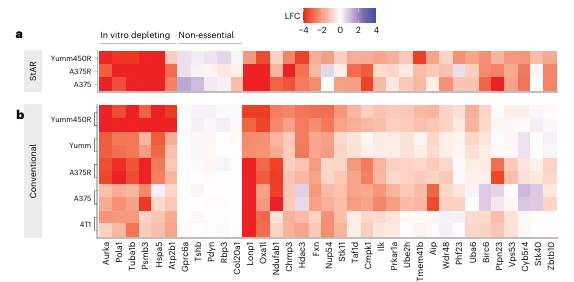
图5. 人和鼠中的体内特异性命中
最后,研究人员对CRISPR-StAR中鉴定的体内特异性命中基因进行单独验证。鉴于组成型和诱导型sgRNA之间的差异以及他莫昔芬的作用效果差异,研究人员新构建了一个可以实现非重组型、重组激活型以及重组非激活型标记的载体。结果显示所有体内特异性命中基因在体内表现出明显强于体外的依赖性(图.6c)。特别是,Zbtb10表现出很强的背景依赖性。总之,这些单基因验证表明CRISPR-StAR具有识别的背景依赖性基因的能力。
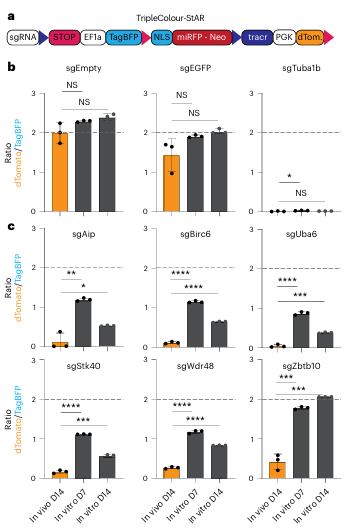
图6. 体内特异性命中基因的单基因验证
五、意义与应用
尽管CRISPR-StAR依赖于Cas9与CreERT2稳定表达,并受体内他莫昔芬诱导差异的干扰,这项技术的问世,仍然为精准医学研究带来了革命性的突破。它通过高分辨率基因筛选和内部对照机制,解决了传统CRISPR筛选在体内复杂疾病模型中的瓶颈问题。其强大的数据可靠性和高解析度使得CRISPR-StAR不仅在肿瘤研究中大显身手,也为药物开发和其他复杂疾病的精准治疗提供了前所未有的工具和思路。
你是否也在苦恼如何高效地完成靶基因的体内筛选?不必担心,源井生物全新推出体内 CRISPR 文库筛选服务,不仅可还原真实疾病场景,更能提供多种小鼠模型,为您量身定制专属体内筛选方案。同时,我们还配备专业的数据解读支持,依托源井独家开发的iScreenAnlys™文库分析平台,无需编程基础,即可轻松完成高质量数据分析。无论您是探索疾病未知机制、筛选潜在药物靶点,还是破解肿瘤耐药难题、优化免疫治疗策略,源井生物都能为您提供一站式、高质量的科研支持。
参考文献
Uijttewaal ECH, Lee J, Sell AC, Botay N, Vainorius G, Novatchkova M, Baar J, Yang J, Potzler T, van der Leij S, Lowden C, Sinner J, Elewaut A, Gavrilovic M, Obenauf A, Schramek D, Elling U. CRISPR-StAR enables high-resolution genetic screening in complex in vivo models.
Nat Biotechnol. 2024 Dec 16. doi: 10.1038/s41587-024-02512-9. Epub ahead of print. PMID: 39681701.











