干货|稳转株构建方法:慢病毒VS转座子?


干货|稳转株构建:慢病毒VS转座子?

在生命科学研究中,构建基因稳定表达细胞株(稳转株)是一项非常重要的技术手段。它为深入探究基因功能、疾病机制以及药物研发等方面提供了坚实的基础。目前,常见的构建稳转株的方法主要有慢病毒、转座子、CRISPR-Cas9基因敲入以及质粒转染等。这些方法各有所长,为科研人员提供了多样化的选择。今天,跟随小源一起来探讨其中慢病毒和转座子这两种方法的应用场景及其特点。
慢病毒介导的稳转株构建
慢病毒作为一种强大的基因载体,凭借其强感染能力和高效的基因整合特性,是稳转株构建的主流方法。
1. 工作原理
慢病毒属于逆转录病毒的一种,它能够将携带的外源基因整合到宿主细胞的基因组中,从而实现长期稳定的基因表达。慢病毒载体通常由包装质粒、包膜质粒和转移质粒三部分组成。通过将这三种质粒共转染到包装细胞中,可以产生具有感染能力的慢病毒颗粒。
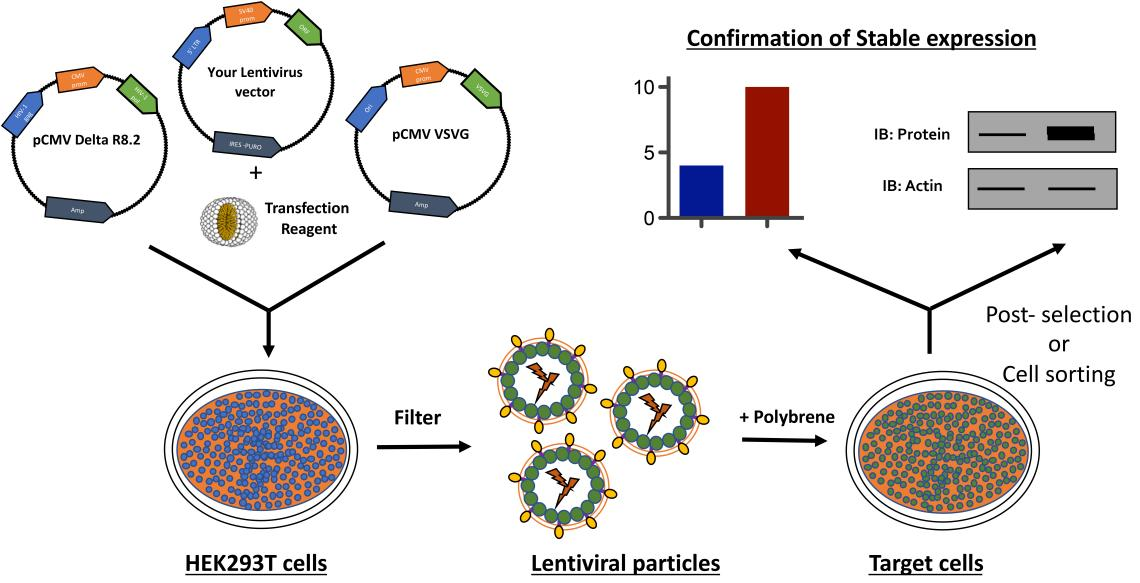
图1慢病毒构建稳转细胞系的示意图
2. 构建流程
载体构建:克隆或合成目的基因,并将其克隆到合适的慢病毒载体中。
病毒包装:将构建好的含有目的基因的慢病毒载体与包装质粒共转染到293T等包装细胞中。培养细胞,收集含有慢病毒颗粒的上清液。
病毒滴度测定:使用合适的方法(如qPCR或荧光测定)确定慢病毒的滴度。
转导目标细胞:将待感染的细胞接种到培养板中,培养至合适的汇合度或密度。根据预实验确定的感染复数(MOI),加入适量的慢病毒颗粒进行感染。感染过程中,可根据细胞类型和病毒特性选择是否添加polybrene来提高感染效率。
筛选稳定细胞:感染后48—72小时,根据所使用的筛选标记(如嘌呤霉素、潮霉素等),加入合适浓度的筛选药物进行筛选。持续培养并更换含筛选药物的培养基,直到未感染的细胞全部死亡,存活的细胞即为初步筛选得到的稳定细胞株。
单克隆化(可选):通过有限稀释法或流式细胞分选等方法,将筛选得到的细胞进一步单克隆化,以获得遗传背景均一的稳定细胞株。
验证:通过PCR、Western blot等方法验证外源基因的整合和表达。
保存和扩增:将筛选出的稳转株冷冻保存,并根据需要进行扩增使用。
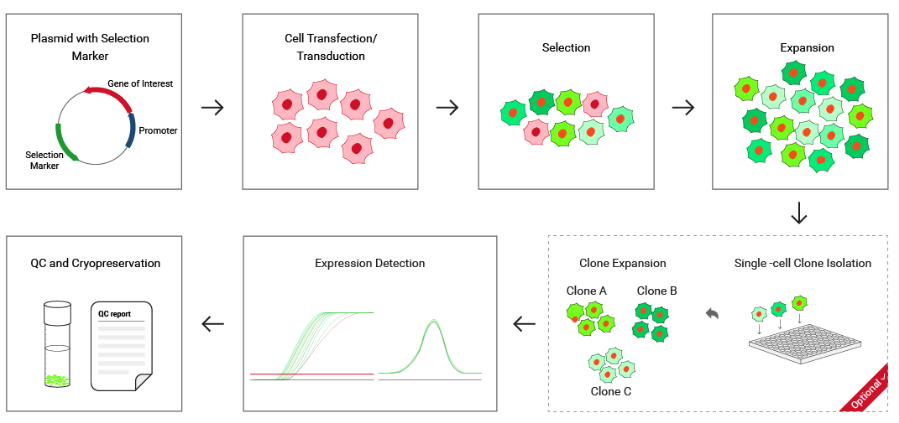
图2 源井稳转株服务流程
3. 应用场景
肿瘤研究:在肿瘤研究中,慢病毒常用于构建稳定表达肿瘤抑制基因或癌基因的细胞株。研究其对肿瘤细胞增殖、凋亡和迁移等生物学行为的影响。
神经科学领域:由于神经元等神经细胞属于终末分化细胞,常规的转染方法效果不佳,而慢病毒能够有效地感染这些细胞,为神经科学研究提供了有力的工具。
免疫细胞研究:对于免疫细胞如T细胞、巨噬细胞等,慢病毒也能够实现高效的基因转染,从而有助于研究免疫细胞的活化、分化以及免疫应答过程。
转座子介导的稳转株构建
转座子,作为一段可以在基因组中“跳跃”的DNA序列,为稳转株的构建带来了另一种独特的策略。
1. 工作机制
转座子是一类能够在基因组内移动的DNA片段,它们可以通过自身编码的转座酶催化,从一个位置移动到另一个位置。在构建稳转株时,通常将外源基因与转座子元件连接,然后通过转座酶的作用将其整合到宿主细胞的基因组中。
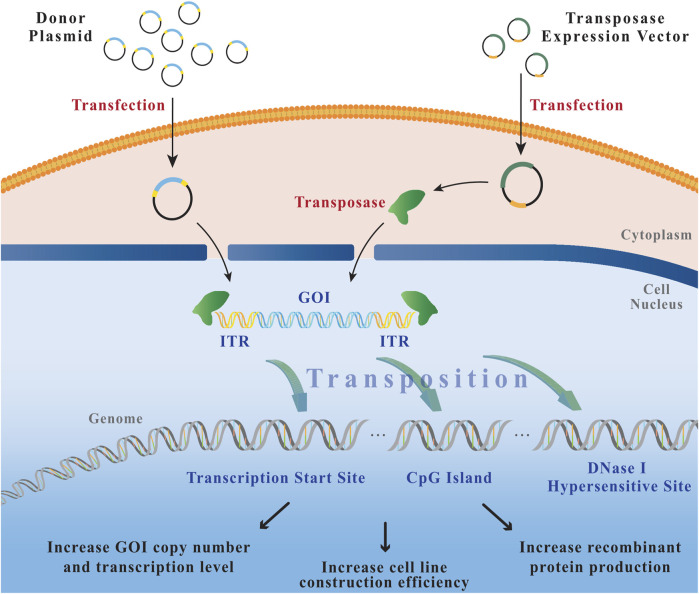
图3 转座过程
2. 构建流程
构建转座子质粒:将目的基因插入到转座子质粒中,通常在目的基因的两侧添加转座子的末端重复序列(ITRs)。
共转染:将转座子质粒和编码转座酶的辅助质粒共转染到目标细胞中。可以使用脂质体转染、电穿孔等方法进行转染。
筛选稳定细胞株:转染后,细胞中会发生转座事件,将目的基因整合到基因组中。通过适当的筛选方法(如抗生素筛选),筛选出稳定整合目的基因的细胞株。
单克隆化(可选):通过有限稀释法或流式细胞分选等方法,将筛选得到的细胞进一步单克隆化,以获得遗传背景均一的稳定细胞株。
验证:对筛选得到的稳定细胞株进行鉴定,如通过PCR、Southern blot等方法验证目的基因的整合情况,以及通过Western blot、荧光显微镜等方法检测目的基因的表达水平。
保存和扩增:将筛选出的稳转株冷冻保存,并根据需要进行扩增使用。
3. 应用场景
基因片段大:转座子因其有效载荷大的优势,能容纳更大的基因,无需截断cDNA。而慢病毒载体对插入的基因片段大小有一定限制。
对慢病毒敏感的细胞:如果细胞对病毒感染较为敏感,慢病毒法可能会对细胞的存活、功能和整体状态产生负面影响,此时可以考虑使用转座子。
下表,是小源整理的一些资料,供大家参考。
| 慢病毒 | 转座子 (PiggyBac为例) |
基因容量 | 6-6.5kb | 10-30kb |
整合位点 | 随机整合到宿主细胞基因组中 | 特异性地整合到“TTAA”位点 |
适用细胞类型 | 广泛,包括分裂和非分裂细胞 | 较广泛,但可能需要优化转染方法以适应不同细胞类型 |
特点 | 需要病毒包装和纯化,过程较复杂 | 相对简单,通过质粒共转染实现 |
小结
慢病毒和转座子在构建稳转株方面各有各的优势和应用场景,但都存在随机整合以及拷贝数未知的缺点。而CRISPR-Cas9基因敲入可以作为一个重要的代替手段,但制作成本高、周期较长。源井生物EZ-OE™新技术,为稳转株构建提供一个全新、更稳定、更可靠的解决方案。该技术区别于传统转座子方法,可以实现基因组定点整合和单一拷贝,而且成本低、周期快至5周!
参考资料:
Tandon, N., Thakkar, K. N., LaGory, E. L., Liu, Y. and Giaccia, A. J. (2018). Generation of Stable
Expression Mammalian Cell Lines Using Lentivirus. Bio-protocol 8(21): e3073.
Sato M, Inada E, Saitoh I, Watanabe S, Nakamura S. piggyBac-Based Non-Viral In Vivo Gene Delivery
Useful for Production of Genetically Modified Animals and Organs. Pharmaceutics. 2020 Mar 19;12(3):277.
Wei, Mian et al. “Progress of Transposon Vector System for Production of Recombinant Therapeutic Proteins in Mammalian Cells.” Frontiers in bioengineering and biotechnology vol. 10 879222. 4 May. 2022, doi:10.3389/fbioe.2022.879222










