单剂量基因组编辑疗法挽救患有DFNA41型耳聋成年小鼠的听觉和前庭功能


先天性听力损失是全球最常见的出生缺陷之一,在发达国家,遗传因素导致的先天性感音神经性听力损失发生率高达 1/500 新生儿。尽管目前已发现超过 150 个耳聋相关基因,但针对遗传性听力损失的有效生物治疗手段仍十分匮乏 —— 临床主流的助听器和人工耳蜗存在显著局限性,如嘈杂环境中言语识别率低、音乐感知效果差,且无法从根本上修复内耳病变细胞的功能缺陷,亟需新型根治性治疗策略。
2025年8月,美国马萨诸塞眼耳医院(Mass Eye and Ear)Zheng-Yi Chen博士团队在Journal of Clinical Investigation发表最新研究, 该团队以 P2rx2V61L/+ 小鼠(模拟人类 DFNA41)为模型,开发 AAV2 介导的 SaCas9-sgRNA 基因组编辑系统,聚焦成年小鼠内耳的高效安全编辑,验证其对听觉、前庭功能及噪声敏感性的挽救效果,并筛选人类 P2RX2 V60L 突变的编辑工具,为临床转化奠定基础。

研究背景
基因治疗(包括基因组编辑疗法)为遗传性听力损失带来新希望,过去数十年已发展出基因替换、基因增强、基因沉默及基因组编辑等多种技术路线,并在小鼠模型中取得一定成功。然而,现有研究存在两大关键瓶颈:
一是 干预时机局限, 多数研究集中于新生小鼠(内耳未成熟),而人类新生儿内耳已完全成熟,成年内耳干预的有效性尚未在多数基因模型中证实,仅 Otof、Tmprss3、Mir96 三种小鼠模型实现成年干预;
二是 疾病类型覆盖不足, 针对常染色体显性耳聋(如 DFNA41)的研究较少,这类疾病多为延迟发作、进行性加重,且常伴随前庭功能障碍和噪声敏感性升高,现有疗法难以满足临床需求。
DFNA41 作为典型的常染色体显性进行性耳聋,由 P2RX2 基因突变(如人类 V60L 突变)导致,患者多在青少年期发病,听力随年龄逐渐衰退,且对噪声诱导的听力损失(NIHL)高度敏感;同时,P2RX2 基因功能异常还会影响前庭系统,但人类患者因症状轻微或中枢代偿机制,相关功能障碍常被忽视。
研究亮点
一、锁定高效低脱靶的等位基因特异性编辑系统
为实现对 P2rx2V61L 突变等位基因的精准切割,研究团队对比了 Staphylococcus aureus Cas9(SaCas9)与 Streptococcus pyogenes Cas9(SpCas9)两类编辑系统的效率与特异性: 在 P2rx2V61L/+ 小鼠原代成纤维细胞中,SaCas9-sgRNA1 对突变等位基因的编辑效率达 75.01%±4.55%,而对野生型 P2rx2 等位基因的编辑率仅 0.45%±0.39%;反观 SpCas9 相关 sgRNA,虽对突变等位基因编辑率达 71.28%~83.29%,但对野生型等位基因的编辑率高达 8.73%~29.20%,存在严重脱靶风险。SaCas9-sgRNA1 编辑产生的插入缺失(indel)中,单核苷酸缺失占比最高,且 85.1% 为移码突变,可导致 P2rx2V61L 基因翻译提前终止,生成无功能的截短蛋白,彻底灭活突变等位基因的增益功能,符合 DFNA41 的治疗逻辑。最后通过 CIRCLE-Seq 技术检测全基因组脱靶位点,未发现除靶位点外的异常 indel;对生物信息学预测的 7 个高风险脱靶位点进行 NGS 验证,indel 率均 < 0.1%, 证实SaCas9-sgRNA1系统在全基因组范围内的高特异性,解决基因组编辑的核心安全顾虑。
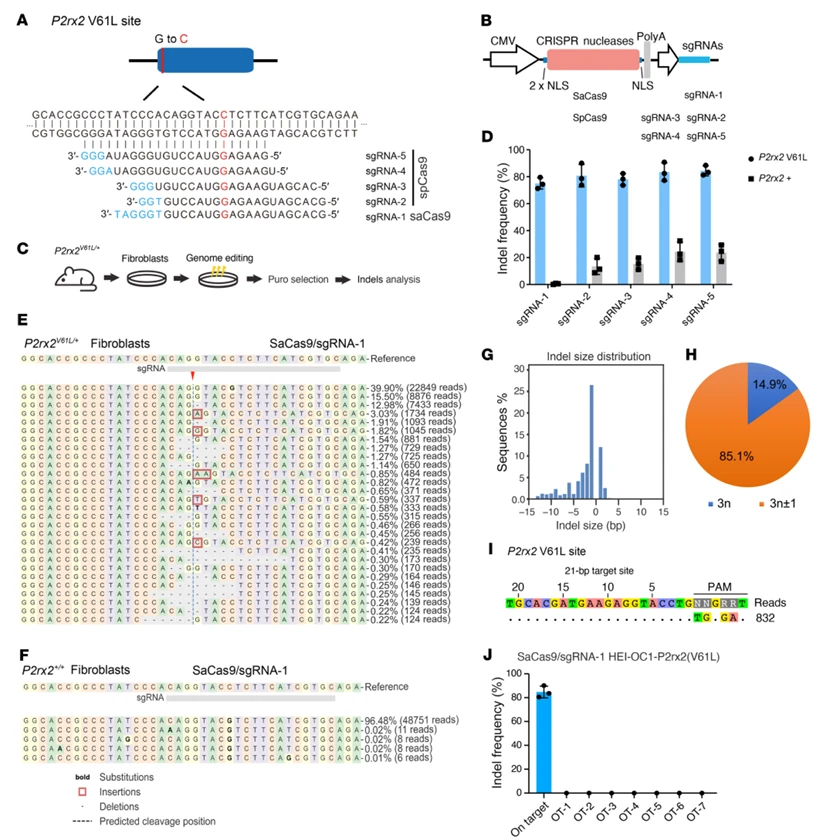
图1. 利用SaCas9–sgRNA-1在小鼠P2rx2V61L/+原代细胞中实现等位基因特异性基因组编辑
二、成年小鼠成熟耳蜗的高效安全体内编辑
针对 “人类内耳成熟后干预效果不足” 的痛点,研究团队通过圆窗膜 + 骨窗注射(RWM+CF)将 AAV2-SaCas9-sgRNA1 递送至 4 周龄 P2rx2V61L/+ 小鼠耳蜗(内耳已成熟),从分子层面验证编辑效果与安全性:8 周后检测显示,耳蜗组织中 P2rx2V61L 等位基因 indel 率为 2.62%±0.64%,野生型等位基因无编辑;RNA 层面,P2rx2V61L 未编辑转录本与野生型转录本的比例较未注射组下降 28.2%,仅检测到 1.46% 的外显子 2 跳跃转录本(无明显功能干扰),证明编辑可有效降低突变转录本水平。通过 FM1-43FX 标记分离毛细胞(P2rx2 基因主要表达细胞),检测到突变等位基因 indel 率为 26.96%±4.2%,与 RNA 层面效率高度一致;且未检测到 AAV 基因组整合(避免插入突变风险),SaCas9 mRNA 在注射 12 周后降至不可检测水平(减少免疫反应), 证实编辑系统在成年毛细胞中的安全性。 AAV2 载体可 100% 转导所有耳蜗回的内毛细胞,外毛细胞转导效率从顶回(80%)到底回(65%)梯度分布,且内毛细胞中转基因表达强度均一;注射 4×10⁹ vg / 耳时,野生型小鼠 ABR 和 DPOAE 阈值无显著变化, 证明载体递送不损伤正常听力。
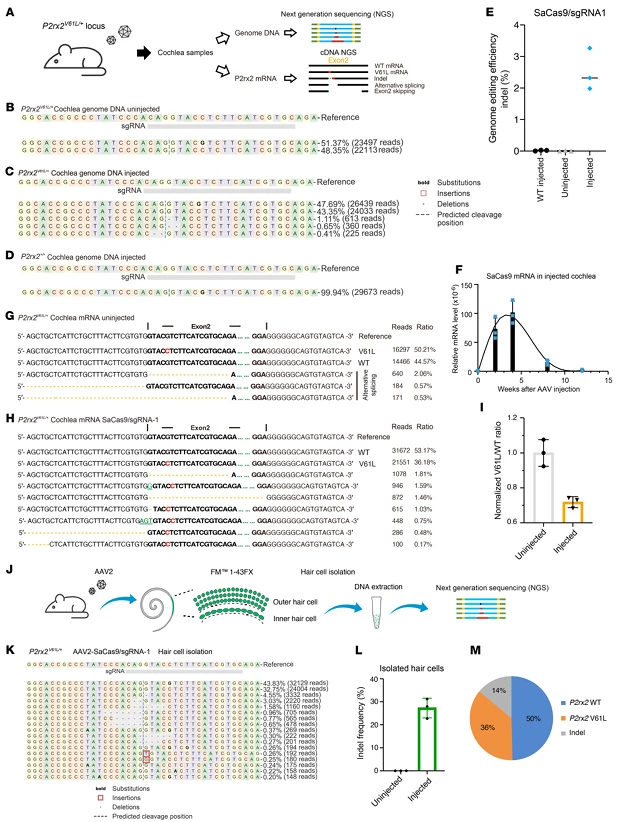
图2. AAV2介导的成年P2rx2V61L/+小鼠耳蜗中P2rx2 V61L位点基因组编辑
三、听觉功能的长期挽救与早干预优势
随后研究团队通过 ABR(听觉脑干反应)和 DPOAE(畸变产物耳声发射)检测,系统评估编辑对听觉功能的挽救效果,发现干预时机显著影响保护范围:注射后 9 个月内,4周龄成年小鼠在5.66、8.00、11.32kHz 频率的 ABR 阈值平均降低 13~21dB,DPOAE 阈值(反映外毛细胞功能)在 11.32kHz 降低 7~11dB;且 ABR 波形的 P1 振幅升高、潜伏期缩短,接近野生型小鼠的听觉传导特性,证实 编辑可实现长期稳定的听觉功能保护。 而在听力损失发作前2 周龄幼年期注射,挽救频率扩展至 16kHz,保护效果持续 12 个月 ,12 个月后 8.00、11.32kHz 频率 ABR 阈值仍平均降低 16dB;进一步研究发现, 早干预优势源于幼年小鼠高频率区域毛细胞尚未退化,更易通过编辑恢复功能, 为临床 “早诊断、早干预” 提供实验依据。同时向 2 周龄野生型 CBA 小鼠注射编辑系统,12 个月内 ABR 和 DPOAE 阈值与未注射组无差异, 排除编辑工具对正常听觉的干扰。
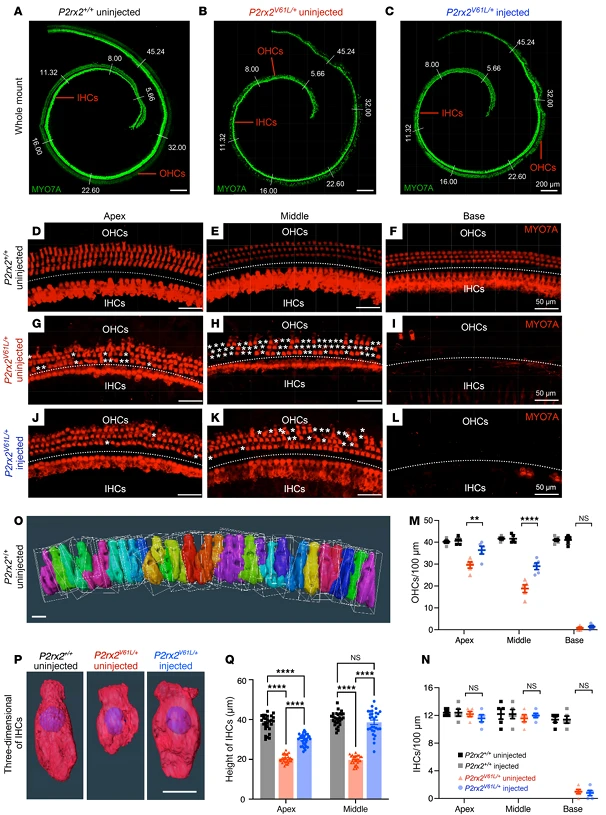
图3. V2–SaCas9–sgRNA-1成年注射可挽救DFNA41基因突变小鼠模型(P2rx2V61L/+)的外毛细胞(OHC)和内毛细胞(IHC)长度

图4. AV2–SaCas9–sgRNA-1在P2rx2V61L/+小鼠模型中挽救了DFNA41的毛细胞形态
四、噪声敏感性降低与前庭功能恢复的拓展价值
除听觉功能外,研究还验证了编辑系统对 DFNA41 其他关键表型的挽救效果,幼年(2 周龄)注射后,小鼠暴露于 97dB SPL(1-20kHz,2 小时)噪声,ABR 阈值与未暴露噪声组无差异,内毛细胞带状突触(CtBP2 标记)损失被完全挽救;成年(4 周龄)注射也能部分减轻噪声损伤,8.00、11.32kHz 频率 ABR 阈值升高幅度显著降低,且无外毛细胞功能异常,解决 DFNA41 患者 “怕噪声” 的临床痛点。编辑后 9 个月,小鼠椭圆囊毛细胞存活数量较未注射组增加 30%,接近野生型水平;行为学检测显示,开放场试验中过度活动、全身旋转行为消失,移动距离和速度恢复正常;转棒试验中平衡维持能力显著改善, 首次证实基因组编辑可修复遗传性耳聋相关的前庭障碍, 为临床评估 DFNA41 患者前庭功能提供新思路。
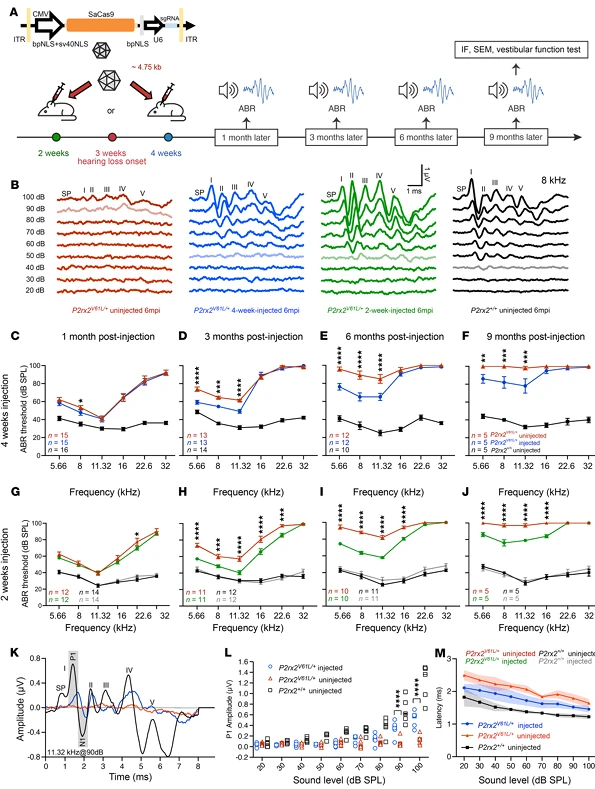
图5. AAV2-SaCas9-sgRNA-1对成年及幼年小鼠的注射,可维持P2rx2V61L/+小鼠模型中DFNA41的听觉功能

图6. AV2–SaCas9–sgRNA-1注射可减轻P2rx2V61L/+小鼠模型中DFNA41基因突变导致的NIHL敏感性增加。
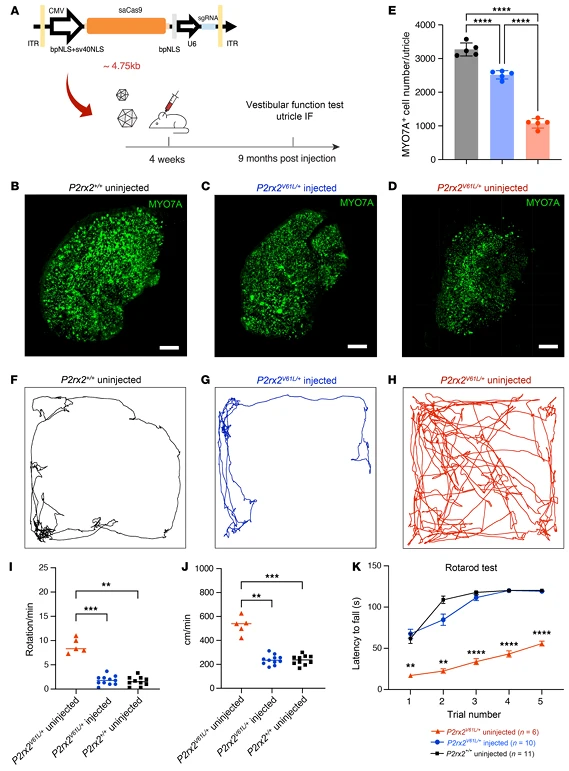
图7. V2-SaCas9-sgRNA-1成年注射可挽救P2rx2V61L/+小鼠模型中DFNA41相关的前庭囊毛细胞及前庭功能
五、人类 P2RX2 V60L 突变编辑工具的临床转化基础
为推动疗法向临床应用,研究团队在患者来源的诱导多能干细胞(hiPSCs)中,筛选针对人类 P2RX2 V60L 突变(c.178G≷T)的编辑工具,SaCas9-KKH/sgRNA1 对突变的编辑效率达 37.9%±2.3%,且 76% 的 indel 为移码突变;而 enosCas12f1/sgRNA2(4.6%±2.2%)和 Cas12j-8(<3%)效率极低, 证实 SaCas9-KKH/sgRNA1 是最优选择,该系统对野生型人类 P2RX2 等位基因无编辑,对预测均与听觉功能无关的 10 个潜在脱靶位点检测未发现 indel,为后续临床前安全性研究和 IND 申请提供关键数据。
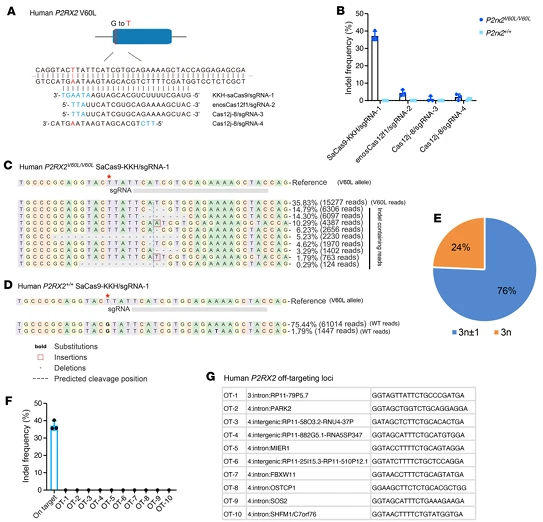
图8. 采用紧凑型CRISPR系统在患者来源的hiPSCs中实现2RX2V60L等位基因特异性基因组编辑
总结与展望:从动物实验到临床应用的路径
本研究通过系统设计与验证,证实 AAV2-SaCas9-sgRNA1 编辑系统可在成年 DFNA41 小鼠模型中实现高效、安全的等位基因特异性编辑, 同时挽救听觉功能、降低噪声敏感性、恢复前庭功能,并 筛选出适用于人类 P2RX2 V60L 突变的编辑工具, 为 DFNA41 的根治性治疗提供了 “从分子到整体” 的完整证据链。
- 高频听力未恢复, 成年小鼠基底回毛细胞(负责高频听力)仍完全丢失,可能与注射操作的机械损伤或高频率区域毛细胞提前退化有关,需改进递送技术(如减少基底回损伤)或结合毛细胞再生策略;
- 编辑效率待提升, 当前毛细胞编辑率约 27%,更高效率可能进一步扩大保护范围;三是人类前庭功能未知,需开展 DFNA41 患者的前庭功能临床研究,确认是否存在潜在功能障碍。
然而,研究仍存在需优化的方向:
未来,随着递送方案优化、临床前安全性验证(如非人灵长类动物研究)及联合干预策略探索,该编辑疗法有望成为首个针对 DFNA41 的临床治疗手段,同时为其他成年显性遗传性耳聋的基因编辑治疗提供可借鉴的技术范式。
源井生物基因敲除服务
源井生物已成功构建 8000+基因敲除(KO)细胞系, 特惠价低至 ¥4980! 交付快至1周左右。欢迎入库搜索您想要的细胞,如果没有找到您需要的细胞,我们也可以为您提供 定制化基因敲除服务。 依托自主研发的 CRISPR 创新技术,我们已在 300 + 种细胞中实现高效基因敲除,编辑效率较传统方法提升 10-20 倍。所有敲除细胞系均通过 PCR 检测 + Sanger 测序双重验证,确保基因编辑精准无误,为您的实验数据可靠性保驾护航!
联系我们了解更多>>>参考文献
Wei W, Zhu W, Silver S, Armstrong AM, Robbins FS, Rameshbabu AP, Walz K, Quan Y, Du W, Kim Y, Indzhykulian AA, Shu Y, Liu XZ, Chen ZY. Single-dose genome editing therapy rescues auditory and vestibular functions in adult mice with DFNA41 deafness. J Clin Invest. 2025 Aug 14;135(20):e187872. doi: 10.1172/JCI187872. PMID: 41090360; PMCID: PMC12520686.










