多重CRISPRa+单细胞测序:解析细胞类型特异性基因激活调控元件


传统的CRISPR以“基因剪刀”著称,能够精准切割DNA;而CRISPRa(CRISPR激活)技术则更像“基因音量调节器”,能够上调基因表达却不改变DNA序列本身。CRISPRa利用失活的Cas9蛋白融合转录激活结构域,实现可逆、精细的基因调控,在研究与治疗中潜力显著。
然而常规CRISPRa筛选存在一个关键局限——难以评估细胞类型特异性的调控效果,而这对于避免基因治疗中的脱靶效应至关重要。2024年9月发表于《Nature Communications》的一项研究提出了一种策略:将多重CRISPRa筛选与单细胞RNA测序结合,建立了多重单细胞CRISPRa筛选平台,可用于识别细胞类型特异性的调控元件。

研究背景
人类基因组中存在数百万个候选顺式调控元件(cCREs),但其中仅有少数经过功能验证且能可靠关联其靶基因。早前,作者团队联合其他研究者采用 CRISPR 干扰(CRISPRi)与单细胞RNA测序技术,实现了对远端cCREs的大规模验证,并成功将其与调控基因建立关联。然而迄今为止,CRISPRa尚未被广泛应用于非编码筛选,需要更多数据来制定其使用指南。且该领域绝大多数研究仍聚焦于筛选候选调控元件的必要性,仅有少数研究尝试在内源性环境中验证其充分性。
然而,传统方法难以大规模匹配调控元件与其靶基因,感染效率低、单sgRNA设计也无法全面捕捉基因表达变化。一方面,传统CRISPRa文库以较低的感染效率实现每个细胞单个sgRNA整合,不利于高效筛选验证人类基因组中有数百万cCREs与约2万个受调基因的配对组合;另一方面,传统CRISPRa文库专注于单个基因的调控,且后续涉及特定基因的表达鉴定,更无法全面了解基因扰动带来的表达变化。
多重单细胞CRISPRa筛选策略
作者团队设计了一种创新筛选策略(图1),克服了传统CRISPRa文库在批量筛选中的局限性。其创新设计的核心在于:
- 随机组合gRNAs导入: 基于piggyBac转座子系统,实现单个细胞中多个gRNA的随机组合,增强扰动效果并减少所需细胞数量。这种随机gRNA组合介导的多重遗传扰动显著增强了基因表达变化检测能力,并大幅度减少分析所需的细胞样本量。
- 单细胞RNA测序(scRNA-seq): 作者采用先进的 10x Genomics scRNA-seq代替基因特异性测定,一次实验就可以全面地检测基因表达变化,无需预设目标基因。
- 计算分组: 通过差异表达分析,精准识别gRNA对靶基因的调控作用。
总之,这种方法的关键优势在于其高通量特性——通过一次实验即可对大量调控元件进行匹配测试,同时节省了时间和资源。
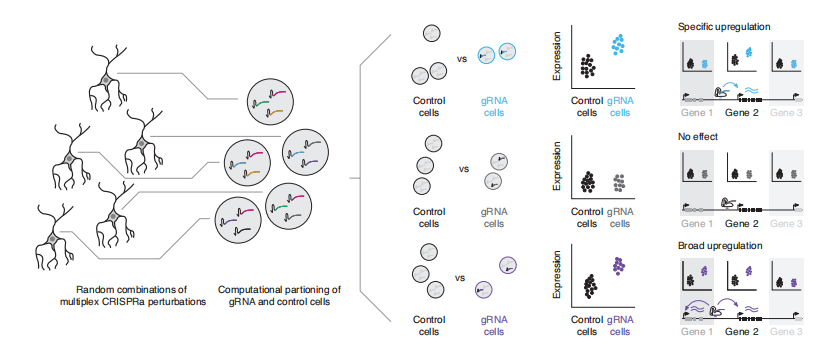
图1. 多重单细胞CRISPRa筛选策略示意图
实验设计
-
细胞系
研究选用了慢性髓系白血病细胞 K562 和人诱导多能干细胞(iPSC)衍生的兴奋性神经元细胞这两种具有代表性的细胞系来探究调控元件是否以细胞类型特异性的方式发挥作用。 -
dCas9-激活复合体体构建与验证
鉴于目前尚未就哪种CRISPRa激活复合体最适合广泛且可扩展地靶向cCREs,作者同步测试了VP64激活复合体(由四个VP16效应器拷贝组成)和VPR激活复合体(由VP64效应器与p65及Rta效应器20,21融合组成)这两种常用的dCas9-激活复合体。此外,作者采用CMV启动子-tdTomato报告系统,通过tdTomato的表达对其CRISPRa活性进行严格验证。 -
gRNA文库设计与构建
gRNA的设计是应用验证的关键环节,其设计过程涉及多个步骤,以确保能够有效筛选出与细胞类型特异性调控元件相关的gRNA,具体设计过程如下:- 阳性对照gRNA的选取: 从先前Horlbeck等人经过验证的hCRISPRa-v2 文库中随机抽取30个靶向转录起始位点(TSS)附近的gRNAs作为阳性对照。
- 阴性对照gRNA的确定: 同样从hCRISPRa-v2文库中选择50个非靶向对照(NTC)。
- 候选靶向启动子gRNA的设计: 靶向9种神经发育障碍(NDD)风险基因(TCF4、FOXP1、SCN2A、CHD8、BCL11A、TBR1、SHANK3、SYNGAP1、ANK2)的50个候选TSSs处设计选取313条gRNA。
- 候选靶向增强子gRNA的设计: 其中50条gRNA靶向经作者团队先前CRISPRi验证“有活性”的25个增强子位点;另外50条gRNA靶向作者团队先前CRISPRi验证“无活性”,但在K562细胞中预测具有强烈增强子效果的的25个增强子位点。
研究结果
通过对 K562 细胞的筛选实验,成功鉴定出多个能够有效上调基因表达的启动子和增强子靶向 gRNA,确定了 59 个激活 gRNA 命中(图2)。这些 hits 涵盖了多种类型,包括针对已知基因(如 FOXP1、CHD8 等)的启动子靶向 gRNAs,以及针对 ANK2 等基因的增强子靶向 gRNAs。研究发现,这些成功激活的 gRNAs 对目标基因具有高度的特异性,且在基因组上与目标基因的距离较近,为深入理解 K562 细胞中的基因调控网络提供了重要线索。
此外,研究还发现部分增强子单独作用即可上调目标基因表达,这一发现挑战了传统观念中增强子与启动子协同作用的认知,为进一步探索基因调控的多样性和复杂性提供了新的方向。
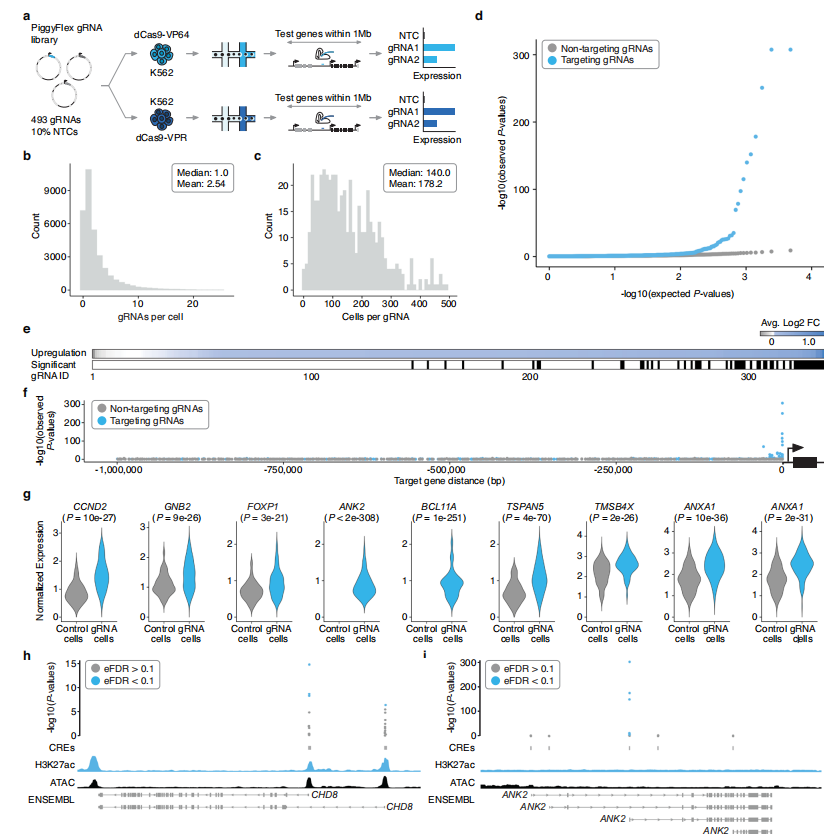
图2. 多重单细胞CRISPRa对K562细胞调控元件的筛选
而在 iPSC 衍生神经元的筛选中,以严格的经验 FDR 为 0.1 确定了 17 个 hit gRNAs,这些 gRNAs 均为 TSS 靶向阳性对照或与神经发育密切相关的 ASD/NDD 风险基因(如 TCF4、FOXP1、TBR1 等)的候选启动子(图3)。研究结果显示,这些 gRNAs 在神经元中具有高度的靶标特异性,如针对 TBR1 的 gRNA 能够在神经元中特异性地上调 TBR1 的表达,而在 K562 细胞中则无此效果,这一发现凸显了该筛选框架在识别细胞类型特异性调控元件方面的卓越能力,为深入研究神经元发育和功能相关的基因调控机制提供了关键依据。
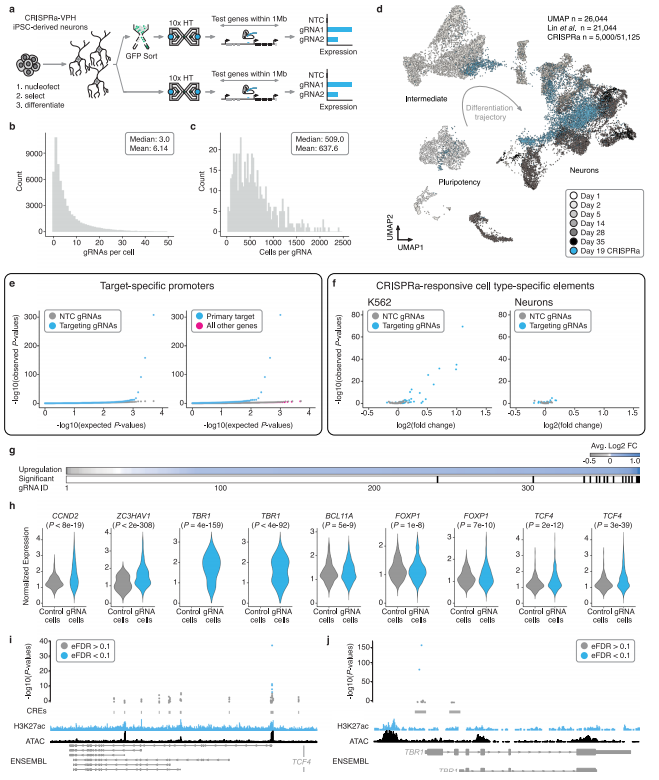
图3.多重单细胞CRISPRa对有丝分裂后iPSC来源的神经元细胞调控元件的筛选
为了进一步验证筛选结果的可靠性,研究人员运用了 SCEPTRE 分析算法对数据进行重新评估。结果显示,SCEPTRE 检测到了更多的 hits,且这些结果与原始分析方法高度一致,这有力地证明了研究结果的稳定性和可靠性(图4)。此外,通过精心设计的独立单独靶向实验,分别对 8 个代表性的 hit gRNAs 进行重复验证。测序结果表明,多数 gRNAs 在相应的细胞类型中能够如预期般上调目标基因的表达,且实验结果与多重单细胞框架的分析结果呈现出良好的相关性(Pearson's correlation coefficient = 0.83),这为研究结果提供了坚实的实验支持,进一步增强了研究结论的可信度。
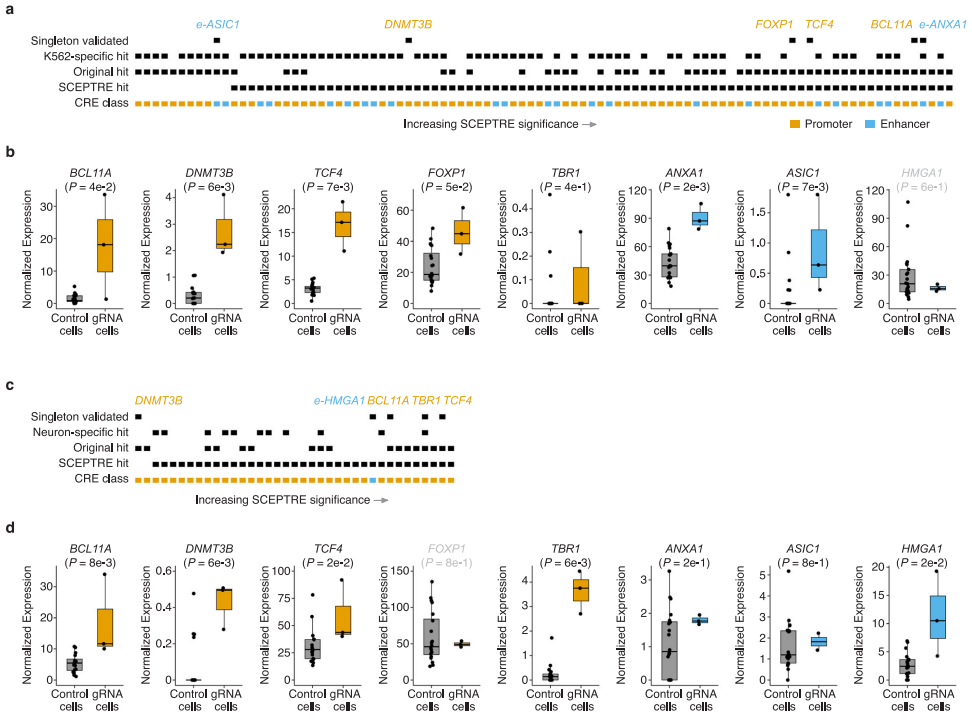
图4.通过协变量分析和单例实验验证支持并扩展结果
综合来看,这些结果进一步完善和扩展了多重单细胞CRISPRa筛选框架,并成功识别出功能性和细胞类型特异性地靶向K562细胞和iPSC衍生兴奋性神经元中单倍体不足基因的内源性CRE。
总之,多重单细胞CRISPRa筛选框架具有识别针对目标和细胞类型特异性的CRISPRa响应调控元件及靶向它们的gRNA的能力,并且能进一步的识别不同细胞类型下的特异性CREs。
应用前景
这项研究的应用前景广泛,涵盖了从基础生物学研究到疾病治疗的多个领域。 在基础科学研究中,该方法可帮助构建全面的细胞类型特异性增强子-基因调控图谱,有助于揭示生命过程中基因表达调控的奥秘。在疾病研究方面,该方法可用于系统性地识别与疾病相关的非编码变异的功能效应,帮助解析全基因组关联研究(GWAS)中发现的风险位点的机制。尤其在临床应用方面,该技术有望为大规模筛选治疗单倍体不足相关疾病的 gRNAs 和细胞类型特异性 CREs 提供重要的技术支持,为开发细胞类型特异性的基因调控疗法提供了路线图。未来的研究可以进一步扩大筛选规模,将更多细胞类型和发育阶段纳入分析,构建更全面的基因调控图谱。
源井生物CRISPR文库服务
源井生物基于自主研发的 CRISPR-iScreen™ 技术,搭建了包括 CRISPR-KO、CRISPRa、CRISPRi 等筛选方式在内的文库筛选平台,提供全流程一站式 CRISPR 筛选服务,各环节无缝衔接,高效实现靶点筛选!源井生物CRISPR 筛选全面覆盖体外与体内两大应用场景, CRISPR体外筛选 提供多样化表型分析方法,满足您的个性化需求; CRISPR体内筛选 精准还原生理微环境,搭配多种小鼠模型选择,完美匹配不同研究方向的实验设计,为靶点验证提供更贴近真实生理状态的可靠数据支撑。
联系我们了解更多>>>参考文献
Chardon FM, McDiarmid TA, Page NF, Daza RM, Martin BK, Domcke S, Regalado SG, Lalanne JB, Calderon D, Li X, Starita LM, Sanders SJ, Ahituv N, Shendure J. Multiplex, single-cell CRISPRa screening for cell type specific regulatory elements. Nat Commun. 2024 Sep 18;15(1):8209. doi: 10.1038/s41467-024-52490-4. PMID: 39294132; PMCID: PMC11411074.










