如何一次成功?基因敲除细胞实验的优化秘诀


如何一次成功?基因敲除细胞实验的优化秘诀

基因敲除(Knockout, KO)技术作为解析基因功能、探究疾病发生机制及验证药物靶点的核心手段,已在生命科学研究领域得到广泛应用。然而,在实际操作中,该技术仍面临敲除效率低下、脱靶效应显著及结果验证体系构建困难等关键技术瓶颈,制约了研究的深度与可靠性。
作为长期致力于基因编辑领域研究的科研工作者,小源将从实验设计与操作的关键技术要点、核心注意事项、常见技术难点与认知误区、典型问题解析及解决方案,以及实用故障排除经验五个维度,系统且深入地剖析基因敲除实验的优化策略,为研究者提供专业化的技术参考。
一、从源头提升 KO 成功率
1. 精准的 sgRNA 设计策略
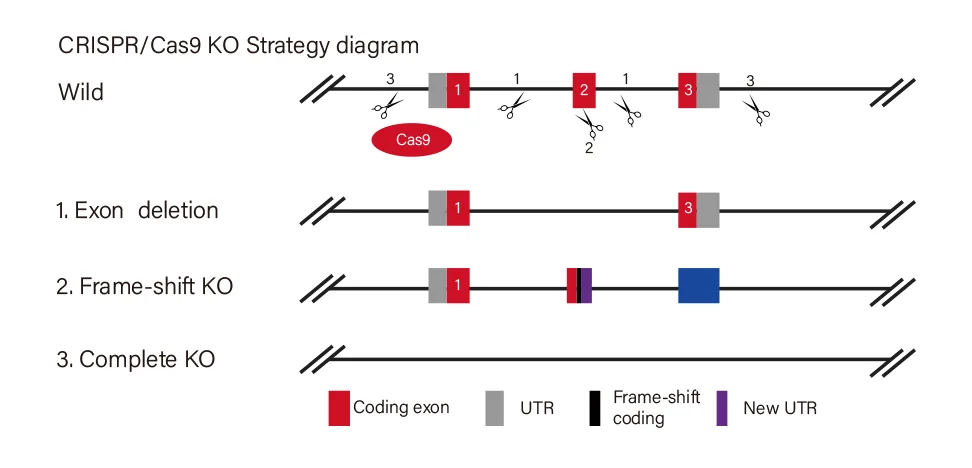
- · 选择靶点时,优先定位于基因外显子的 5' 端区域,以最大化移码突变(frameshift mutation)的发生概率,确保蛋白编码提前终止。
- · 采用多算法交叉验证(如 CRISPR Design Tool、Benchling、CHOPCHOP)进行 sgRNA 评分与脱靶预测,通过叠加分析筛选特异性评分≥90 分的候选序列,显著降低脱靶风险。
- · 结合物种特异性功能基因组数据库(如 Ensembl、UCSC Genome Browser),规避位于高度保守结构域或功能未知区域的靶点,减少潜在的代偿效应干扰。
源井生物自主研发的红棉·CRISPR基因编辑系统,可在一分钟内自动生成三套设计方案。三大神器助力,高效评估基因敲除风险,让实验设计更智能、更可靠。
2.选择合适的编辑系统与载体
- · 对于常规永生化细胞系(如HEK293、HCT116),采用质粒载体介导的 Cas9/sgRNA 共转染体系即可满足实验需求,兼具经济性与高效性。
- · 针对难转染细胞(如神经细胞),推荐使用慢病毒载体介导的稳定表达系统或 RNP(核糖核蛋白)递送系统,前者可通过整合实现长效编辑,后者能降低 DNA 整合相关的毒副作用,提升细胞存活效率。
- · 条件性敲除(conditional KO)实验中,需采用 loxP/Cre 重组系统或 Tet-on/off 等诱导性表达系统,通过时空特异性调控实现关键基因的可控性缺失,避免胚胎致死或早期发育异常。
源井生物已成功在超过300种细胞类型中实现高效基因编辑,累计完成6000余例成功案例。凭借丰富的细胞编辑经验与优化的实验流程,我们能够显著提升阳性克隆的获得率,并有效降低脱靶风险与实验失败率,敲除效率可高达97%。无论是常规细胞系、干细胞还是高难度细胞,源井均能提供高效、可靠、可重复的定制化基因编辑解决方案,助力科研团队快速推进功能基因研究、疾病机制解析及药物靶点验证。
3.多维度验证体系的构建
- · PCR 扩增+测序基因组水平:通过 PCR 扩增靶标区域并进行 Sanger 测序或 NGS 分析,验证 indel(插入/缺失)突变的效率及突变类型。
- · 转录水平:采用 RT-qPCR 检测目的基因 mRNA 的相对表达量,评估转录本的降解或截短情况。
- · 蛋白水平:结合 Western blot 定量分析目的蛋白表达量,或通过免疫荧光染色观察蛋白定位变化,直接验证敲除效果。
源井生物敲除细胞系服务提供PCR检测及Sanger测序验证,确保基因编辑的准确性。如有特殊验证需求(如Western Blot蛋白水平验证),可根据具体项目进行评估并提供相应服务,点击在线咨询>>>
二、实验注意事项:细节决定成败
1. 细胞状态的严格质控
需全程维持细胞的良好状态,避免使用高代次的细胞或出现形态异常、增殖速率下降的细胞。高代次的细胞可能积累基因组变异,而状态不佳的细胞会显著降低转染效率及编辑系统的活性,导致实验重复性下降。
2.试剂与培养基的标准化处理
转染前需确认培养基、转染试剂及相关缓冲液均处于无菌状态且新鲜配制,避免因试剂降解(如血清中生长因子失活)或污染(细菌、支原体)引发细胞毒性,干扰编辑过程。
3.转染条件的个性化优化
根据细胞类型特异性优化转染参数:适当优化转染条件(DNA/试剂比例、细胞密度、脉冲参数等)。
4. 验证体系与对照设置的前瞻性设计
在细胞基因组编辑前,提前规划好验证方法与阳/阴性对照。
三、实验中常见困难与应对方案
| 困难 | 可能原因 | 解决方案 |
|---|---|---|
| 敲除效率低 | sgRNA 活性不足、转染效率低 | 重新设计靶点、提高导入效率、更换编辑系统 |
| 高脱靶率 | sgRNA 特异性差 | 优化设计、使用高保真 Cas9(HiFi Cas9) |
| KO 导致细胞死亡 | 目标基因为必需基因 | 采用条件性 KO 或 RNAi 部分沉默 |
| 单克隆筛选失败 | 分选效率低、细胞状态差 | 使用自动化单细胞分选仪、优化培养条件等 |
四、常见错误与预防
错误 1:忽视细胞类型差异
对所有细胞系采用统一的编辑系统与导入方式。
- 潜在风险:难转染细胞(如神经细胞)的编辑效率可能低于 10%,而敏感细胞系可能因载体毒性导致大量死亡,影响实验重复性。
- 预防措施:根据细胞特性选择适配的递送系统 —— 通过预实验验证不同系统的兼容性。
错误 2:过度依赖预测软件
- 潜在风险:预测结果可能与实际细胞环境存在偏差,导致敲除效率低于 30% 或脱靶效应显著。
- 预防措施:对候选 sgRNA 进行小规模预实验,通过酶切或流式细胞术检测编辑效率,同时结合脱靶位点测序筛选最优序列,避免直接进入大规模实验造成资源浪费。
错误 3:验证时间点选择不当
转染后 24 小时内过早检测(可能因编辑未完成导致假阴性),或超过 7 天延迟检测(可能因细胞增殖稀释编辑细胞比例导致假阴性)。
- 潜在风险:初检时间过早会漏检真实编辑事件,过晚则可能因非编辑细胞竞争性增殖掩盖阳性信号,干扰结果判断。
- 预防措施:根据编辑系统特性设定合理检测窗口 ——例如瞬时转染实验建议在 48–72 小时进行检测(此时 Cas9 活性达峰值且细胞状态稳定),稳定敲除细胞系需在药物筛选后 1–2 周检测(确保抗性细胞克隆均为编辑阳性)。
五、客户常见疑问
Q1. 多久可以完成一个 KO 项目?
视细胞类型与策略不同,常规 8–10 周,特殊细胞系需更长。源井生物基于优化的技术体系和红棉自动化方案设计系统,可以实现快速准确鉴别,快至4周筛到阳性克隆。为研究者加速实验进程提供有力支持。
Q2.难转染细胞能做吗?
可以做。CRISPR-U™是源井生物自主研发的高效细胞基因编辑平台,基于 CRISPR/Cas9 技术,结合独特的 gRNA 设计算法、丰富的细胞系编辑参数数据库、精确的 Pool 编辑效率检测方法、单克隆形成率提升策略,以及适用于微量细胞的高通量基因型鉴定体系。在基因敲除细胞系构建方面,源井生物自主研发的 CRISPR-U™ 技术相较于传统方法,可将基因编辑效率提升 10–20 倍。
Q3.基因敲除与敲低有什么区别?
基因敲除细胞系是通过CRISPR/Cas9等手段永久性删除目标基因,可以实现使其失活;而基因敲低细胞系则通过siRNA或shRNA等方式暂时性或部分抑制基因表达,基因本身仍存在。敲除适用于深入研究基因功能或构建疾病模型,敲低则更适合初步筛选或研究必需基因。两者在稳定性、效率和应用场景上各有优势。
源井生物不仅提供基因敲除细胞系构建服务,还可为您定制高效的基因敲低解决方案。无论您的研究目标是基因功能验证、机制探索,还是疾病模型构建,源井生物都能为您提供可靠、高效的基因编辑解决方案。
Q4.基因敲除服务多少钱?
专业 KO 服务会提供从 DNA 到蛋白的全流程验证数据。源井生物已构建8000+基因敲除(KO)细胞系,特惠价低至¥4980!交付快至1周左右。如未找到目标细胞株,我们还可提供定制化基因敲除服务,满足个性化科研需求。点击在线咨询>>>
六、实战经验
- 1. 低编辑效率:先用 GFP 报告系统评估导入效率,必要时提高 MOI(病毒感染方法)或更换 sgRNA。
- 2. 脱靶效应显著:主要源于 Cas9 非特异性切割或 sgRNA 与基因组其他区域存在高度同源性。可以更换高保真 Cas9,并缩短 Cas9 表达时间。
- 3. 细胞死亡率高:降低转染剂量,调整导入时间窗口,或更换为条件性敲除策略。
- 4. 单克隆生长缓慢:优化培养基成分,增加生长因子或使用条件培养箱。
七、结语
基因敲除实验作为生命科学研究中解析基因功能的核心技术,其成功与否取决于策略设计的科学性、操作细节的严谨性及实验经验的积累深度。从 sgRNA 靶点的精准筛选、编辑系统与细胞类型的适配,到转染条件的优化、单克隆的高效筛选,再到多维度验证体系的构建,每个环节均需层层把控 —— 任何一处疏漏都可能导致实验周期延长、结果可靠性下降,甚至整个项目失败。
对于追求高效、稳健结果的研究者而言,与具备成熟技术体系的专业团队合作,可显著降低实验风险。源井生物深耕基因编辑领域多年,依托CRISPR-UTM多平台技术矩阵、经过验证的标准化实验流程(敲除效率≥97%),以及一万余种细胞模型构建经验,能够提供从方案设计、细胞编辑到阳性克隆验证的一站式 KO 解决方案。这不仅能帮助研究者规避技术难点、缩短项目周期,更能释放科研精力,聚焦于核心科学问题的探索与创新。
联系我们,了解更多技术服务内容>>









