精准分化!iPS 细胞打造 EHM 心肌移植物,推动心衰再生治疗临床应用


精准分化!iPS 细胞打造 EHM 心肌移植物,推动心衰再生治疗临床应用
在全球范围内,心力衰竭仍是心血管疾病领域的重大挑战,现有治疗手段难以实现受损心肌的再生修复。2025年3月,题为Engineered heart muscle allografts for heart repair in primates and humans的一项研究在《Nature》发布,该研究 聚焦 iPS 细胞来源的心外膜工程化心肌(EHM)同种异体移植物 ,经多模型验证其效果与安全性:恒河猴与人类 EHM 关键特性一致且无残留多能干细胞;裸鼠、健康及心衰恒河猴模型中,EHM 显著改善心脏功能、实现长期留存并明确安全剂量与免疫方案;人类晚期心衰患者中,EHM 成功留存并再生心肌,患者病情稳定无严重副作用。 研究为 EHM 临床转化提供完整证据链,解决心肌再生核心难题,推动晚期心衰再生治疗迈向临床,奠定后续试验基础。

一、研究背景
心肌细胞植入是修复衰竭心脏的潜在策略,但长期面临三大核心难题:
1. 细胞留存与疗效失衡 :现有方案难以实现心肌细胞的长期留存,无法形成可持续的治疗效果,难以改善心脏结构与功能。
2 .安全性风险突出 :直接植入心肌细胞易引发心律失常、肿瘤生长等严重副作用,限制临床应用。
3. 动物模型转化局限 :小动物(如啮齿类)异种移植研究中,强烈的免疫反应导致移植物难以长期存活(尚无研究证明其在免疫功能正常动物中能存活超 3 个月),且无法可靠预测大动物及人类的治疗结果;而自体移植存在技术复杂性高、难以规模化应用的问题。
基于此,研究团队提出核心假设:能否通过由 iPS 细胞衍生的心肌细胞与基质细胞构建的心外膜工程化心肌(EHM)同种异体移植物,实现慢性衰竭心脏的结构与功能再生,且无严重副作用,从而有助于推进心力衰竭的人类临床试验。
二、研究结果
1. 恒河猴与人类 EHM 特性比较:奠定临床转化模型基础
为明确恒河猴 EHM 能否作为人类 EHM 临床转化的可靠模型,研究团队构建了恒河猴 iPS 细胞来源的 EHM 与人类 GMP 级 iPS 细胞来源的 EHM,通过流式细胞术、单细胞 RNA 测序(snRNA-seq)及收缩功能检测,系统比较两者在细胞组成、结构及收缩性能上的差异。结果显示,两类 EHM 在关键指标上高度一致:细胞组成方面,恒河猴与人类 EHM 中 ACTN2 + 心肌细胞比例分别为 69±3%、81±3%;收缩功能方面,均能在电刺激下产生稳定收缩力;结构特征方面,肌节排列均规则有序。更重要的是,snRNA-seq 未在两类 EHM 中检测到残留多能干细胞,直接排除了肿瘤形成风险,这 为后续以恒河猴为模型开展 EHM 安全性与有效性研究提供了核心依据。
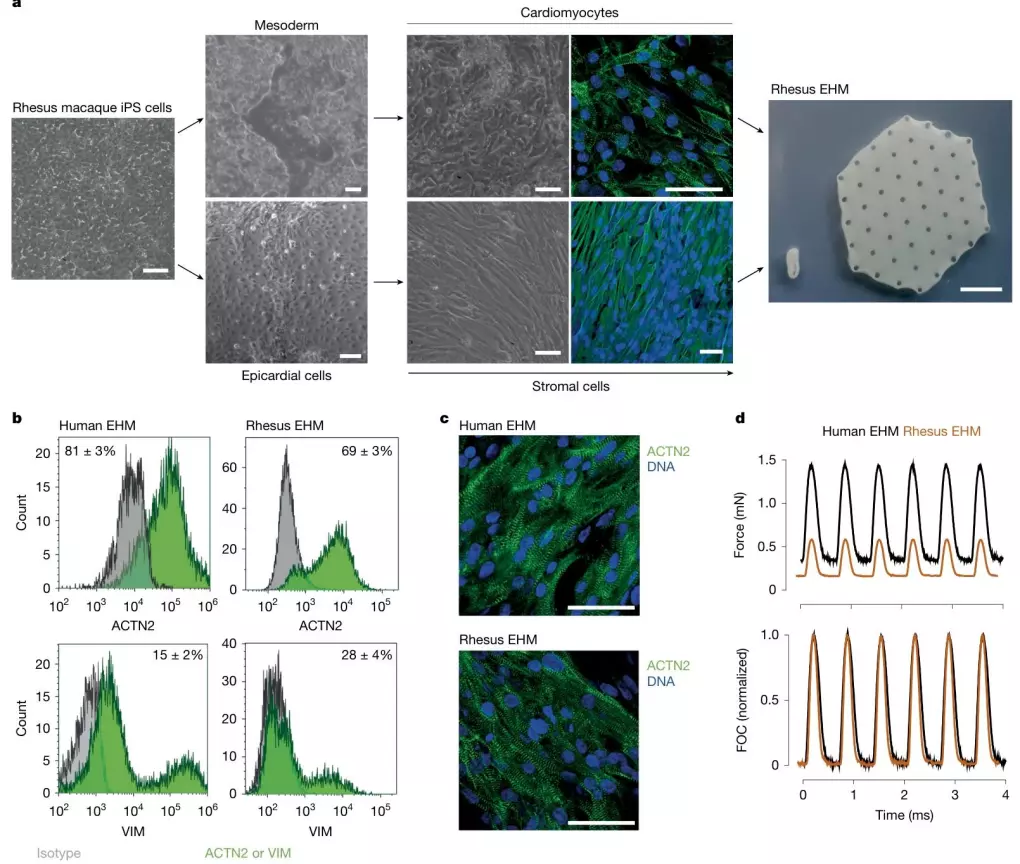
图1. 恒河猴工程化心肌(EHM)的制备与表征
2. 裸鼠模型初步探索:验证 EHM 功能改善潜力
在明确恒河猴 EHM 与人类 EHM 的一致性后,研究团队进一步在裸鼠缺血再灌注(I/R)损伤模型中,初步验证 EHM 的可行性与功能改善效果。15 只裸鼠经 I/R 损伤构建心脏损伤模型 4 天后,被随机分为两组,分别植入存活的恒河猴 EHM(n=7)与致死照射的恒河猴 EHM(n=8),4 周后通过超声心动图评估心脏功能。数据显示,植入存活 EHM 的裸鼠,射血分数从基线的 47±4% 显著提升至 59±3%(P=0.0174),每搏输出量从 102±10μL 增加至 173±13μL(P=0.0016);而植入致死照射 EHM 的裸鼠,心脏功能无显著改善。同时,组织病理学分析未发现存活 EHM 组存在残留多能干细胞及肿瘤形成, 这一结果初步证实,存活的 EHM 具备改善损伤心脏功能的潜力,且无明显安全隐患。
3. 健康恒河猴模型研究:确定 EHM 安全剂量与免疫方案
基于裸鼠模型的阳性结果,研究团队转向更贴近临床场景的健康恒河猴模型,旨在确定 EHM 的安全剂量、最优免疫抑制方案及移植物长期留存效果。14 只健康恒河猴被分为队列 1(1× EHM,4000 万细胞 / 千克,随访 3 个月)与队列 2(5× EHM,2000 万细胞 / 千克,随访 6 个月),并测试他克莫司单药、他克莫司 + 甲泼尼龙、环孢素 + 甲泼尼龙三种免疫抑制方案,通过 MRI 与组织病理学评估心壁厚度及移植物留存情况。结果显示:其一,EHM 对心壁的增厚作用呈剂量依赖性,5× EHM 组目标心壁增厚 4.5±0.6mm,显著高于 1× 组的 1.4±0.3mm(P<0.001);其二,免疫抑制方案中,他克莫司(目标谷浓度 5-15ng/mL)联合甲泼尼龙(0.15mg/kg/ 天)的方案效果最优,可实现 EHM 长达 6 个月的留存,且停药后能诱导移植物可控排斥,而环孢素方案下 1 只动物出现自体移植物排斥;其三,安全性方面,14 只恒河猴均未观察到心律失常、肿瘤,仅 5 只出现剂量依赖性骨软骨细胞分化,且延长代谢筛选至 7 天可消除该现象。最终,研究确定 他克莫司 + 甲泼尼龙为最优免疫抑制方案,5× EHM 为安全最大剂量。
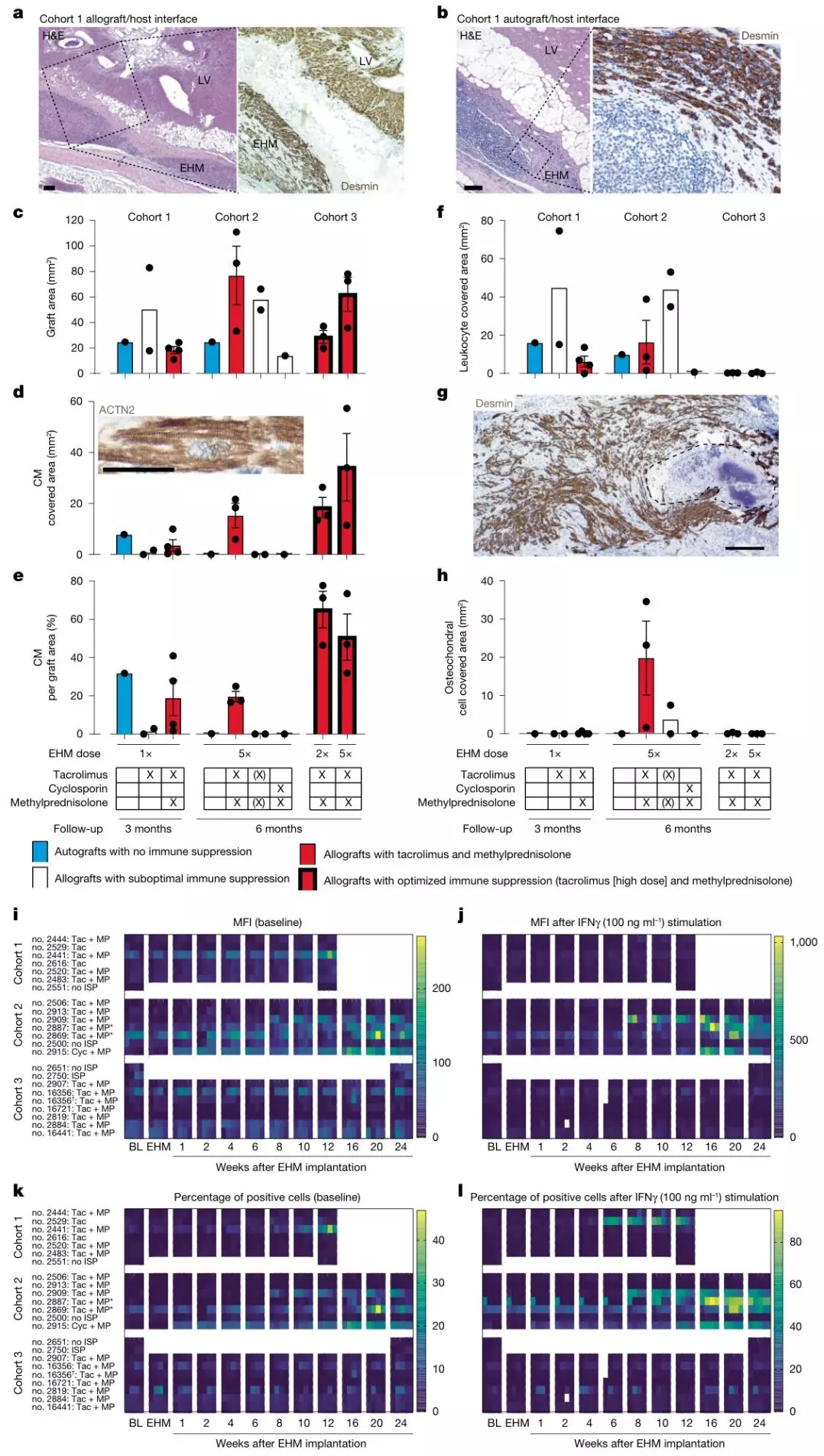
图2. 组织病理学特征与同种异体致敏反应
4. 慢性心衰恒河猴模型验证:证实 EHM 修复衰竭心脏的能力
在明确健康恒河猴中 EHM 的安全参数后,研究团队进一步在病理状态下的恒河猴模型中,验证 EHM 对衰竭心脏的结构修复与功能改善作用。19 只恒河猴通过 I/R 损伤构建慢性心衰模型,6 个月后随机分为 EHM 植入组(2×/5× 剂量)与对照组(有 / 无免疫抑制),随访 6 个月期间,通过 MRI 检测心壁厚度与射血分数,结合组织病理学与 MRI 验证血管化情况。结果表明:结构修复上,5× EHM 组目标心壁增厚 2.2±0.1mm,显著优于对照组的 - 0.03±0.07mm(P<0.00001);功能改善上,3/6 EHM 植入猴的心壁收缩分数提升 21±0.2%(显著高于对照组的 0.6±3.3%),3/4 猴的射血分数提升 7±3%(P=0.0389)。
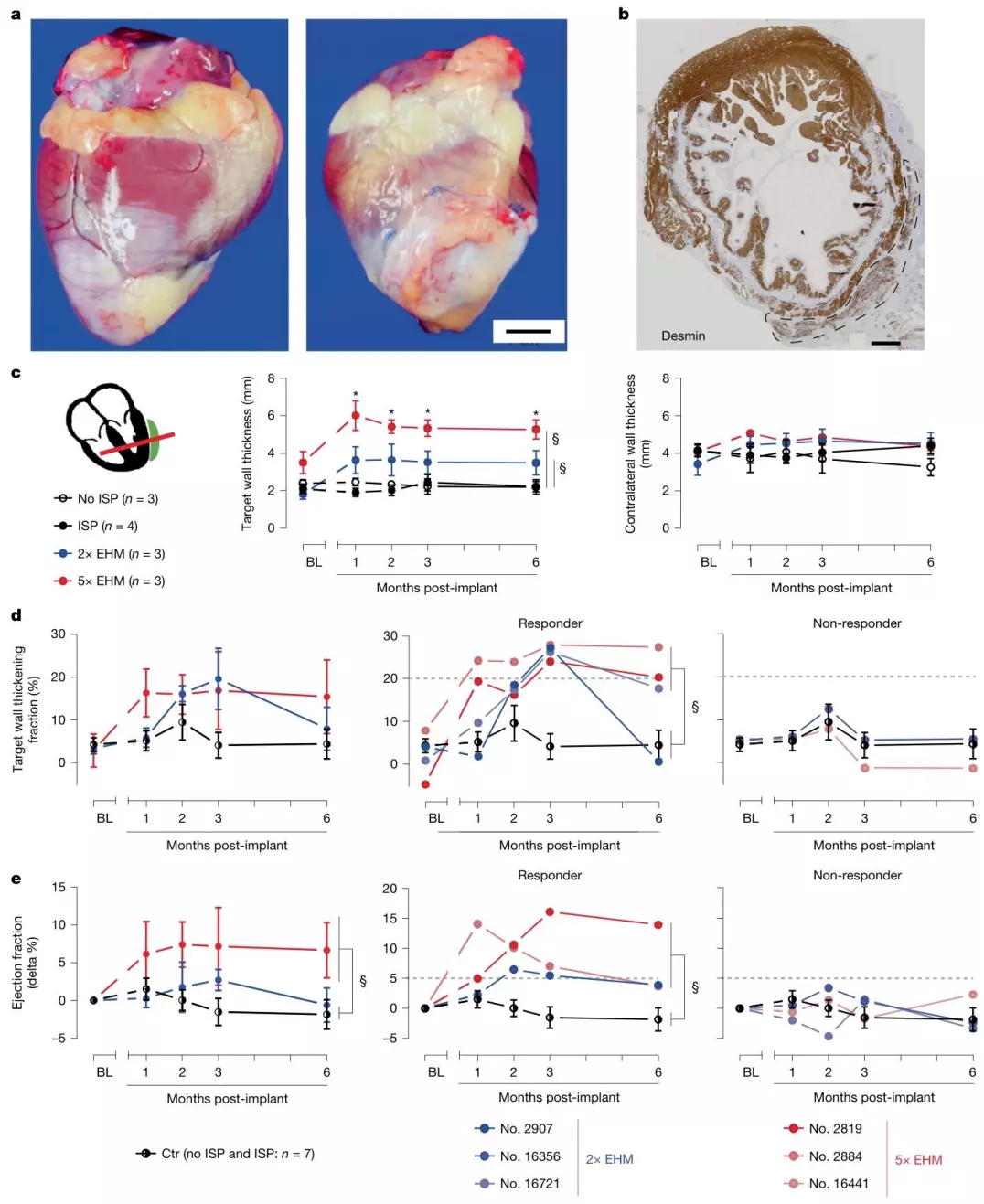
图3. 在慢性心力衰竭模型中,EHM同种异体移植物通过心肌再生改善局部及整体心功能
血管化方面,钆增强 MRI 及组织病理学证实,EHM 移植物毛细血管密度达 281±37 个 /mm²,与宿主心肌血管化水平匹配,可保障移植物长期存活。 这些数据充分说明,EHM 不仅能在健康心脏中安全留存,更能有效修复衰竭心脏的结构与功能。
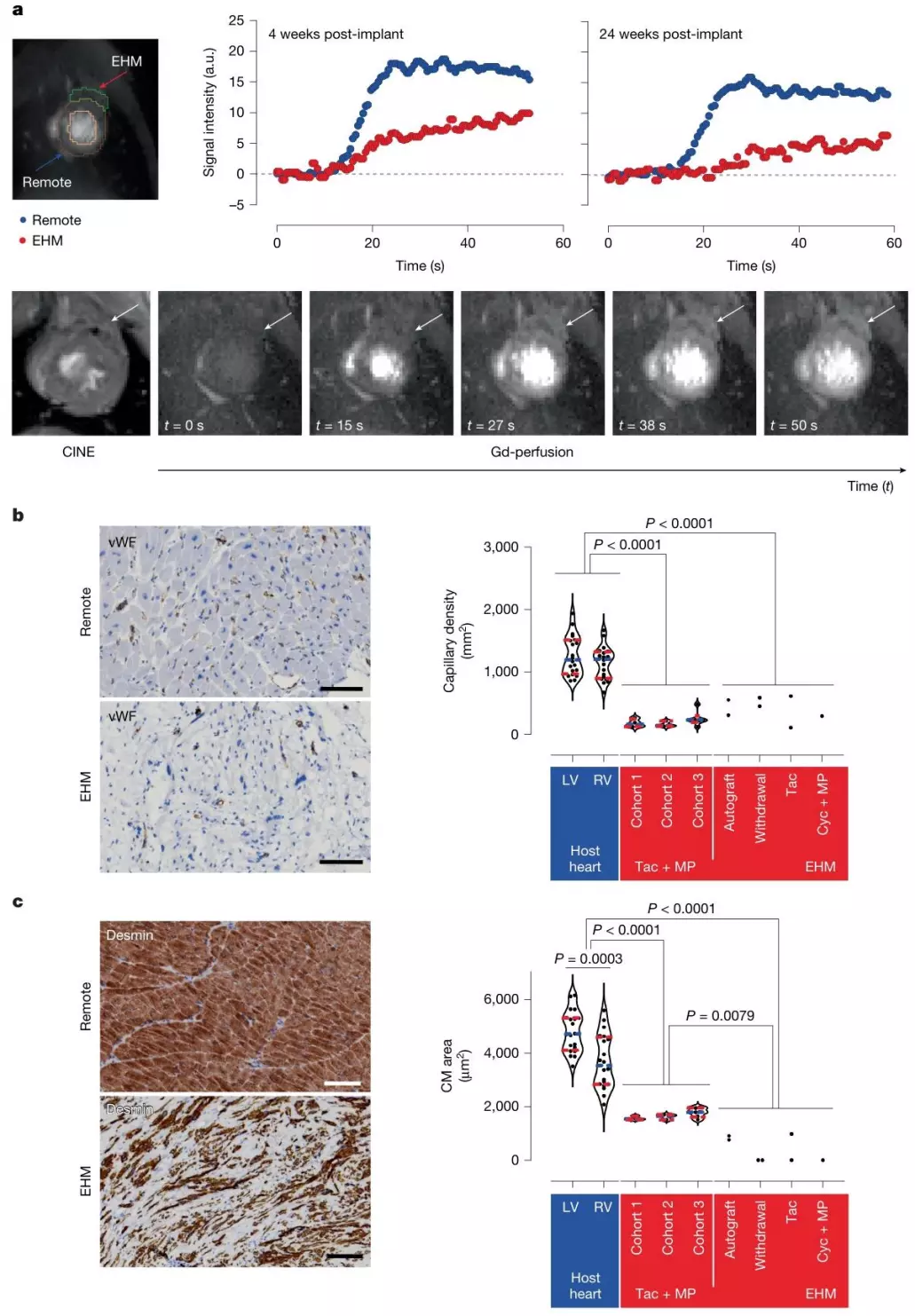
图4. EHM同种异体移植物血管化与灌注的证据
5. 人类临床验证:实现从动物到人类的转化突破
经过多轮动物模型验证后,研究团队最终推进至人类临床试验,以验证 EHM 从动物到人类的临床转化可行性。研究纳入 1 名晚期心衰患者(NYHA III 级,射血分数 35%),为其植入 10× EHM(4 亿细胞),3 个月后患者因病情进展接受心脏移植,研究团队通过组织病理学、基因测序分析移植物留存与心肌再生情况。结果显示:EHM 移植物成功在患者心脏中留存,尽管移植物中心肌细胞面积(947±35μm²)小于宿主心肌细胞(3632±168μm²),但已形成规则的肌节结构;移植物区域毛细血管密度达 187±5 个 /mm²,实现局部血管化;患者术后病情稳定,射血分数提升至 39%,无心律失常等副作用,且未检测到供体特异性抗体。 这一结果首次在人类中证实 EHM 的心肌再生效果与安全性,为后续大规模临床试验奠定了关键基础。
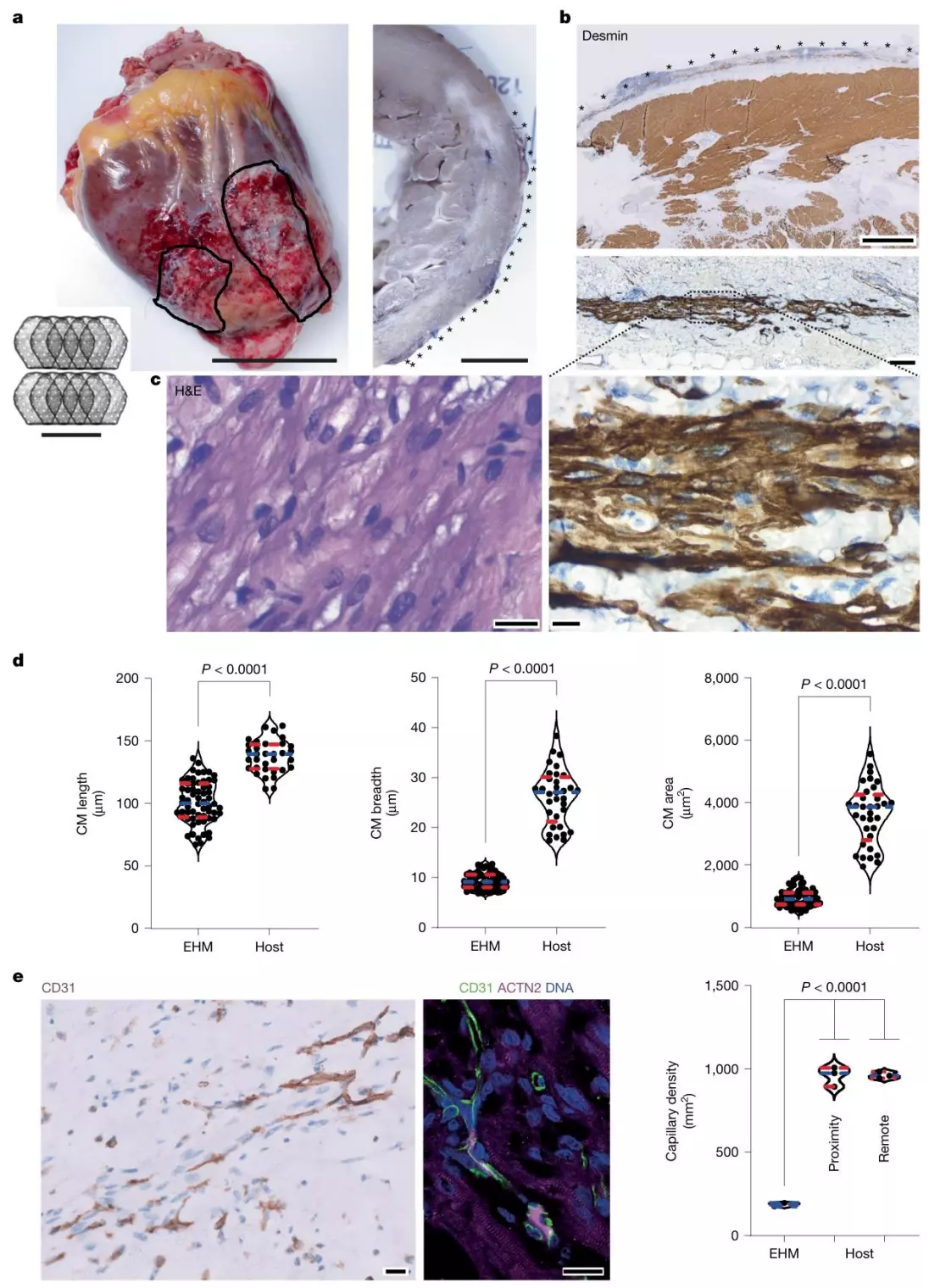
图5. 人类心脏的心肌再生
三、研究意义
该研究的研究意义体现在两个方面:第一个方面是确立了EHM 移植物的转化价值,恒河猴 iPS 细胞来源的 EHM 同种异体移植物, 在大动物模型中实现 “长期留存(6 个月)- 结构修复 - 功能改善” 的完整链条 ,且 无严重安全性问题(无心律失常、肿瘤) ,为人类临床应用提供核心实验依据。另一方面是 首次在人类晚期心衰患者中证实 EHM 的心肌再生效果 ,患者病情稳定且无严重副作用,验证 “从恒河猴到人类” 的转化可行性,直接支持 BioVAT-HF Phase 1/2 临床试验进一步推进,为晚期心衰再生治疗开辟新路径。
这项研究不仅解决了心肌再生领域 “留存 - 疗效 - 安全” 的三角难题,更搭建了从基础研究到临床应用的关键桥梁。未来,随着低免疫原性 EHM 构建、3D 打印 EHM 等技术的发展,心衰的 “再生治疗” 有望从临床试验走向常规临床应用,为千万心衰患者带来新希望。
源井生物提供的支持
源井生物依托自身丰富的细胞培养经验和成熟的培养平台,开辟了干细胞分化相关研究的产品与服务,已成功推出 EZ-Stem™早期三胚层诱导试剂盒(#YD-T-001) 、EZ-Stem™ 定形内胚层诱导试剂盒(#YD-DE-001)和 EZ-Stem™ 心肌分化试剂盒(YD-CM-001)等定向分化相关产品 ,助力干细胞分化能力鉴定、疾病模型构建、心脏发育与心血管疾病机制及药物筛选等研究。如果您想要指定分化的细胞类型,我们还提供神经元、心肌细胞、肝细胞等多种类型的 定向分化服务 ,满足不同领域的需求。
参考文献
Jebran AF, Seidler T, Tiburcy M, Daskalaki M, Kutschka I, Fujita B, Ensminger S, Bremmer F, Moussavi A, Yang H, Qin X, Mißbach S, Drummer C, Baraki H, Boretius S, Hasenauer C, Nette T, Kowallick J, Ritter CO, Lotz J, Didié M, Mietsch M, Meyer T, Kensah G, Krüger D, Sakib MS, Kaurani L, Fischer A, Dressel R, Rodriguez-Polo I, Stauske M, Diecke S, Maetz-Rensing K, Gruber-Dujardin E, Bleyer M, Petersen B, Roos C, Zhang L, Walter L, Kaulfuß S, Yigit G, Wollnik B, Levent E, Roshani B, Stahl-Henning C, Ströbel P, Legler T, Riggert J, Hellenkamp K, Voigt JU,
Hasenfuß G, Hinkel R, Wu JC, Behr R, Zimmermann WH.
Engineered heart muscle allografts for heart repair in primates and humans. Nature. 2025 Mar;639(8054):503-511. doi: 10.1038/s41586-024-08463-0.
Epub 2025 Jan 29. PMID: 39880949; PMCID: PMC11903342.











