Hela基因敲除细胞:基因功能研究的“经典模型”


Hela基因敲除细胞:基因功能研究的“经典模型”
在生命科学研究的漫长历程中,有一种细胞系如同 “不朽的传奇”,自诞生以来便持续推动着医学与生物学的突破,它就是 HeLa 细胞。1952 年,源自一位宫颈癌患者海瑞塔・拉克斯(Henrietta Lacks)的 HeLa 细胞,首次展现出无限增殖的特性,打破了人体细胞在体外培养中 “短命” 的局限,成为首个可无限传代的人类细胞系。从脊髓灰质炎疫苗的研发,到癌症治疗方案的探索,HeLa 细胞始终是科研人员手中的重要工具。
随着基因编辑技术,尤其是 CRISPR/Cas9 技术的兴起,科研人员得以对 HeLa 细胞进行精准的基因敲除操作,赋予了这一 “经典模型” 全新的研究价值。基因敲除 HeLa 细胞系不仅能更深入地解析基因功能、揭示疾病发生机制,还为药物研发提供了高效的实验平台,成为连接基础研究与临床应用的关键桥梁。
一、基因敲除 HeLa 细胞系的核心研究价值
自 1952 年被分离以来,HeLa 细胞凭借其独特属性成为生命科学的 “万能模型”,而基因编辑技术的介入更使其研究价值实现质的飞跃,主要体现在三大维度:
1. 解码基因功能
在 HeLa 细胞中敲除目标基因后,研究人员可通过对比细胞形态、增殖速率、信号通路变化等表型差异,明确基因的生物学角色。例如 DNA 损伤修复相关基因的敲除,能直观展现细胞应对遗传物质损伤时的应激缺陷,这类研究为破解生命活动的分子机制提供了关键线索。
2. 探索疾病机制
在癌症领域,它可模拟肿瘤发生中的基因异常,揭示恶性增殖、侵袭转移的内在逻辑;在传染病研究中,通过敲除病毒入侵相关基因,能明确病原体感染的关键受体与信号通路。新冠疫情期间,科学家利用 HeLa 细胞敲除实验,快速锁定 SARS-CoV-2 病毒进入人体细胞的受体,加速了基础研究进程。
3. 助力药物研发
通过构建与疾病相关的基因敲除模型,可筛选出针对特定靶点的候选药物,并评估其疗效与安全性。同时,对比药物在正常与基因敲除 HeLa 细胞中的反应,能清晰解析药物的作用靶点与耐药机制,为临床用药提供科学依据。
二、基因敲除 HeLa 细胞客户研究案例分享
源井生物已为多个科研团队完成基因敲除细胞系的构建,助力科研项目取得突破,以下通过两个典型案例,展现其在不同研究领域的应用价值:
1.IF=6.9|TBK1 敲除 HeLa 细胞系在 TBK1 介导的 I 型干扰素反应研究中的贡献
DOI:https://doi.org/10.1016/j.celrep.2025.116336
研究背景
TBK1 是启动抗病毒先天免疫反应的核心激酶,其异常激活会导致 I 型干扰素(IFN-I)过量产生,引发过度炎症反应。衣康酸(ITA)及其衍生物被推测通过靶向 TBK1 调控免疫反应,但需排除药物非特异性作用,且 TBK1 关键修饰位点的功能尚未明确,需基因层面验证。 源井生物提供的TBK1 KO HeLa细胞助力研究揭示 TBK1 在 IFN-I 反应中的作用及衣康酸的调控机制。
实验设计
研究者采用 CRISPR-Cas9 技术构建 TBK1 基因敲除(TBK1 KO)HeLa 细胞系,以野生型(WT)HeLa 细胞为对照,通过转染 TBK1 野生型(WT)或突变体(如 C605S)质粒,结合衣康酸(ITA)、4 - 辛基衣康酸(4-OI)等处理,运用荧光素酶报告基因检测、qPCR、Western blot 及激酶活性分析,探究 TBK1 在 IFN-I 反应中的作用及衣康酸的调控机制。
结果
● 验证 TBK1 对 IFN-β 产生的必要性
TBK1 KO HeLa 细胞中转染 WT-TBK1 质粒后,IFN-β 报告基因活性及 IFNB mRNA 表达显著升高,而未转染或转染空载体时 IFN-β 产生受抑,证实 TBK1 是 IFN-I 反应的关键调控因子。
● 明确 TBK1 的关键修饰位点功能
转染 TBK1 C605S 突变体(半胱氨酸 605 突变为丝氨酸)的 TBK1 KO HeLa 细胞,衣康酸介导的 TBK1 烷基化作用显著减弱,TBK1 二聚化及磷酸化水平降低,IFN-β 报告基因活性被抑制,且衣康酸对 IFN-β 产生的抑制效应完全逆转,证实 Cys605 是衣康酸介导 TBK1 烷基化的关键位点。
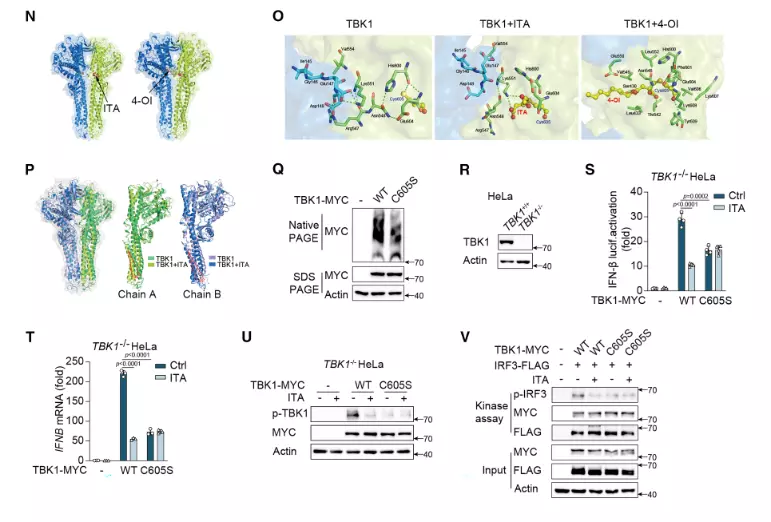
图1. 验证 TBK1 是 ITA 调控 I 型干扰素(IFN-I)通路的必需靶点
● 佐证药物作用的特异性
TBK1 KO HeLa 细胞中,衣康酸、4-OI 无法抑制 IFN-β 产生及 TBK1 磷酸化,而转染 WT-TBK1 后药物抑制效应恢复,排除了药物对其他信号通路的非特异性干扰,确认药物通过靶向 TBK1 发挥作用。
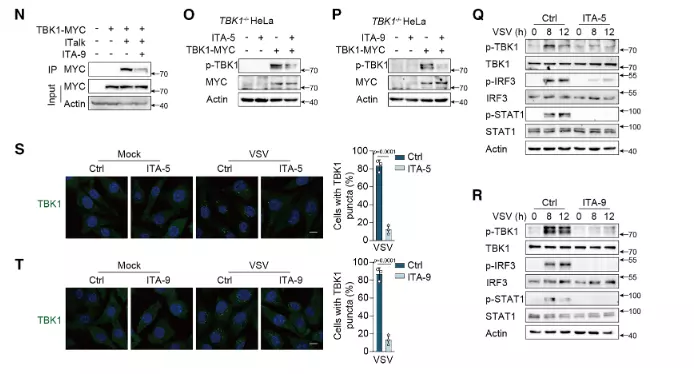
图2. 验证新型 TBK1 抑制剂(ITA-5/ITA-9)的靶向作用
2.IF=26.8|LDL-R敲除 HeLa 细胞系在肽两亲物(PA)肿瘤靶向机制研究中的贡献
DOI:https://doi.org/10.1002/adma.202509359
研究背景
肽两亲物 SA-E 可通过与血液中脂蛋白(如 HDL)结合延长循环时间,进而靶向肿瘤,但不清楚其细胞内化是否依赖脂蛋白受体(如低密度脂蛋白受体 LDL-R)。需排除受体介导的摄取机制,明确 SA-E 的肿瘤靶向是否具有受体非依赖性,为其作为通用肿瘤成像和治疗平台提供依据。源井生物构建的LDL-R KO HeLa细胞为研究PA与内源性脂蛋白结合作用研究提供了核心细胞工具。
实验设计
研究者采用 CRISPR-Cas9 技术构建 LDL-R 基因敲除(LDL-R⁻/⁻)HeLa 细胞系,以野生型(WT)HeLa 细胞为对照,通过 Cy5 标记的 SA-E 进行细胞摄取实验,结合荧光显微镜成像定量分析;同时将两种细胞分别皮下接种于裸鼠,构建肿瘤模型,静脉注射 ICG 标记的 SA-E 后,通过 IVIS 成像检测肿瘤部位的荧光强度,对比两者的肿瘤积累能力。
结果
● 验证 SA-E 细胞内化不依赖 LDL-R
LDL-R⁻/⁻ HeLa 细胞对 SA-E 的摄取量与 WT HeLa 细胞无显著差异,表明 SA-E 通过细胞膜胆固醇富集的脂筏区域结合内化,无需 LDL-R 介导,证实其细胞摄取的受体非依赖性。
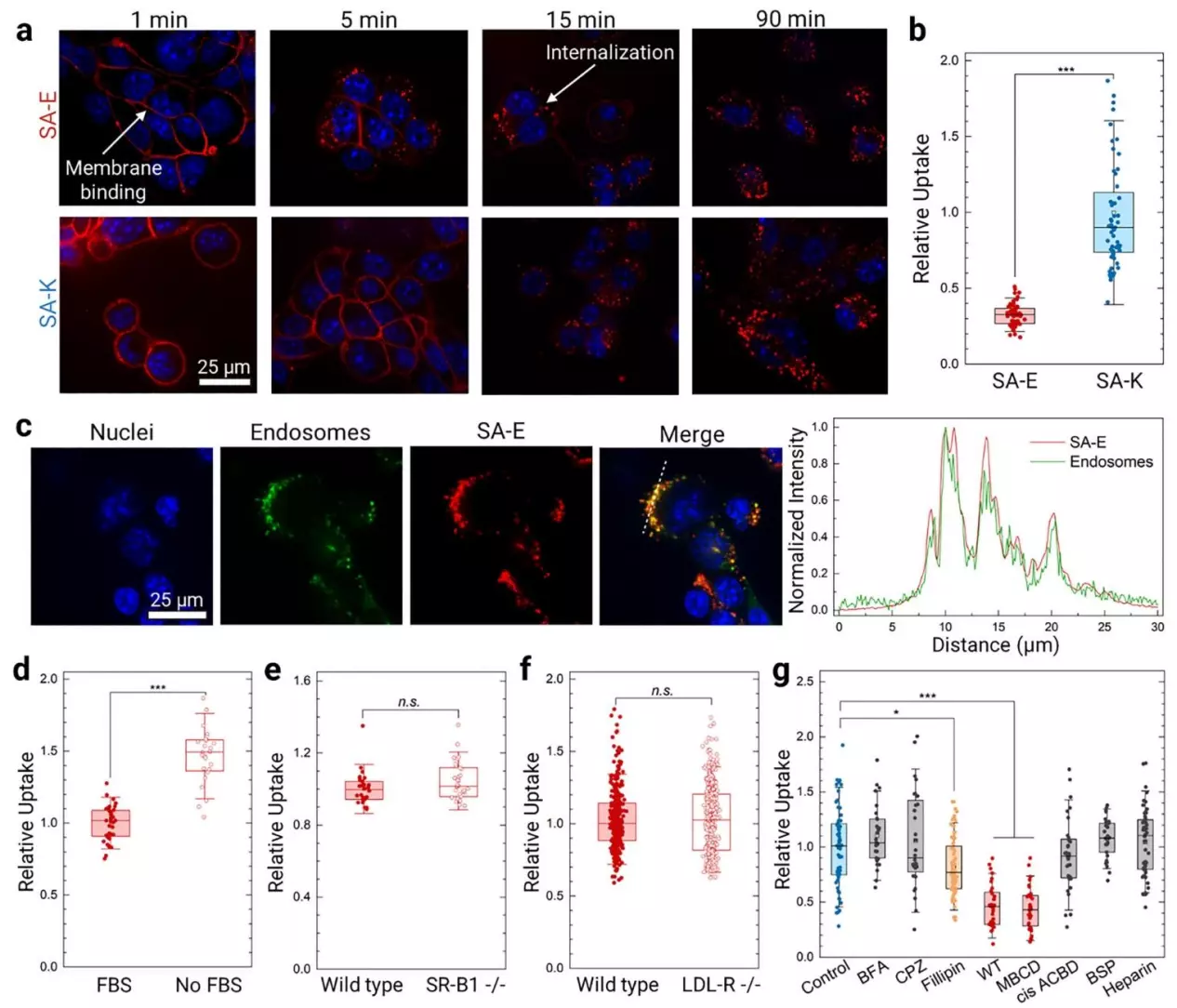
图3. 验证 SA-E 细胞内化不依赖 LDL-R
● 证实肿瘤靶向的通用性
LDL-R⁻/⁻ HeLa 细胞形成的肿瘤与 WT HeLa 细胞肿瘤相比,SA-E 的肿瘤积累水平无显著差异,且均呈现强荧光信号,说明即使肿瘤细胞缺乏 LDL-R,SA-E 仍能有效靶向肿瘤,进一步支持其通过脂蛋白“搭便车”及细胞膜脂筏结合的通用靶向机制。
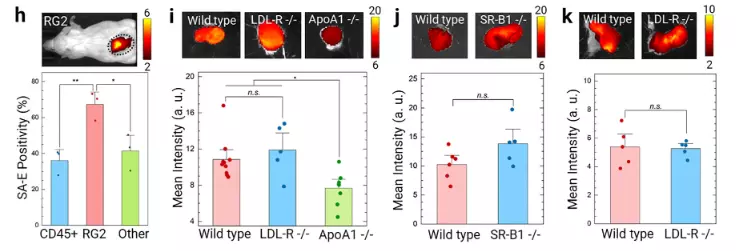
图4. 验证 SA-E 的肿瘤靶向不依赖肿瘤细胞 LDL-R 表达
● 支撑 SA-E 的广谱应用潜力
该结果与 SR-B1 敲除细胞、脂蛋白受体敲除小鼠的实验结果一致,共同证明 SA-E 的肿瘤靶向不依赖特定脂蛋白受体,为其应用于不同受体表达状态的实体肿瘤提供了关键证据。
三、源井生物基因敲除细胞
源井生物深耕基因编辑领域多年,积累了丰富的技术经验,目前已拥有超 8000 例基因敲除细胞案例,覆盖肿瘤细胞、永生化细胞系、iPS 等 300 多种细胞类型。依托自主研发的红棉・基因编辑系统,可提供三类标准敲除方案,并根据客户科研目标进行定制化调整;同时配套 RNP 法、质粒法、病毒法三种编辑方案,可根据您的具体需求匹配最优方案。
研究同款基因敲除Hela细胞
更多热门研究靶点
参考文献
[1]Chai L, Li C, Wang X, Qin Y, Sun H, Du J, Yang L, Hu D, Xiong J, Zhao Z, Gong R, Wu T, Wu M, Nie M, Gao J, Jia J, Gao C, Zhao W, Zhou H, Kang D, Jia M. IRG1 catalyzed energy metabolite itaconic acid restrains type I interferon-dependent immune responses by alkylation of TBK1. Cell Rep. 2025 Oct 28;44(10):116336. doi: 10.1016/j.celrep.2025.116336. Epub 2025 Sep 26. PMID: 41014555.
[2]Xiang L, Stewart MR, Mooney K, Dai M, Drennan S, Holland S, Quentel A, Sabuncu S, Kingston BR, J Dengos I, Bonic K, Goncalves F, Yi X, Henderson MI, Ranganathan S, Branchaud BP, Muldoon LL, Jr RFB, Fischer JM, Yildirim A. Peptide Amphiphiles Hitchhike on Endogenous Biomolecules for Enhanced Cancer Imaging and Therapy. Adv Mater. 2025 Oct 4:e09359. doi: 10.1002/adma.202509359. Epub ahead of print. PMID: 41045193.











