干货|基因编辑小白也能上手的HeLa细胞来啦

干货|基因编辑小白也能上手的HeLa细胞来啦!

细胞干货系列又和大家见面啦!前几期,我们与大家探讨了难度较高的THP-1细胞基因编辑技巧,大家是不是收获满满呢?这一期,我们将带来对小白超级友好的HeLa细胞干货。该细胞系不但容易培养,而且各种转染方法均可适用,基因编辑的效率还很高。
说起HeLa细胞,它们不仅是细胞界的明星,更是科学研究的得力助手。据PubMed网站显示,与HeLa细胞相关的科学论文已超过120,000篇,甚至在多个领域助力科学家斩获诺贝尔奖。经基因编辑的HeLa细胞系可用于研究癌症,癌症治疗,细胞死亡,信号通路等领域。小源为大家精心准备了HeLa细胞培养与基因编辑干货,感兴趣的话一起来看看吧!
细胞信息:
细胞名称 | HeLa(人宫颈癌细胞) |
细胞形态 | 上皮样,贴壁生长 |
细胞培养条件 | DMEM+10%FBS+1%P/S |
气相 | 空气,95%;CO2,5%; |
温度 | 37℃ |
换液频次 | 2-3次/周 |
传代比例 | 1:2-1:5 |
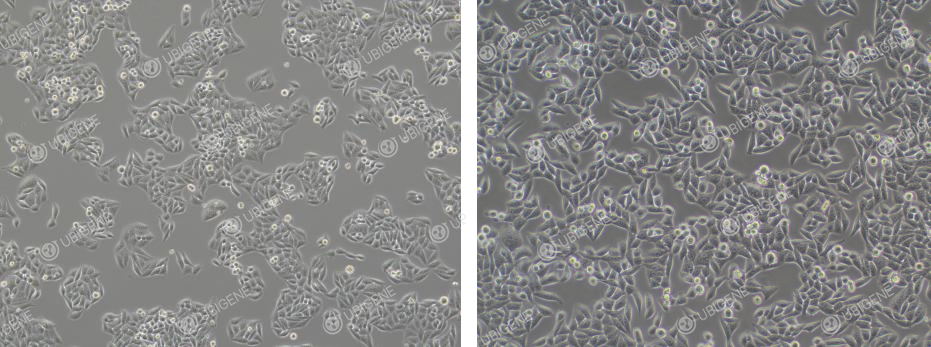
细胞生长正常图片(细胞呈椭圆形或梭形均为正常)
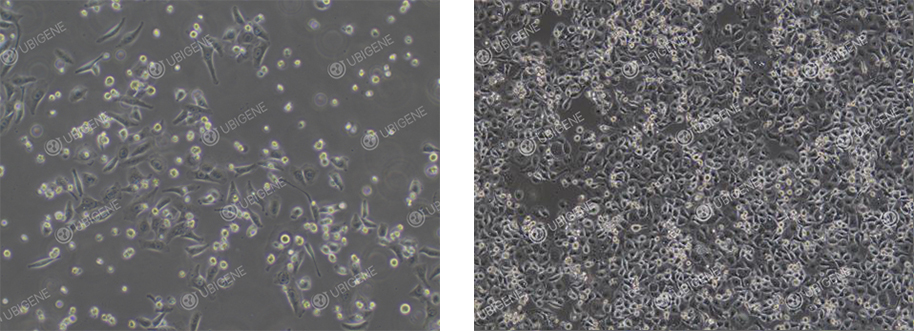
细胞生长状态差图片
HeLa细胞基因编辑Tips
HeLa细胞转染时注意事项:
1. 确保细胞状态良好,细胞处于对数生长期,细胞密度一般处在80%-90%。
2. 注意细胞消化时间,避免过度消化,对细胞造成伤害。
3. 实验过程中细胞要吹打成单细胞,避免细胞聚团。
4. 细胞进行实验时活率≥80%。
5. 对于转染试剂使用前需要充分混匀保证其均匀性。
6. 常见转染方法(电转法、脂质体法、慢病毒法),要注意的细节:
电转法:
1.电转法进行实验时控制好电转细胞量,电转后接种到合适的培养皿里。
2.用电转法进行实验时要保证电转后细胞贴壁率≥70%。
3.用电转法进行转染时需控制好实验时间,电转全程不宜过长。
脂质体法:
1.脂质体法进行实验时要控制好感染前的细胞汇合度,不可过高。
2.选用脂质体法进行正式实验前可进行预实验,筛选出合适的转染体系。
慢病毒法:
1.慢病毒法进行实验时要控制好感染前的细胞汇合度,不可过高。
2.选用病毒法进行正式实验前可进行预实验找到最合适的MOI;感染前添加助染剂Polybrene。
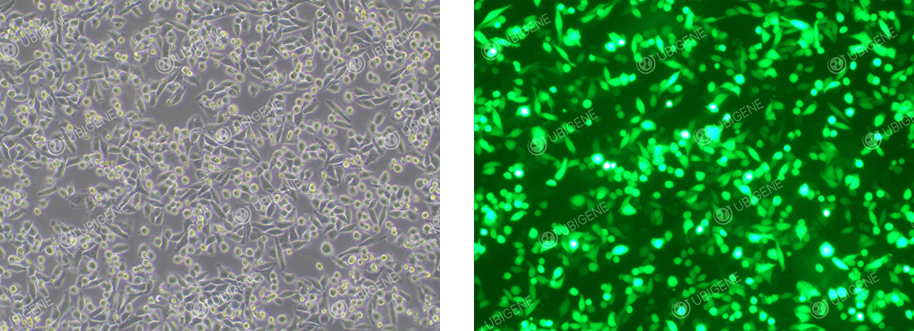
电转荧光图
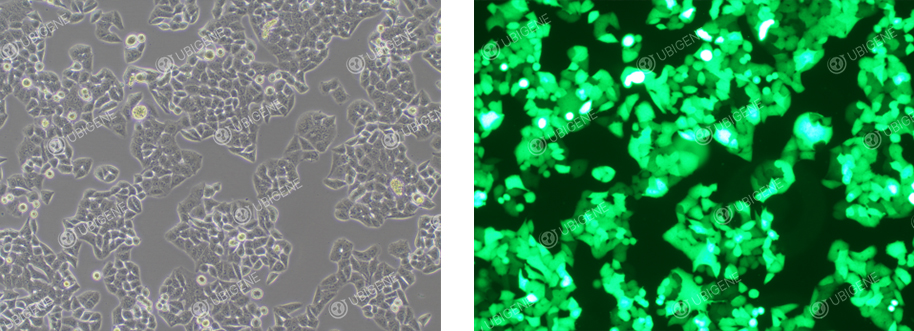
慢病毒感染荧光图
HeLa铺单克隆实验注意事项:
1. 确保铺克隆实验前细胞状态正常,建议控制细胞汇合度在70%-80%之间。
2. 铺克隆时细胞活率≥90%。
3. 可先进行预实验找到合适的铺克隆梯度,避免单克隆占比太低。
4. 稀释细胞计数后结果最好落在1*10^6-2*10^6个/mL之间。
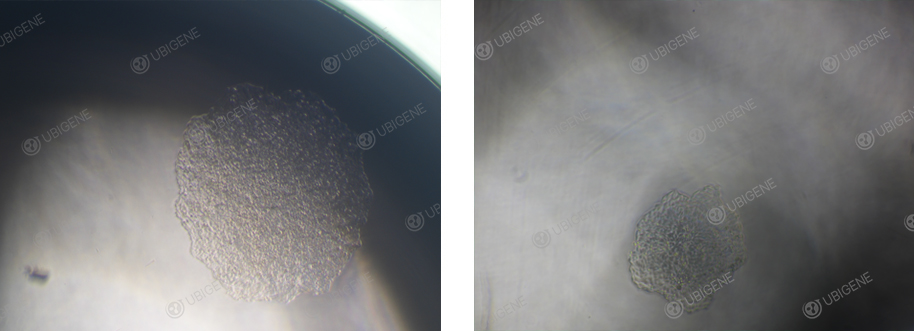
HeLa细胞单克隆
HeLa 细胞培养教程
细胞复苏
1) 准备工作:准备好所要复苏的细胞;预热水浴锅至37℃;预热完全培养基
2) 超净台内吸取 7 mL 已预热好的完全培养基至 15 mL 离心管备用
3) 将细胞从干冰里取出,用镊子夹住盖子放入 37℃水浴中快速晃动(注意:水不能没过盖子),使其在 1 分钟左右完全融化
4) 用单道移液器将细胞悬液转至步骤2)提前准备好的15ml离心管中,1100 rpm 室温离心 4 分钟
5) 同时准备一个新的T25培养瓶,加入4mL完全培养基
6) 离心结束,弃去上清,加入1mL新鲜完全培养基重悬细胞后加入到步骤5)的培养瓶里,放入培养箱培养
7) 第二天观察细胞状态及贴壁情况
细胞传代(以T25瓶为例):
1) 当细胞汇合度达到80%-90%时可进行传代,传代时在超净台内弃去培养瓶里的培养液,加入5mLPBS洗涤细胞1-2次
2) 加入1mL胰酶,轻轻晃动瓶子并使胰酶完全浸过细胞,将培养瓶放入培养箱孵育 1-3 分钟,待在显微镜下观察到大部分细胞变圆变亮,轻轻晃动培养瓶两侧有大部分细胞脱落时,立即终止消化
3) 加入2倍胰酶体积即2mL完全培养基终止消化,然后转移至15mL离心管中
4) 1100 rpm 室温离心 4 分钟,离心结束,弃去上清,加入完全培养基重悬细胞
5) 细胞按照1:2-1:5比例传代,传代第二天观察细胞状态
细胞冻存:
1) 按细胞传代的方法,在超净台内把培养瓶里的细胞进行消化至单细胞悬液,所有液体转移到离心管中
2) 用移液管吹打混合均匀,取 20 μL 进行细胞计数
3) 1100 rpm 室温离心 4 分钟,离心结束弃去上清,用 1~2 mL 4℃预冷的冻存液重悬细胞,随后加入冻存液调整至密度为 1*10^6个细胞/mL
4) 将细胞悬液按 1 mL/管平均分装至提前贴好标签的冻存管中
5) 将冻存管放置于 4℃预冷的程序降温盒中,并在冻存结束的15分钟之内将程序降温盒放置超低温冰箱
6) 过夜后,将冻存细胞转移至液氮罐内保存
HeLa细胞培养小Tips
细胞状态差如何调整:
1. 培养基和血清:确保使用正确的基础培养基和加入适量血清,血清浓度可根据细胞状态适当调整。
2. 细胞培养环境:确认培养温度、湿度、气相条件是否正常
3. 避免使用过期或长时间存放的培养基,新鲜配制的完全培养基建议在两周内使用完毕。
4. 细胞传代、换液操作:细胞传代时,注意消化时间和胰酶浓度,避免因消化时间过长或过短导致的细胞损伤;一般每周进行2-3次换液,避免长时间不进行换液处理。
5. 若细胞状态差时且细胞密度低,可重新消化细胞接种至更小的培养皿里,使细胞密度达到70%以上,细胞密度大,细胞分泌的细胞因子多,有利于细胞增殖。
红棉 ·万象全品类细胞库,超5000种细胞随心选。KO细胞、Luc细胞、Cas9细胞、EGFP细胞、野生型细胞应有尽有,选你所想。免费提供细胞STR鉴定报告,全程技术指导。找细胞,上万象!










