IF=19.8 | 源井助力发现GPNMB通过抑制SNARE复合体的组装促进胞内菌的存活增殖


引言
异源自噬(Xenophagy)在抑制巨噬细胞内细菌增殖中发挥着关键作用,但在细菌感染中自噬体与溶酶体融合的调控机制尚未完全明确。
2025年3月4日,Zhenzhen Yan等人在Cellular&Molecular Immunology(CMI)发表题为“GPNMB disrupts SNARE complex assembly to maintain bacterial proliferation within macrophages”的研究论著,揭示了感染过程中GPNMB通过阻断SNARE复合体组装,促进胞内菌在巨噬细胞中存活增殖的新机制。 研究中的关键敲除细胞GPNMB Knockout cell line (THP-1)由源井生物提供。

研究背景
麻风是由麻风分枝杆菌(Mycobacterium leprae,M. leprae)感染引起的慢性传染病。巨噬细胞作为M. leprae感染寄生的主要细胞,其功能受损是M. leprae在胞内存活增殖的重要原因。但调控M. leprae免疫逃逸的分子机制目前仍不清晰。
在微生物感染过程中,细胞自噬作为机体免疫系统的重要组分,参与对病原体的杀伤。病原体通过适应或逆转宿主的自噬机制,可造成宿主的持续性感染,甚至引起细胞死亡。既往研究表明灭活的M. leprae可以诱导人的单核细胞发生自噬,但活的M. leprae能够抑制该过程。由此可见,抑制细胞自噬是M. leprae免疫逃逸的重要途径,但具体机制尚不清晰。
研究目的
- 明确 GPNMB 在胞内细菌感染中的作用,解释其与瘤型麻风(L-Lep)患者免疫低下、细菌增殖的关联。
- 揭示 GPNMB 调控宿主抗细菌免疫的分子机制,重点探究其对自噬通路及 SNARE 复合体组装的影响。
- 验证 GPNMB 作为胞内细菌感染相关疾病潜在治疗靶点的可行性。
研究方法
临床样本分析: 检测麻风病患者(L-Lep/T-Lep)皮肤组织 GPNMB 表达(mIHC)、血清可溶性 GPNMB 水平(ELISA),结合数据库数据验证表达差异。
细胞实验: 采用 THP-1(野生型 / GPNMB 敲除型)、HEK293T 等细胞,通过质粒过表达、siRNA 干扰调控基因表达;利用 Co-IP 验证蛋白相互作用,Western blot 检测关键蛋白(LC3、p62、SNAP29 等)表达,免疫荧光观察自噬体 - 溶酶体共定位;构建多种胞内细菌感染模型,检测细胞因子分泌(qPCR/ELISA)和细菌载量。
动物实验: 利用 Gpnmb 条件性敲除小鼠(Gpnmbfl/fl Lyz2-Cre)和野生型小鼠,建立海分枝杆菌感染模型,检测体内细菌载量、组织损伤及细胞因子水平。
分子机制验证: 构建 STX17 截短突变体、GPNMB 糖基化位点突变体,结合 GFP-mCherry-LC3 双荧光系统,明确蛋白结合结构域及修饰对功能的影响。
研究路线
临床关联分析: 发现 L-Lep 患者 GPNMB 高表达与免疫弱、细菌载量高的关联,提出科学问题。
细胞功能验证: 对比 GPNMB 敲除 / 过表达细胞与对照细胞,明确其对免疫应答、细菌增殖及自噬流的影响,定位作用环节为自噬体 - 溶酶体融合。
分子机制探究: 筛选并验证 GPNMB 与 STX17 的特异性结合,阐明其通过诱导自身去糖基化、促进 SNAP29 降解,阻断 SNARE 复合体组装的分子路径。
体内验证: 通过小鼠感染模型,确认 GPNMB 敲除对体内细菌清除、免疫应答的正向作用,验证细胞实验机制。
结论整合: 构建 GPNMB 调控胞内细菌感染的完整通路,明确其作为治疗靶点的潜力。
研究亮点
1. GPNMB在瘤型麻风中高表达
本研究中,作者对比了瘤型麻风(L-Lep,免疫反应弱,菌载量高)与结核样型麻风(T-Lep,免疫反应强,菌载量低)患者皮肤与血液中GPNMB的含量,发现瘤型麻风患者GPNMB的含量显著多于T-Lep,提示其与M. leprae的免疫逃逸相关。
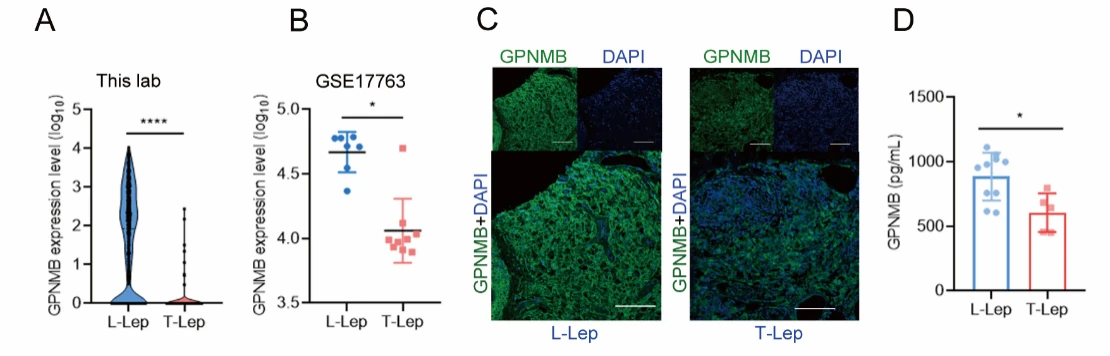
图1.瘤型麻风患者GPNMB的含量显著多于T-Lep
2. GPNMB促进胞内菌存活
为了验证GPNMB的功能,作者利用siRNA敲低了巨噬细胞中GPNMB的表达,发现GPNMB表达量低的细胞中,胞内菌的含量显著提高。同时,作者利用海分枝杆菌感染小鼠后发现,GPNMB敲除小鼠中,各脏器中的菌载量显著增多。以上结果说明,GPNMB能够促进胞内菌的存活。
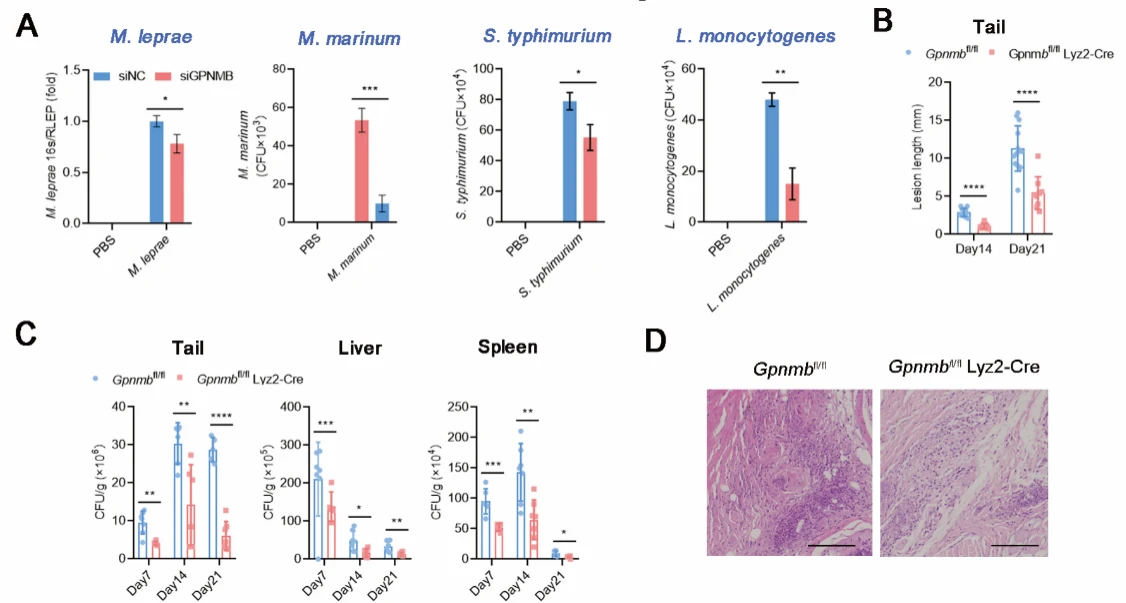
图2.GPNMB能够促进胞内菌的存活
3. GPNMB抑制细胞自噬
为了阐明GPNMB的作用机制,作者检测了GPNMB的细胞定位,发现细菌感染过程中,GPNMB与自噬小体的标志物LC3及p62有明确的共定位。敲除GPNMB的细胞中LC3及p62的含量均显著降低,提示GPNMB破坏了细胞自噬。
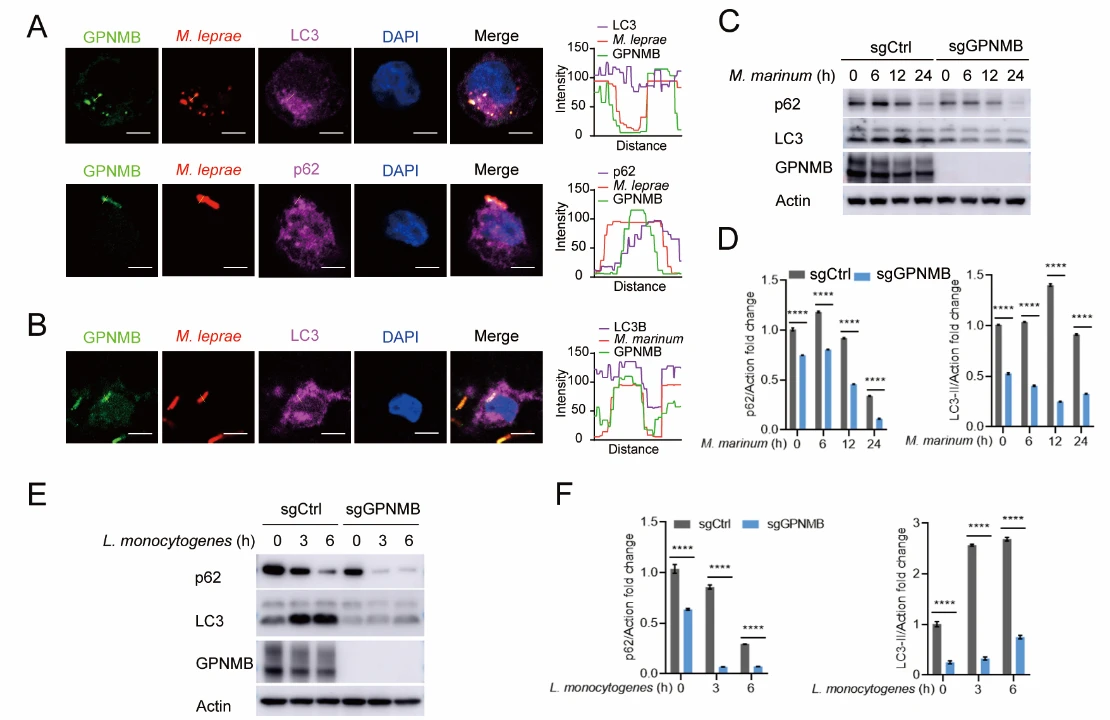
图3. GPNMB抑制细胞自噬
4. GPNMB抑制自噬体与溶酶体融合
为了探究GPNMB对细胞自噬的作用机制,作者进行了一系列探索。发现GPNMB能够抑制自噬体与溶酶体融合。
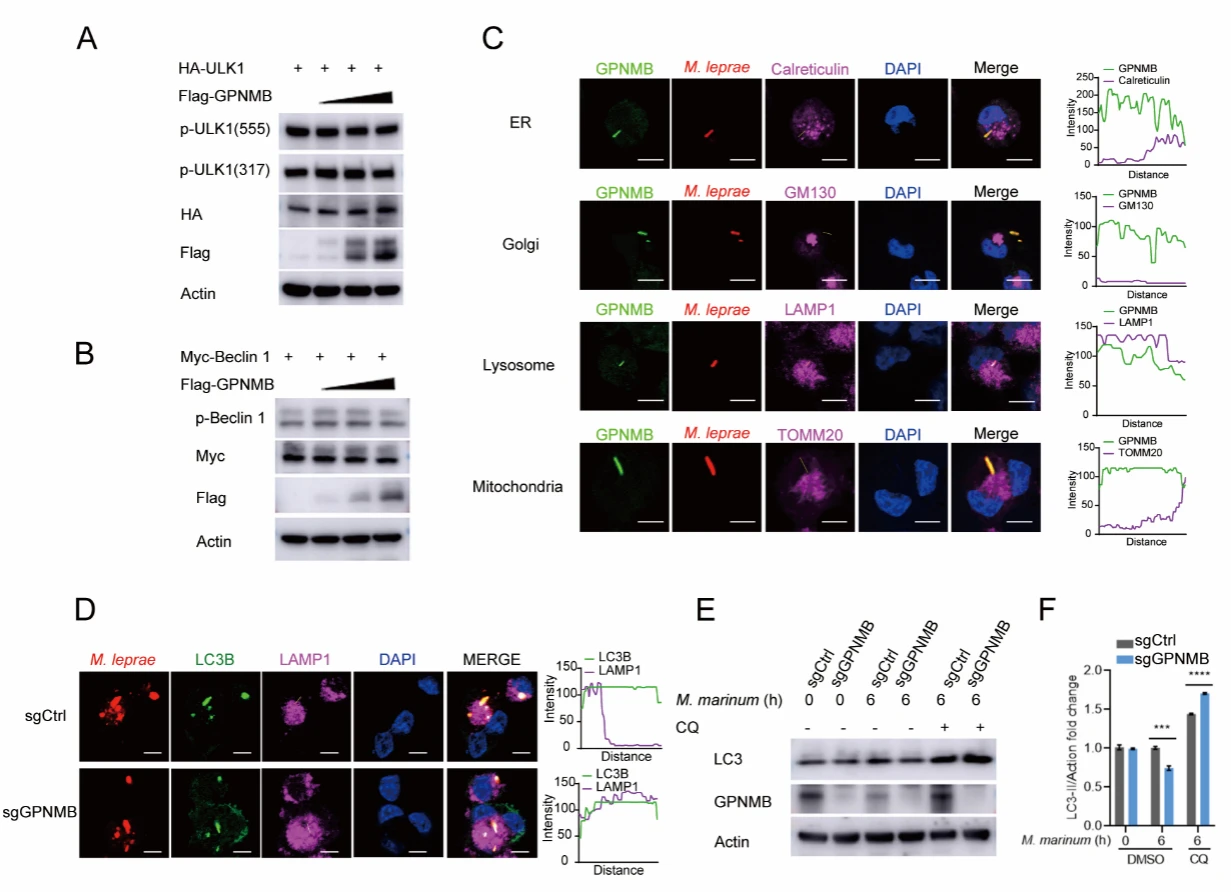
图4. GPNMB抑制自噬体与溶酶体融合
5. GPNMB靶向STX17
紧接着,作者筛选了GPNMB的作用靶点,发现其与溶酶体定位蛋白STX17存在明显的结合作用。并且STX17的膜定位结构域对两者的结合是至关重要的。
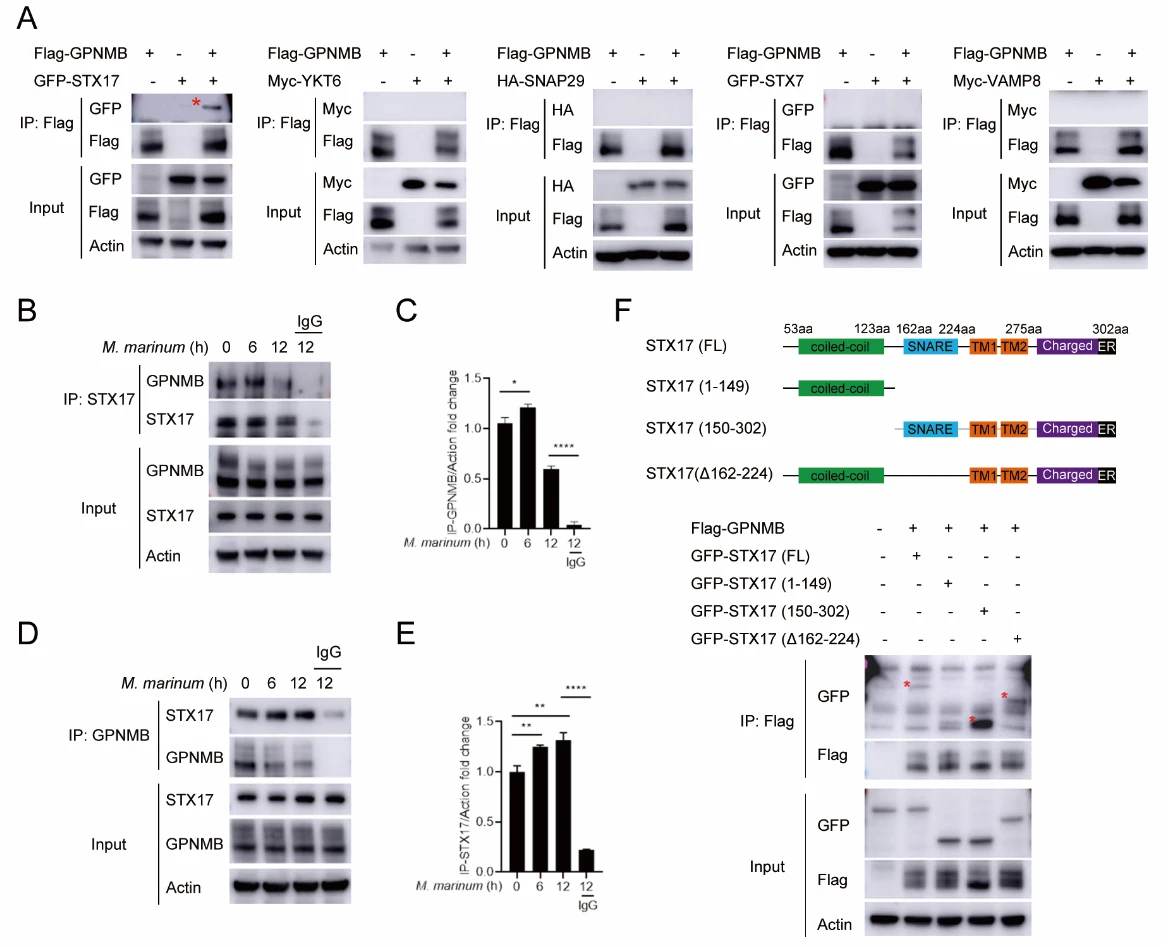
图5. GPNMB靶向STX17
6. GPNMB抑制STX17与SNAP29的结合
STX17是STX17-SNAP29-VAMP8 SNARE复合体的重要组成成分。该复合体介导自噬体与溶酶体融合。作者发现,GPNMB能够抑制STX17与SNAP29的结合。
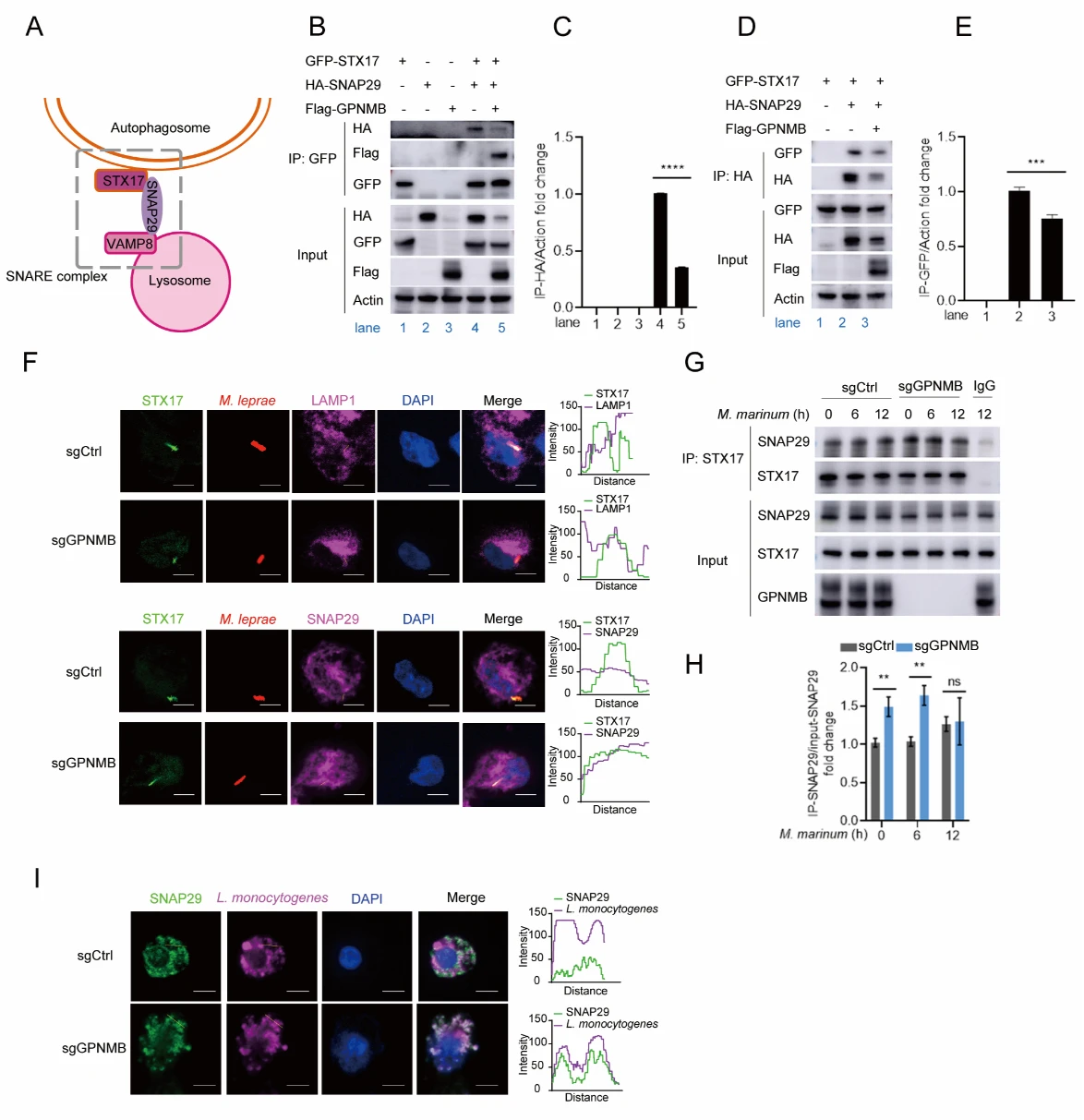
图6. GPNMB抑制STX17与SNAP29的结合
研究意义与创新点
- 首次明确 GPNMB 通过特异性结合 STX17、诱导自身 N296 位点去糖基化以促进 SNAP29 降解,进而阻断 STX17-SNAP29-VAMP8 SNARE 复合体组装,抑制自噬体 - 溶酶体融合,最终削弱宿主抗菌免疫、促进胞内细菌增殖;
- 不仅填补了 GPNMB 在胞内细菌感染中的功能空白,解析了麻风病(L-Lep)免疫低下的核心机制,还建立了 “GPNMB - 自噬调控 - 细菌存活” 的新型关联,为慢性胞内细菌感染提供了潜在治疗靶点与生物标志物;
- 研究通过 “临床样本 - 多细胞模型 - 基因敲除小鼠” 的三维验证体系,覆盖多种胞内细菌,证实结论普适性,同时明确了糖基化修饰在自噬调控中的关键作用,为相关机制研究提供了新范例。
研究结论
麻风是一个典型的胞内菌感染性疾病,一直被认为是研究宿主防御机制与细菌感染之间相互作用的理想疾病模型。本研究以麻风为模型,首次系统揭示了GPNMB在宿主抗菌防御中的新功能。研究发现细菌感染后,GPNMB被招募到自噬小体,并与自噬小体定位蛋白STX17结合,阻断STX17-SNAP29-VAMP8 SNARE复合体组装;上述过程直接破坏了自噬体与溶酶体的融合过程,抑制了细胞的自噬流,最终削弱了宿主对胞内细菌的清除能力。除麻风分枝杆菌外,GPNMB缺陷还可显著抑制多种胞内病原体(如海分枝杆菌、李斯特菌、沙门氏菌)在巨噬细胞内的增殖,提示其在胞内菌感染中的普遍调控作用。利用小鼠感染模型研究发现,与野生型相比,Gpnmbfl/fl Lyz2-Cre小鼠体内海分枝杆菌载量显著降低,进一步从体内实验证实了GPNMB在胞内菌感染中的意义。
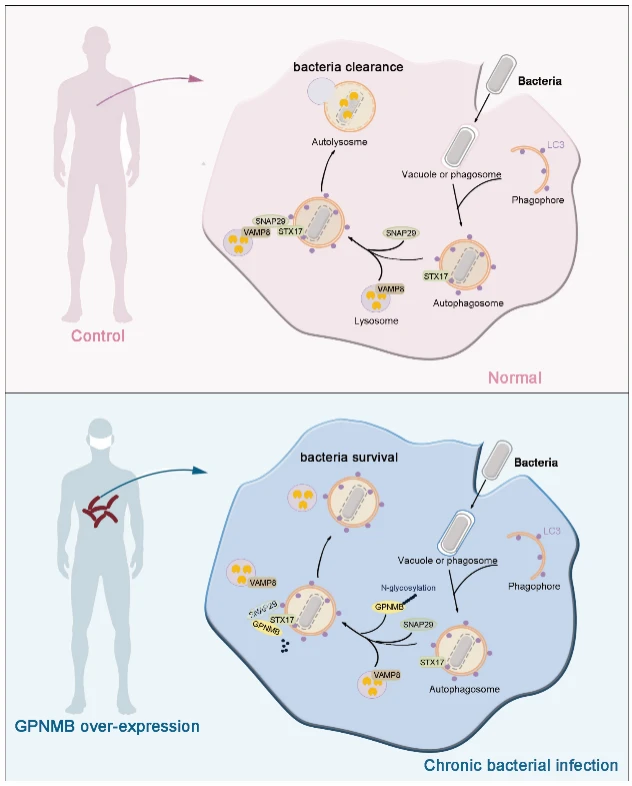
图7. 本研究机制图
该研究首次阐明了GPNMB通过调控SNARE复合体组装影响宿主杀菌的分子机制,为靶向自噬通路的抗感染治疗提供了新思路。
源井生物提供的支持
在本研究中,源井生物提供的 GPNMB Knockout cell line (THP-1) 作为 “GPNMB 缺失” 的对照模型,通过与野生型THP-1 细胞的表型对比,从 “免疫应答 - 细菌存活 - 自噬流 - 分子互作” 四个层面,层层递进地 验证了 GPNMB 调控胞内细菌感染的分子机制。
源井生物积累了丰富的基因编辑经验,拥有13000例基因编辑成功案例,覆盖各类热门研究靶点与经典细胞系,能够为您提供成熟的基因敲除解决方案。超8000种KO细胞产品,低至¥4980,进入 红棉·万象全品类细胞库 搜索您的目标细胞;若需个性化研究工具,我们的 定制化 KO 细胞构建服务 可精准匹配需求,助力您高效推进感染免疫、自噬调控等领域的科研探索。
联系我们了解更多>>>参考文献
Yan Z, Han J, Mi Z, Wang Z, Fu Y, Wang C, Dang N, Liu H, Zhang F. GPNMB disrupts SNARE complex assembly to maintain bacterial proliferation within macrophages. Cell Mol Immunol. 2025 May;22(5):512-526. doi: 10.1038/s41423-025-01272-z. Epub 2025 Mar 4. PMID: 40038549; PMCID: PMC12041529.










