基因编辑磷酸位点终极目标之一:发展基因组药学


磷酸位点基因组编辑的终极目标之一--发展基因组药学

为理解与人类疾病相关的遗传因素,人类基因组计划(HGP)和从患病个体获得的DNA序列数据为此提供了前所未有的机会。癌症中的突变可能改变许多分子活动,而其中一个分子活动就是蛋白质磷酸化。当它被改变时,可能会导致整个系统的受损和信号转导的失调。
迄今为止,已知有3000多种人类基因的改变与疾病相关。单基因疾病,例如亨廷顿氏病,囊性纤维化,地中海贫血和镰状细胞性贫血,都是由单基因突变引起的。而癌症和糖尿病等多因素疾病是由多个基因突变与环境条件之间的相互作用引起的。目前有许多已知的突变是自发的或体细胞氨基酸替换的,其中一些可能会对蛋白质功能有着巨大影响。在这些突变集合中,我们期望能观察到阻断正常分子功能的功能丧失性突变,以及功能获得性突变,也就是与正常的相比,这种影响分子功能的突变能引起失调的激活。最后,我们期望能观察到许多并不参与肿瘤发生和发展的突变。
氨基酸的丝氨酸残基(Serine),苏氨酸残基(Threonine)和酪氨酸残基(Tyrosine)的磷酸化在癌症相关蛋白中是非常常见的,并且已知在癌症中失调。众所周知,磷酸化信号传导的变化可能是由于激酶和磷酸酶功能的失调,一般是通过改变基因表达来进行检测。激酶或磷酸酶上的氨基酸替换直接破坏激酶或磷酸酶的稳定性和/或功能,导致靶磷酸化的改变。激酶或磷酸酶调节剂同样也有引起磷酸化改变的作用。磷酸化位点的破坏是与癌症相关的,例如细胞周期蛋白D1(CCND1)中T286的突变。GSK3B在细胞周期蛋白D1的野生型中对T286进行磷酸化以启动其核输出,并随后在细胞质中降解,而磷酸化的丧失与细胞周期蛋白D1在食管癌中的核积累有着因果关系,并通常会增加致癌风险。在涉及肝癌的连环蛋白β-1的另一项研究中,已知磷酸化发生在氨基酸T41和S45上,并导致显着的磷酸化丧失。因此,磷酸化靶位点突变是癌症发展的新途径。癌症中信号转导失调的机制是通过去除或产生磷酸化位点来介导的,从而导致磷酸化功能的丧失或获得,这取决于磷酸化残基的作用。我们可以发现几种富含磷酸化破坏突变的通路。值得注意的是,Wnt/β-连环蛋白通路富含磷酸化位点的获得以及丧失的活动。
磷酸化可以以各种形式影响蛋白质功能,例如增加或减少蛋白质的活性、稳定它或将其标记去被破坏、将其定位在特定的细胞区室内,并且可以启动或破坏其与其他蛋白质的相互作用。人类基因组编码的21,000种蛋白质中,超过三分之二被磷酸化,且可能有90%以上的蛋白质受到PTM的影响。因此,磷酸化活动在控制生物进程如增殖,分化和凋亡中起重要作用。蛋白质的磷酸化位点通常具有关键的调节功能,并且是许多细胞信号传导通路的核心,因此修改它们的突变有可能导致病理状态,如癌症,心血管疾病,肾脏疾病等。而磷酸化位点调节的重要性可能存在巨大差异。磷酸化位点的突变有可能通过上调或下调该位点磷酸化的化学计量来极大地影响蛋白质的结构和功能。此外,突变的磷酸化经常修改进行蛋白质-蛋白质相互作用(PPI)的成员,这种修改是许多细胞信号传导通路的核心,而另一个重要的考虑因素是破坏或改变其PPI以及整个PPI网络上磷酸化位点的影响。分子相互作用网络的研究已越来越多地应用于人类疾病,例如癌症,许多已知的癌症突变的影响可通过其对分子相互作用网络的影响来理解。
应用范围:
在系统层面上研究蛋白质磷酸化的潜在领域。
1. 基础研究:研究磷酸化调节谱(识别相关和相反信号状态的分子指纹分析)。
2. 疾病建模:使用基因处理工具构建细胞和动物的疾病模型(研究同基因背景下疾病相关基因中靶向突变的功能分析,研究疾病的病理及其发展)。
3. 基于细胞/基因的疗法:基因药物作为与缺陷基因相关的疾病可以在基因组层面上得到修正(人类治疗和细胞治疗的基因编辑)。
4. 药物发现:细胞蛋白质内的磷酸化位点及其调节作用允许使用磷酸化作为测定终点,并且获得的信息可用于药物发现和药物开发过程中的各个阶段。
基因编辑开拓了改善人类健康的新方向
CRISPR作为对基因组序列提供精确,有针对性的修改和校正的技术,基因组药学被证明具有作为针对人类疾病的治疗干预的广泛前景。此外,使用CRISPR/Cas9技术,基因组的编辑变得简单,因此可以在体内和体外更有效地制备和分析磷酸化位点的“敲入”点突变。
案例分析1:
使用CRISPR系统研究单基因肝病
威尔逊氏病(Wilson's disease, WD)作为单基因肝病是基于ATP7B基因的突变而产生的,并导致肝脏中铜(Cu)排泄的功能恶化。过量的铜积累在各种器官,例如肝脏和大脑。威尔逊氏病患者表现出临床异质性,涵盖了从急性或慢性肝衰竭到神经系统症状。通过锌或螯合剂的终生治疗可以改善病程,但是在相当一部分患者中观察到严重的副作用,例如神经功能恶化和肾毒性,因此肝移植将是不可避免的。另一种治疗方案则是ATP7B基因的基因校正。在这项研究中,研究人员使用CRISPR/Cas9基因编辑在人类细胞系中引入人工ATP7B点突变,并通过额外使用的单链寡核苷酸(ssODNs)来纠正这一突变,模拟威尔逊氏病点突变在体外的基因修正。
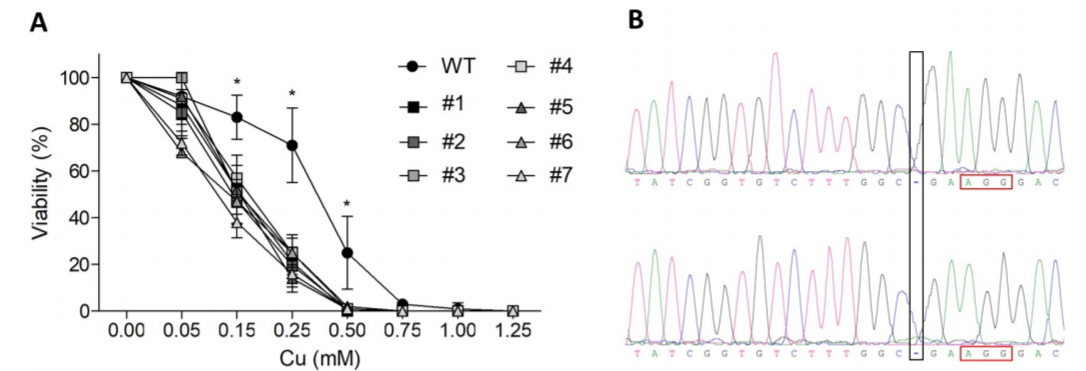
图一:ATP7B基因敲除突变体的生成
CRISPR/Cas9介导的ATP7B-KO细胞产生了铜电阻降低。用HEK239T细胞建立敲除模型并用PX459脂质体转染。用MTT法测定HEK293T细胞和KO突变体(图1A)的细胞代谢活性。Sanger测序证实HEK293T细胞克隆#1在1184位置(黑色框内标记)缺失一个胞嘧啶核苷酸,且PAM区域上游有三个核苷酸(红色框内标记)。
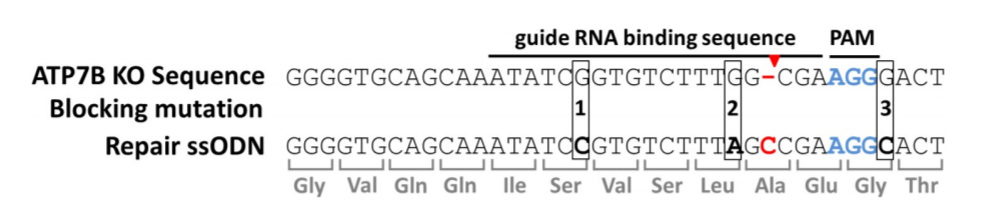
图2:CRISPR/Cas9介导的ATP7B修复方案
ATP7B敲除细胞(HEK293TΔC)表现为胞嘧啶核苷酸缺失(红色“-”标记)的点突变。Cas9在PAM区域(标蓝)上游切断三个核苷酸(红色箭头标记)。修复ssODN在位置1、2和3(ssODN_3M)或位置2和3(ssODN_2M)包含沉默阻断突变。
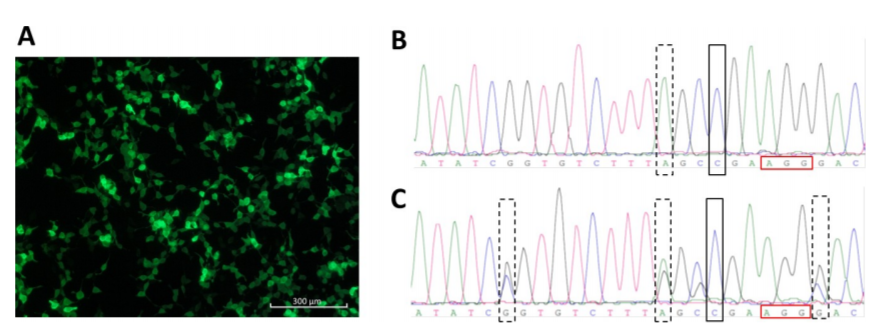
图3:CRISPR/Cas9介导的ATP7B修复方案
用pmaxGFP脂质转染HEK293TΔC细胞。GFP表达水平显示在图3A中。对携带阻断突变2号(虚线框)的ATP7B修复的纯合HEK293TΔC细胞克隆(黑色框)(图3B)和携带所有三个阻断突变(虚线框)的ATP7B修复的杂合HEK293TΔC细胞克隆(黑色框)(图3C)进行Sanger序列分析。
这些实验数据证明了CRISPR/Cas9介导的ATP7B点突变校正是可行的,并且有发展临床使用的可能。
案例分析2:
使用CRISPR/Cas9校正HCT-116细胞中的β-cateninΔTCTser45的缺失突变
结直肠癌是第三大常见癌症。CRC与Wnt/β-catenin(β-连环蛋白)信号传导通路的失调密切相关。β-catenin在Ser45被酪蛋白激酶1(CK1)磷酸化,并连续在Ser33,Ser37和Thr41被糖原合酶激酶-3β(GSK-3β)磷酸化,从而引起随后的泛素化和蛋白酶体降解。这些Ser/Thr残基的突变会改变重要的功能性磷酸化位点,抑制β-catenin磷酸化降解级联反应,并导致Wnt/β-catenin信号通路的组成性激活。因此,通过基因编辑技术校正β-catenin基因突变可以开发用于结肠癌的新一代治疗方法。
在该研究中,人结肠直肠细胞系HCT-116被选用,因为它具有β-catenin基因的杂合缺失突变(ΔTCT),其负责在蛋白质的N-末端区域编码调节性Ser45。研究人员通过基因测序证实了ΔTCTSer45缺失突变在β-连环蛋白基因的外显子3和CRISPR/Cas9 PAM位点上的位置。96 nt ssODN包含了作为HDR修复模板的野生型β-catenin基因序列。将HCT-116细胞与载体和ssODN共转染后,通过FACS筛选GFP阳性细胞并扩增,并通过TA克隆和测序计算突变校正效率。
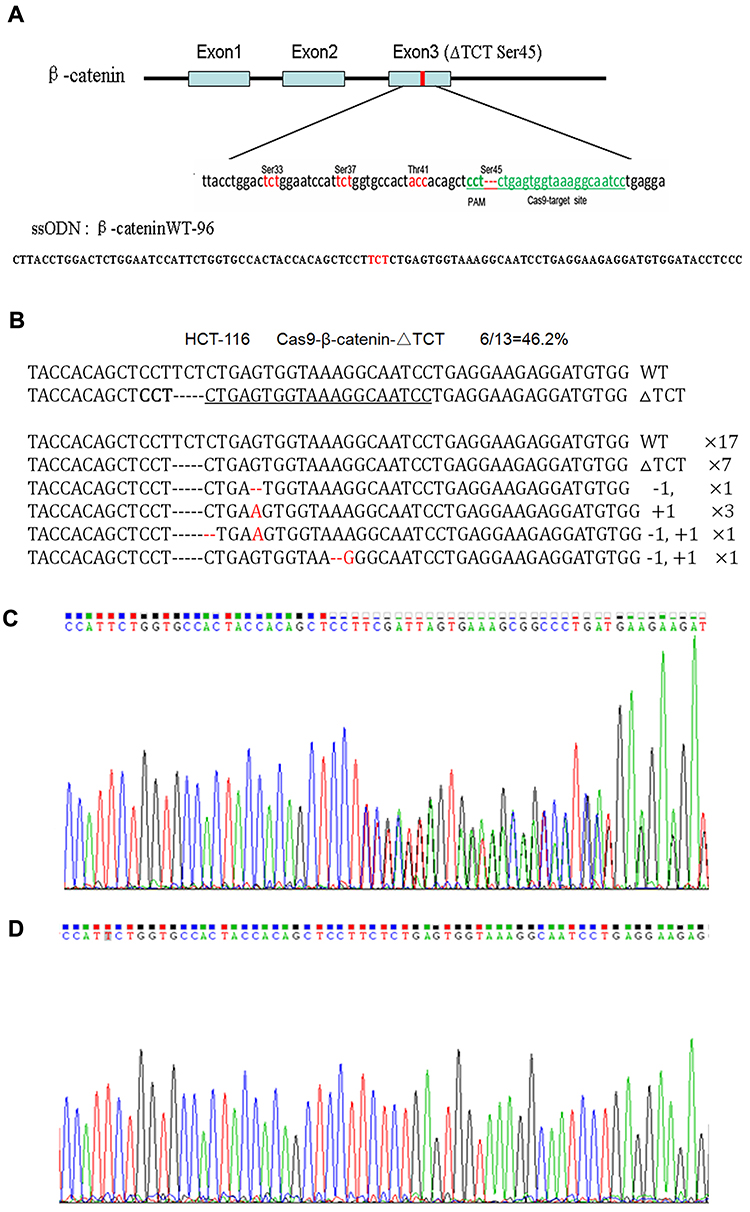
图1:HCT-116细胞中β-cateninΔTCTser45的突变校正
由于该基因的一个等位基因中的缺失突变,HCT-116细胞中β-catenin的测序图谱显示从突变基因座开始的重叠峰(图1C)。突变校正后,我们发现突变基因座中存在TCT序列,因此从突变基因座开始的重叠峰也相应消失了(图1D)。这些发现证实,用Cas9-GFP/sgRNA共表达载体和ssODN共转染可以纠正HCT-116细胞中的β-cateninΔTCTser45缺失突变。
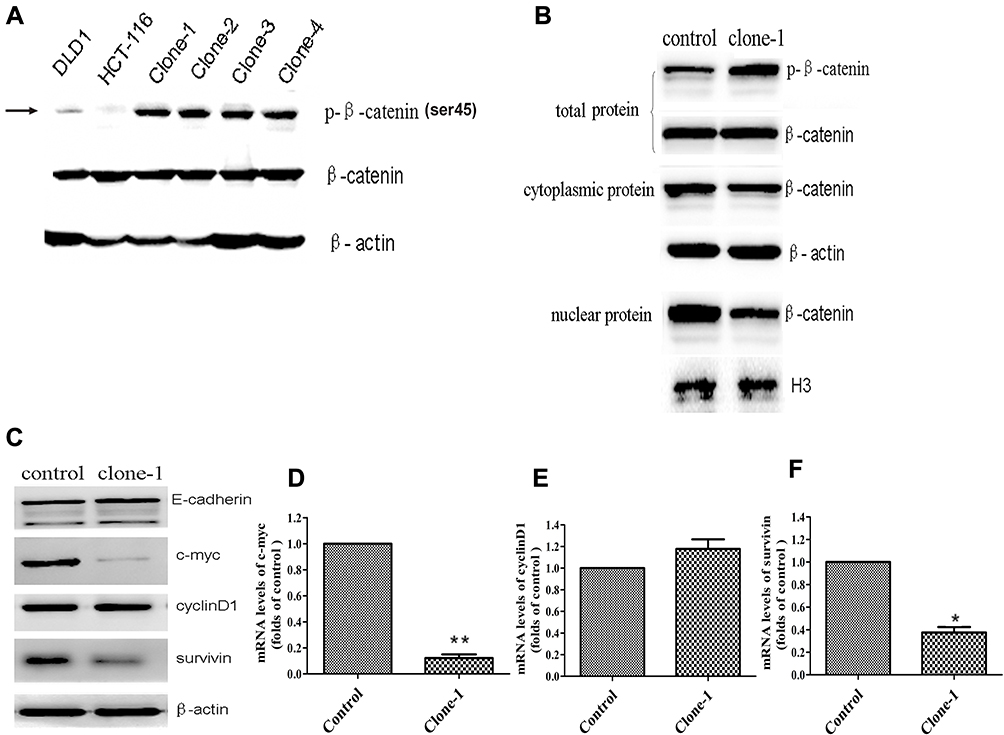
图2:β-cateninΔTCTser45突变校正的功能作用
β-catenin的Ser45是重要的磷酸化位点。ΔTCT密码子的缺失突变将对HCT-116细胞中的β-cateninSer45磷酸化产生巨大影响。因此,研究人员研究了缺失突变体和被校正突变体中β-catenin的表达水平。如预期的那样,与没有β-cateninΔTCT缺失突变的DLD1大肠癌细胞相比,未校正的HCT-116细胞具有非常弱的可检测Ser45磷酸化β-catenin表达(图2A)。他们还研究了对照组和一个突变校正的HCT-116细胞克隆中的蛋白质表达,即总体、核和细胞质的β-catenin水平(图2B)。此外,他们还比较了蛋白质的表达以及E-cadherin(E-钙粘蛋白),c-myc,cyclinD1和survivin基因(图2C,D,E和F)。
总的来说,通过CRISPR/Cas9和ssODN的组合去校正驱动突变可以极大地改进癌细胞系的生物学行为,同时也表明该方案在癌症的基因治疗中的潜在应用。
源井生物开发的CRISPR-U™优化了真核细胞和动物基因编辑载体和过程。效率和准确度比传统方法高10倍。立即联系我们了解与您研究相关的基因编辑服务!
参考文献:
1.CRISPR/Cas9-mediated correction of mutated copper transporter ATP7B. PLoS ONE Vol.15(9): e0239411. 2020.
2.Cas9 Mediated Correction of β-catenin Mutation and Restoring the Expression of Protein Phosphorylation in Colon Cancer HCT-116 Cells Decrease Cell Proliferation in vitro and Hamper Tumor Growth in Mice in vivo. Oncotargets and therapy. Vol.13.17-29.2020










