突破治疗困局!CRISPR 筛选揪出核心靶点,GSK3β 抑制剂直击 B-ALL 生存关键


引言
经典 Wnt/β- 连环蛋白通路的降解异常驱动多种肿瘤发生,但在 B 细胞急性淋巴细胞白血病(B-ALL)中的作用存在争议。Kadriye Nehir Cosgun 团队在Nature Cancer 发表的研究中,通过 CRISPR筛选 等核心技术证实,B-ALL 依赖高效 β- 连环蛋白降解生存,GSK3β 抑制剂可阻断该过程,诱导 β- 连环蛋白与 Ikaros/NuRD 复合物结合并抑制 MYC,最终杀伤肿瘤细胞,为耐药 B 细胞恶性肿瘤提供了新策略。

研究背景
急性淋巴细胞白血病是常见的血液系统恶性肿瘤,传统治疗对部分患者效果不佳,亟需新的治疗靶点和策略。经典 Wnt/β- 连环蛋白通路中,β- 连环蛋白的降解异常常驱动肿瘤发生,但 B-ALL 中该通路的作用机制尚未明确。已知 GSK3β 是 β- 连环蛋白降解的关键激酶,其抑制剂在临床中已展现良好安全性,为探索其在 B-ALL 中的治疗潜力提供了基础。
研究目的
阐明 B-ALL 中 β- 连环蛋白降解的独特作用及分子机制,验证 GSK3β 抑制剂靶向 β- 连环蛋白降解的治疗效果,为难治性 B 细胞恶性肿瘤提供新的治疗方向。
研究方法
- 实验模型: 使用小鼠和人类 B-ALL 细胞系、患者来源异种移植模型(PDX)、基因工程小鼠模型(如 Apcfl/+、Gsk3bfl/+、β-catenin (S33;S45)+/fl 等)。
- 基因编辑: 通过 CRISPR-Cas9 技术构建基因敲除 / 突变细胞系及小鼠,如 IKZF1/3 双敲除、β- 连环蛋白磷酸化位点缺失等。
- 文库选择与转导: 使用小鼠全基因组敲除 EKO sgRNA 文库,该文库覆盖 22,956 个基因,含 278,754 条 sgRNA(每基因 12 条 sgRNA)及阴性对照,通过慢病毒介导将文库转导至 NALM6 细胞,确保每个细胞随机携带 1 条 sgRNA。
- 蛋白与分子机制验证: 采用免疫共沉淀、质谱分析、Western blot 验证蛋白相互作用;通过 RNA-seq、GSEA 分析基因表达及通路变化;利用 ChIP-seq 检测染色质结合情况。
- 功能验证: 通过流式细胞术、集落形成实验、细胞活力检测评估细胞增殖与死亡;在动物模型中进行体内治疗实验,监测肿瘤负荷与生存情况。
- 药物敏感性分析: 结合公共数据库(DepMap)和临床前实验,评估 GSK3β 抑制剂的细胞选择性与治疗效果。
研究路线
- 表型验证: 明确 B-ALL 中 β- 连环蛋白表达特征及降解依赖性,对比实体瘤与 B 细胞恶性肿瘤的差异。
- 机制解析: 验证 GSK3β 介导的 β- 连环蛋白降解对 B-ALL 生存的必要性;阐明 β- 连环蛋白与 Ikaros/NuRD 复合物结合抑制 MYC 的分子机制。
- 治疗验证: 在细胞、类器官及动物模型中,评估 GSK3β 抑制剂的单药治疗效果及选择性。
- 临床转化: 结合临床样本和 PDX 模型,验证 GSK3β 抑制剂对难治性 B-ALL 的治疗潜力。
主要结果
-
B-ALL 中 β- 连环蛋白呈低表达且依赖高效降解
与实体瘤相比,小鼠和人类 B-ALL 细胞中 β- 连环蛋白 mRNA 水平正常,但蛋白水平极低,仅为实体瘤的 1/32。B-ALL 细胞中 β- 连环蛋白 N 端持续被 GSK3β 磷酸化,处于持续蛋白酶体降解状态,未检测到稳定的非磷酸化活性形式。临床样本分析显示,B 细胞恶性肿瘤中 β- 连环蛋白降解通路(CTNNB1、APC、AXIN1 等)的致病变异率显著低于实体瘤。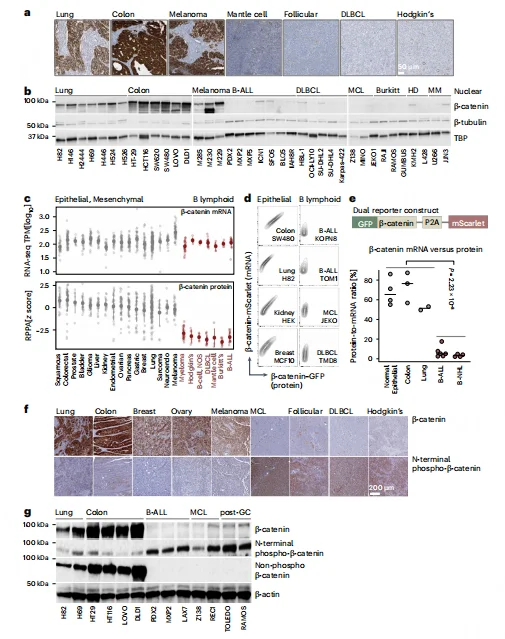
图1.B淋巴细胞表达 β -连环蛋白mRNA但缺乏 β -连环蛋白表达
-
β- 连环蛋白降解是 B-ALL 生存与白血病起始的关键
基因敲除实验证实,APC、GSK3β 或 CK1α 的单等位基因缺失会导致 β- 连环蛋白积累,诱导 B-ALL 细胞急性死亡及集落形成能力丧失。体内实验中,阻断 β- 连环蛋白降解可显著降低白血病起始细胞能力(LIC 从 1/1042 降至 1/40063),延长移植小鼠生存期。B 细胞特异性 β- 连环蛋白磷酸化位点缺失会导致 B 淋巴细胞生成停滞于前 B 细胞阶段,证实 B 细胞发育依赖 β- 连环蛋白降解。经 CEBPα 介导将 B-ALL 重编程为髓系细胞后,其对 β- 连环蛋白积累的敏感性消失,表明降解依赖性是 B 细胞特性决定的。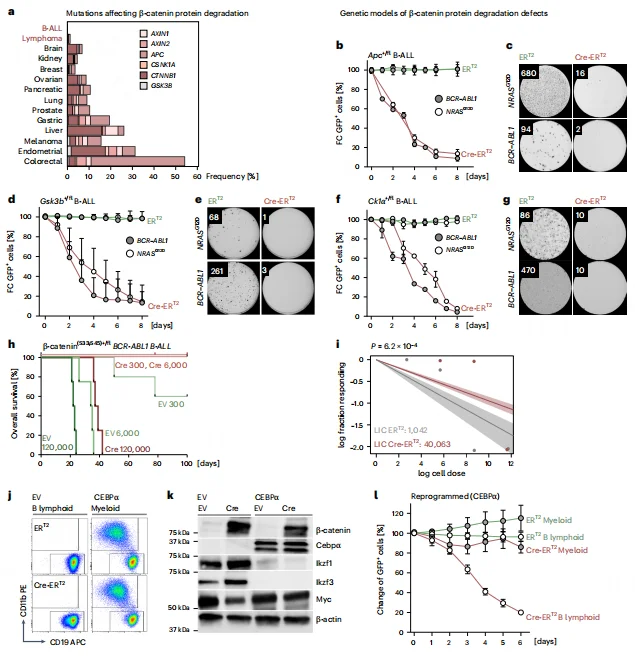
图2.B细胞恶性肿瘤的独特依赖性在于高效降解 β -连环蛋白。
-
β- 连环蛋白积累通过抑制 MYC 诱导 B-ALL 细胞死亡
RNA-seq 及 GSEA 分析显示,β- 连环蛋白积累会显著抑制 MYC 靶基因集,同时上调 Wnt 通路负调控因子(Axin2、Nkd1 等)。双报告基因实验直观显示,GSK3β 抑制剂处理后,β- 连环蛋白积累与 MYC 表达呈负相关,10 小时后 MYC 信号显著下调。过表达 MYC 可挽救 β- 连环蛋白积累介导的细胞死亡,恢复集落形成能力;而敲除 β- 连环蛋白则可逆转 GSK3β 抑制剂对 MYC 的抑制作用。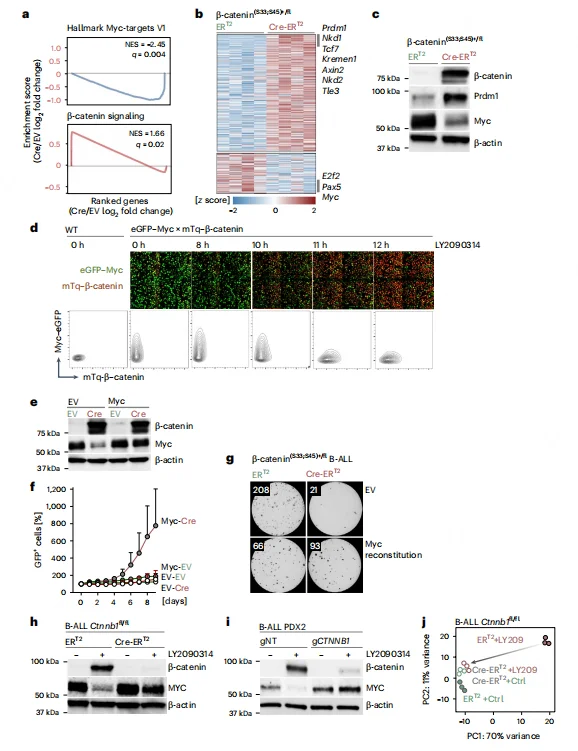
图3.B细胞中 β -连环蛋白降解受损导致MYC转录抑制。
-
β- 连环蛋白与 Ikaros/NuRD 复合物形成抑制性复合物
免疫共沉淀及质谱分析证实,B-ALL 中 β- 连环蛋白不与经典 TCF 因子结合,而是与 B 细胞特异性转录因子 IKZF1/3(Ikaros/Aiolos)及 NuRD 复合物(Chd4、Mta1/2 等)相互作用。IKZF1/3 双敲除可破坏 β- 连环蛋白与 NuRD 复合物的结合,逆转 MYC 抑制及细胞死亡表型;单独敲除 IKZF1 或 IKZF3 无此效果。跨谱系对比显示,β- 连环蛋白与 Ikaros/NuRD 的相互作用为 B 淋巴系特异性,实体瘤中 β- 连环蛋白主要与 TCF 家族结合。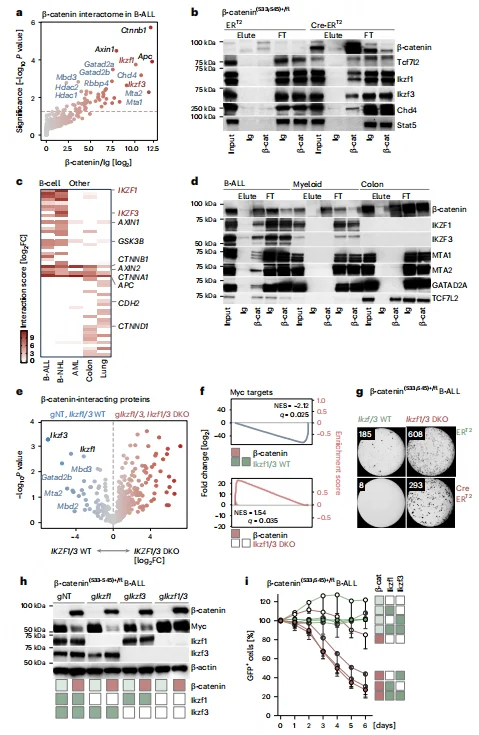
图4.β -连环蛋白与B淋巴样转录因子Ikzf1和Ikzf3形成抑制性复合物
-
Ikaros-β- 连环蛋白复合物在 MYC BENC 增强子介导转录抑制
ChIP-seq 显示,约 72.2% 的 β- 连环蛋白结合峰与 Ikaros 重叠,二者共同富集于 MYC 的造血特异性 BENC 增强子区域。β- 连环蛋白积累会招募 NuRD 复合物,抑制 BENC 区域 H3K27ac 修饰(活性增强子标记),进而抑制 MYC 转录。突变 BENC 区域的 Ikaros 核心结合基序(GGGAA)可阻断 β- 连环蛋白介导的 MYC 抑制,维持细胞存活及竞争性适应度。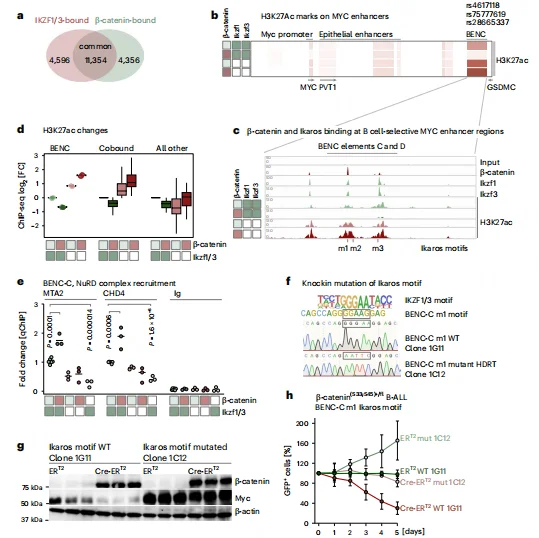
图5.在MYC BENC增强子区域中识别出Ikaros基序,这对于β-连环蛋白介导的MYC抑制是必需的
-
GSK3β 抑制剂对 B-ALL 具有选择性治疗效果
药物敏感性分析显示,GSK3β 抑制剂(LY2090314、CHIR99021 等)对 B 细胞恶性肿瘤的毒性显著高于实体瘤,B-ALL 的 EC50 值较实体瘤低 176 倍。 CRISPR 化学基因组筛选证实,CTNNB1(β- 连环蛋白)敲除可最显著挽救 GSK3β 抑制剂介导的细胞死亡,验证 β- 连环蛋白降解是其核心靶点。 敲除 β- 连环蛋白的 B-ALL 细胞(BV173、PDX2)对 GSK3β 抑制剂完全耐药,进一步证实药物作用依赖 β- 连环蛋白积累。基因表达相关性分析显示,IKZF1/3 高表达与 GSK3β 抑制剂敏感性正相关,TCF7L1/2 高表达则与耐药相关。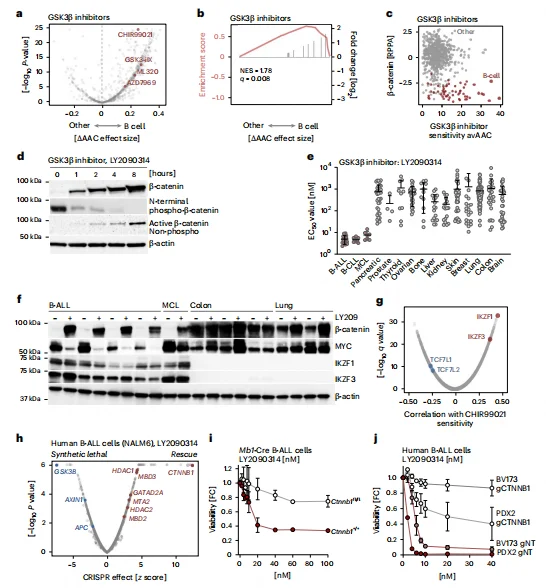
图6.小分子抑制β-连环蛋白降解诱导B细胞选择性死亡
-
GSK3β 抑制剂在难治性 B 细胞恶性肿瘤中的临床转化潜力
GSK3β 抑制剂对化疗敏感及难治性 B-ALL PDX 模型均有效,且不受 IKZF1 缺失状态影响。携带 MYC 易位(8q24+)的 B 细胞淋巴瘤对 GSK3β 抑制剂敏感性显著降低,为临床患者分层提供依据。体内实验中,LY2090314 单药治疗可显著降低难治性 B-ALL 及 MCL PDX 的肿瘤负荷,延长小鼠生存期(P 值范围 6.5×10⁻⁴~1.2×10⁻⁵)。治疗后小鼠无明显器官毒性,且 B-ALL 细胞表型无显著改变,证实其安全性。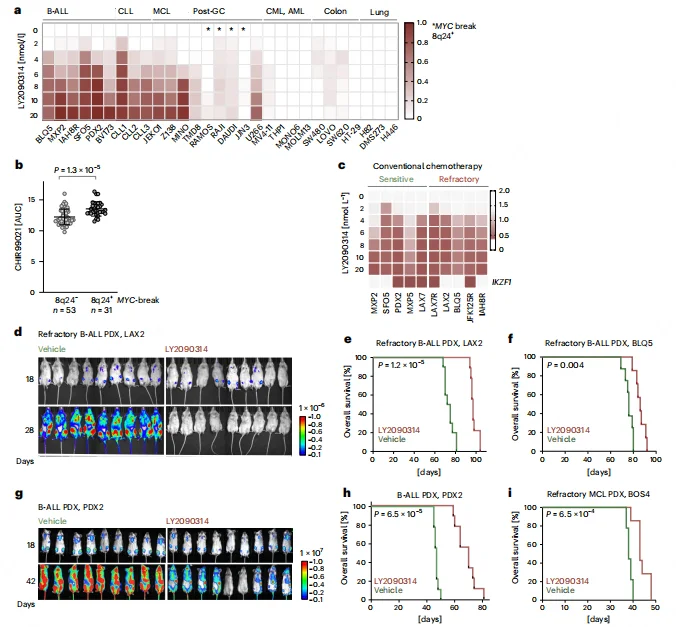
图7.GSK3β 抑制剂用于难治性B淋巴细胞恶性肿瘤的再利用依据
文章小结
本研究揭示了 B-ALL 依赖高效 β- 连环蛋白降解生存的独特机制:GSK3β 介导的 β- 连环蛋白降解可避免其与 Ikaros/NuRD 复合物结合,从而维持 MYC 表达和肿瘤细胞存活。GSK3β 抑制剂可通过阻断该降解过程,诱导 β- 连环蛋白积累并抑制 MYC,实现 B 细胞特异性肿瘤杀伤。该发现不仅阐明了 β- 连环蛋白在 B-ALL 中的非经典作用,更利用已进入临床的 GSK3β 抑制剂,为难治性 B 细胞恶性肿瘤提供了极具转化价值的治疗策略。
源井生物CRISPR-iScreen™文库
CRISPR-iScreen™ 是源井生物自主研发的一项创新技术,旨在实现高效的CRISPR筛选。目前,源井生物拥有超过40种的CRISPR文库现货供应,覆盖人类、小鼠、绿猴及猪等物种的全基因组基因敲除/抑制/激活文库;此外,还有针对激酶、细胞周期、膜蛋白、代谢等相关基因构建的CRISPR敲除/抑制/激活亚文库,助您轻松实现靶点筛选!目前源井拥有 150+文库病毒现货, 400+文库Cell Pool现货, 还提供 一站式CRISPR文库(体内/体外)功能筛选服务, 随时支持您的研究需求。
源井开年特惠, CRISPR文库NGS测序(含分析) 低至¥1600,文库数据分析低至¥500, iScreenAnlys™ 文库分析平台 免费使用, Drug-Z/MAGeCK-MLE/MAGeCK-RRA 三大算法自由选,筛选数据一键分析,欢迎咨询加速您的研究进程!
联系我们了解更多>>>参考文献
Cosgun KN, Jumaa H, Robinson ME, Cheng Z, Oulghazi S, Kume K, Fonseca Arce D, Agadzhanian N, Kistner KM, Leveille E, Drivet E, Yu F, Qian Z, Song JY, Chan WC, Xu L, Xiao G, Taketo MM, Kothari S, Davids MS, Schjerven H, Jellusova J, Müschen M. Targeting β-catenin degradation with GSK3β inhibitors induces cell death in acute lymphoblastic leukemia. Nat Cancer. 2026 Jan 8. doi: 10.1038/s43018-025-01093-z. Epub ahead of print. PMID: 41507538.










