研究前沿| 尿苷竟成抗癌 “神药”?研究证实:补充尿苷增强 CD45 N - 糖基化,逆转高 SNX17 肿瘤的免疫治疗抵抗!


引言
免疫检查点阻断(ICB)疗法在癌症治疗中展现出突破性疗效,但高昂成本与有限响应率(仅 10%-30% 患者获益)严重限制其广泛应用。肿瘤微环境(TME)中的代谢紊乱是导致 CD8⁺T 细胞功能耗竭、ICB 耐药的核心原因之一。近日,南方医科大学研究团队在 Cell Metabolism(IF:30.9)期刊发表最新研究,首次揭示分选连接蛋白 17(SNX17)通过调控尿苷代谢重塑肿瘤免疫微环境的关键机制: SNX17 通过稳定 RUNX2 转录因子,促进尿苷磷酸化酶 1(UPP1)表达,加速 TME 中尿苷降解,进而抑制 CD45 N - 糖基化及下游 LCK-ZAP70 信号激活,削弱 CD8⁺T 细胞抗肿瘤功能。 外源性补充尿苷可有效恢复 CD8⁺T 细胞活性,克服高 SNX17 肿瘤的 ICB 耐药,为开发低成本免疫治疗策略提供了全新方向。

研究背景
CD8⁺T 细胞是肿瘤免疫监视的核心力量,其功能受 TME 代谢环境的严格调控。蛋白质糖基化作为关键翻译后修饰,对 T 细胞发育与激活至关重要,但肿瘤代谢异常如何影响 T 细胞 N - 糖基化进而调控其功能尚不明确。尿苷作为重要核苷类代谢物,参与核酸合成、能量代谢及糖蛋白合成等过程,其在免疫调控中的作用及分子机制仍有待深入阐明。SNX17 作为分选连接蛋白家族成员,主要调控蛋白质内吞与回收,其在肿瘤免疫代谢中的功能尚未见报道,成为潜在的研究靶点。
研究目的
鉴定 ICB 耐药的关键调控因子,阐明其调控 TME 代谢与 CD8⁺T 细胞功能的分子机制,验证尿苷补充作为低成本免疫治疗策略的有效性及与 ICB 疗法的联合应用价值。
研究方法
- 临床样本与数据库分析: 整合 GEO 数据库(GSE189469、GSE215011 等)及 TCGA 结直肠癌(CRC)队列,结合 44 例 CRC 患者临床样本,分析 SNX17、UPP1 表达与 ICB 治疗响应及生存期的相关性。
- 动物模型: 构建 SNX17、UPP1、RUNX2 基因敲除(KO)及过表达(OE)肿瘤细胞系, 建立 CMT93、MC38、Hepa1-6、B16F10 等皮下及原位肿瘤模型,使用 C57BL/6、BALB/c 裸鼠及 SLC29A1-KO、CD45-KO 基因工程小鼠,评估肿瘤生长、免疫细胞浸润及治疗效果。
- 细胞实验: 通过 CRISPR-Cas9 技术构建基因敲除细胞,分离小鼠脾脏 CD8⁺T 细胞及人外周血 PBMC 来源 CD8⁺T 细胞,采用共培养、Transwell 实验、流式细胞术、Western blot 等验证尿苷对 CD8⁺T 细胞活化、细胞因子分泌及信号通路的影响。
- 分子机制验证: 利用质谱分析检测代谢物水平,通过免疫共沉淀(IP)、染色质免疫沉淀(ChIP)、MAL II 凝集素染色等鉴定蛋白互作及糖基化修饰,借助荧光报告基因实验解析信号通路调控关系。
- 治疗验证: 在肿瘤模型中评估外源性尿苷(腹腔注射、饮食补充)单药及与抗 PD-1 抗体联合治疗的效果,检测 TME 中免疫细胞功能重塑情况。
研究路线
- 耐药因子筛选: 通过生物信息学分析鉴定 SNX17 为 ICB 耐药关键基因, 验证其与 CD8⁺T 细胞浸润及患者预后的相关性。
- 功能验证: 在细胞及动物模型中,证实 SNX17 通过消耗 TME 中尿苷抑制 CD8⁺T 细胞抗肿瘤活性,尿苷补充可逆转该效应。
- 机制解析: 阐明 SNX17-RUNX2-UPP1 轴调控尿苷代谢的分子路径;揭示尿苷通过促进 CD45 N - 糖基化激活 LCK-ZAP70 信号的机制;验证 CD45 N - 糖基化位点(N380)的关键作用。
- 治疗验证: 评估尿苷单药及与抗 PD-1 联合治疗的疗效,明确其在高 SNX17 肿瘤中的优势。
主要结果
-
SNX17 高表达与免疫治疗响应不佳及抗肿瘤免疫抑制相关
生物信息学分析显示,SNX17 是唯一与结直肠癌 CD8⁺T 细胞浸润呈显著负相关的 ICB 耐药候选基因,高 SNX17 肿瘤中 CD8⁺T 细胞比例显著降低。CRC 患者肿瘤组织中 SNX17 表达高于正常组织,高 SNX17 表达患者总生存期显著缩短,且 PD 组(疾病进展)SNX17 表达显著高于 PR+SD 组(部分缓解 + 疾病稳定)。动物实验证实,SNX17 过表达的 CMT93 肿瘤对 PD-1 抑制剂治疗无响应,而 SNX17 敲除显著增强肿瘤对 ICB 的敏感性。SNX17 敲除不影响肿瘤细胞体外增殖及裸鼠体内生长,但显著抑制免疫健全 C57BL/6 小鼠的肿瘤进展,对 MC38、Hepa1-6、B16F10 等多种肿瘤模型均有效。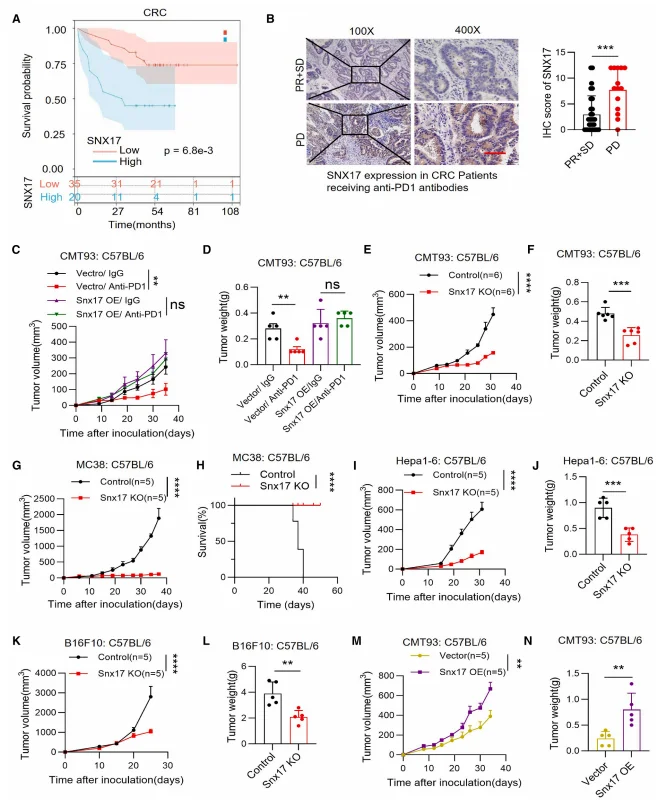
图1.肿瘤组织中SNX17表达升高与免疫治疗反应不良及抗肿瘤免疫抑制相关
-
SNX17 通过 CD8⁺T 细胞依赖方式限制抗肿瘤免疫
单细胞 RNA 测序显示,SNX17 敲除肿瘤中 CD4⁺、CD8⁺T 细胞比例升高,T 细胞活化通路富集,效应分子(IFN-γ、GZMB、IL-2)表达升高,耗竭标志物(PD1、HAVCR2、TIGIT)表达降低。体内抗体耗竭实验证实,CD8⁺T 细胞 depletion 可完全逆转 SNX17 敲除的抗肿瘤效应,而 CD4⁺T 细胞 depletion 无影响, 表明 SNX17 通过靶向 CD8⁺T 细胞发挥免疫抑制作用。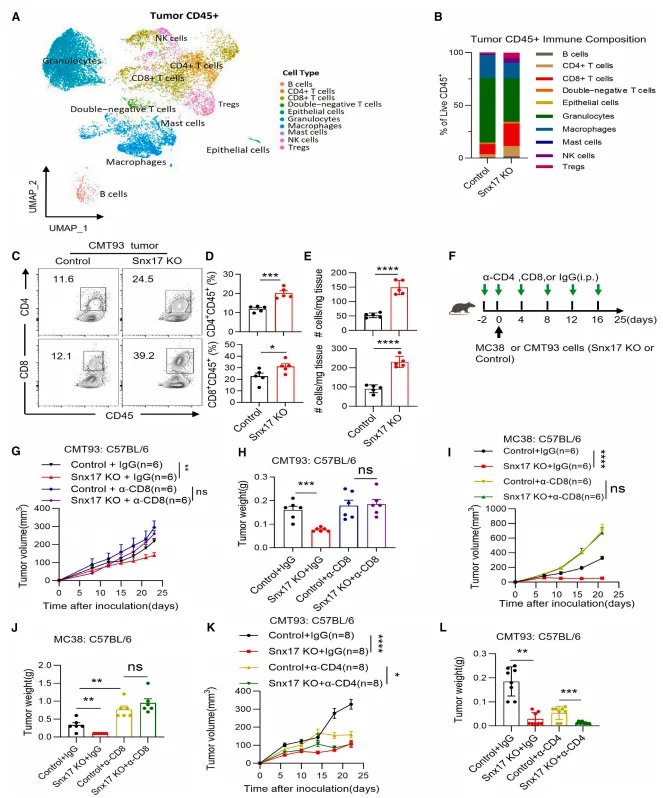
图2.SNX17限制CD8+ T细胞依赖性抗肿瘤免疫
-
SNX17 通过 UPP1 促进尿苷消耗,抑制 CD8⁺T 细胞活性
质谱分析显示,SNX17 敲除肿瘤细胞上清及肿瘤组织中尿苷水平显著升高,尿嘧啶水平降低,而 SNX17 过表达则显著降低尿苷水平。肿瘤细胞与 CD8⁺T 细胞共培养实验证实,二者存在尿苷竞争关系, 低尿苷浓度下肿瘤细胞占比增加会抑制 CD8⁺T 细胞尿苷摄取。 外源性尿苷以剂量依赖方式促进小鼠及人 CD8⁺T 细胞分泌 IFN-γ、IL-2、TNF-α 等细胞因子,且该效应依赖尿苷转运体 SLC29A1。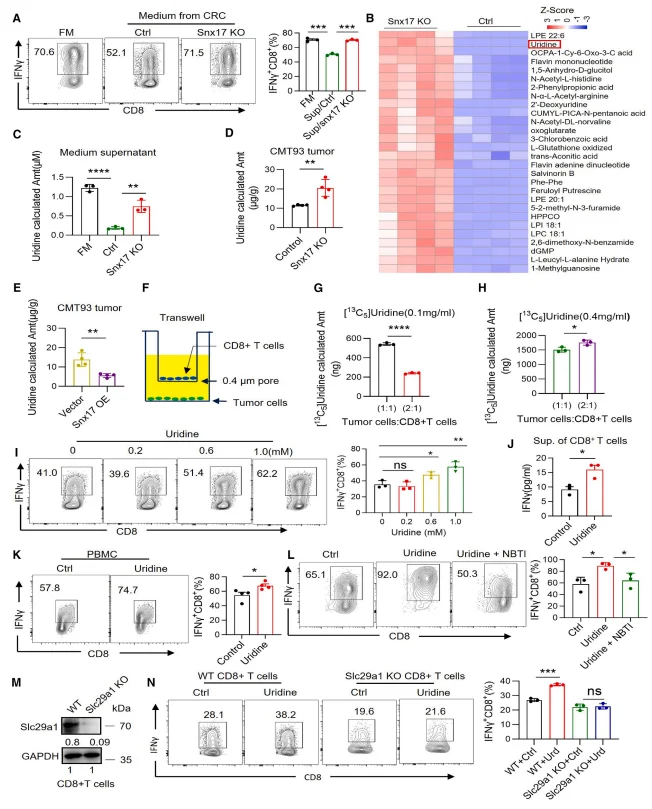
图3.SNX17通过促进尿苷消耗来调节CD8+ T细胞活性
-
尿苷增强 CD8⁺T 细胞介导的抗肿瘤免疫
腹腔注射或饮食补充尿苷显著抑制免疫健全小鼠的肿瘤生长,包括皮下及原位肿瘤模型,且该效应依赖 CD8⁺T 细胞。尿苷单药治疗对低 SNX17 肿瘤的抑制效果与抗 PD-1/PD-L1 抗体相当,且在高 SNX17 肿瘤中与抗 PD-1 抗体联合使用呈现显著协同效应。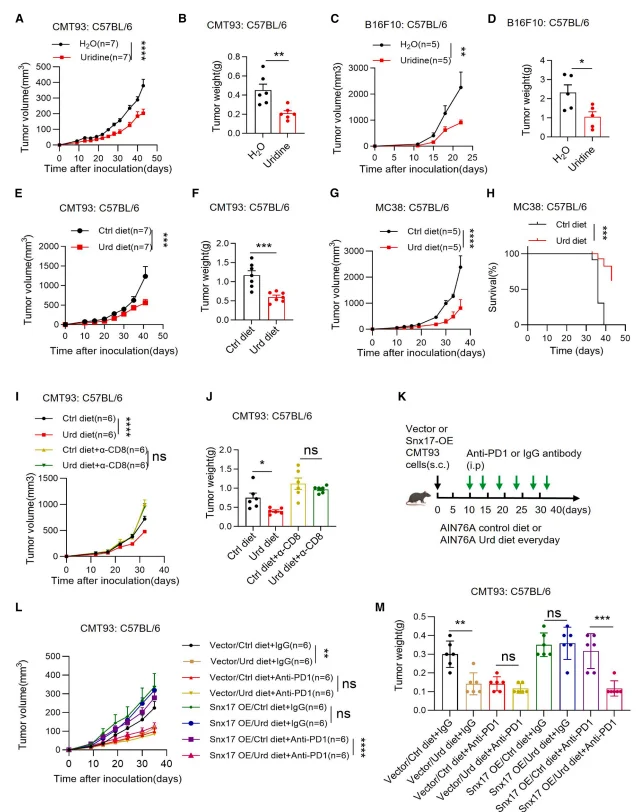
图4.尿苷增强CD8+ T细胞介导的抗肿瘤免疫
-
尿苷通过 CD45 N - 糖基化激活 LCK-ZAP70 信号
尿苷代谢产物 UDP-GlcNAc 水平在尿苷处理及 SNX17 敲除的 CD8⁺T 细胞中显著升高,N - 糖基化抑制剂衣霉素(TM)可阻断尿苷诱导的 IFN-γ 分泌,而 O - 糖基化抑制剂无此效应。质谱鉴定及 MAL II 染色显示,尿苷显著增强 CD45 N - 糖基化,CD45 敲除或糖基化缺陷突变体(CD45RO^N380)可消除尿苷对 CD8⁺T 细胞的激活作用。尿苷促进 LCK(Y394)及下游 ZAP70、CD3ζ 磷酸化,TM 可阻断该磷酸化过程,LCK 抑制剂 PP2 则逆转尿苷诱导的 IFN-γ 分泌。UPP1 敲除模拟 SNX17 敲除表型,增加 TME 中尿苷水平及 CD8⁺T 细胞 IFN-γ 分泌,抑制肿瘤生长,且 UPP1 过表达可逆转 SNX17 敲除的抗肿瘤效应。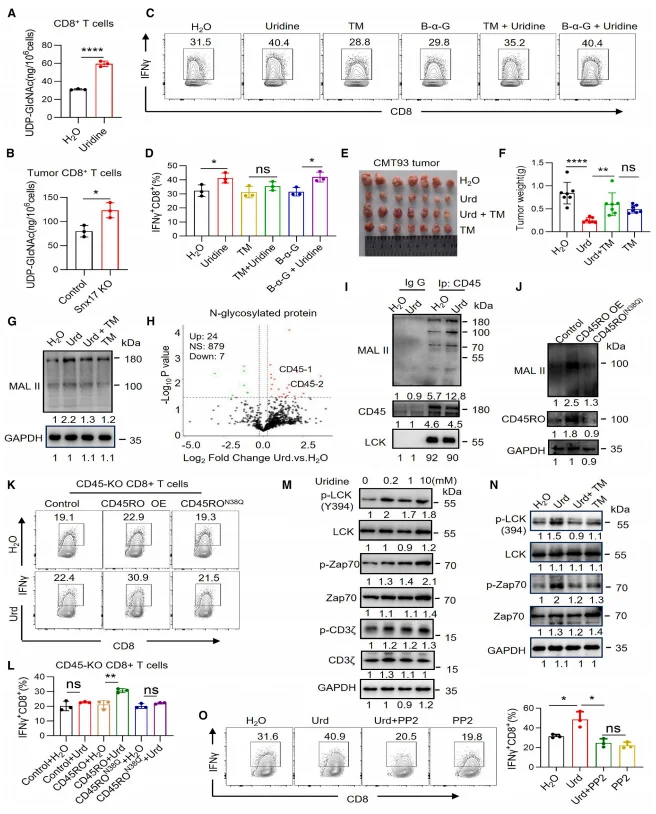
图5.尿苷通过增强CD45的N-糖基化促进CD8+ T细胞活性
-
SNX17 通过 RUNX2 调控 UPP1 转录
RNA-seq 及验证实验显示,SNX17 敲除显著降低 UPP1 mRNA 及蛋白水平,SNX17 过表达则升高 UPP1 表达。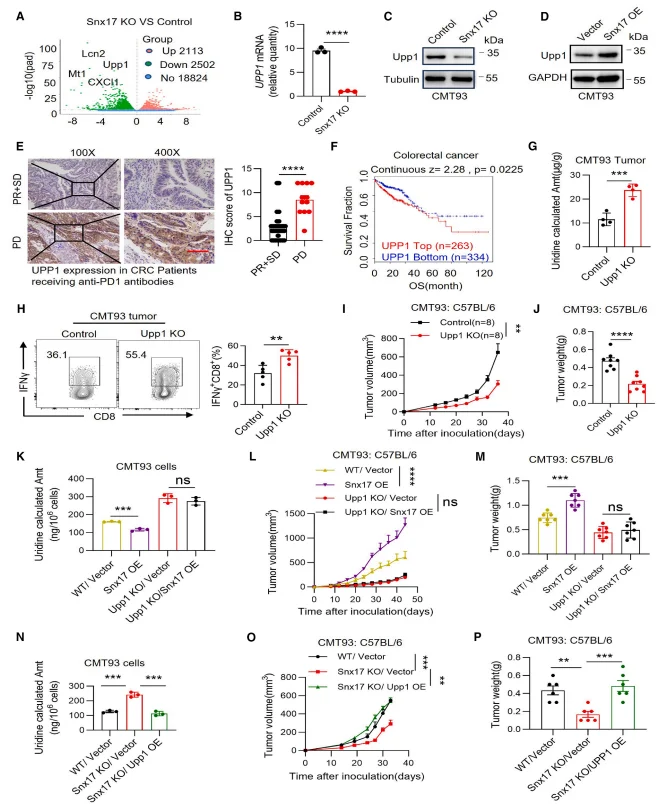
图6.SNX17通过UPP1降低尿苷水平
ChIP 实验证实 RUNX2 可直接结合 UPP1 启动子,SNX17 与 RUNX2 相互作用并抑制其溶酶体降解,RUNX2 敲除可逆转 SNX17 过表达对 UPP1 的上调及肿瘤生长促进作用。
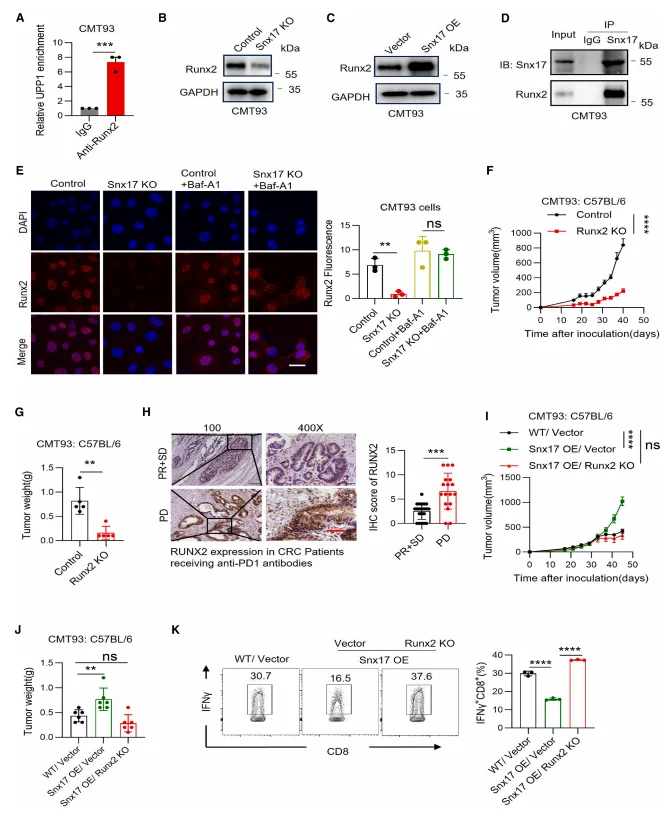
图7.SNX17通过RUNX2调控UPP1转录
研究意义与创新点
-
机制创新: 首次揭示 SNX17-RUNX2-UPP1 - 尿苷代谢轴调控 CD8⁺T 细胞功能的全新机制,明确 CD45 N - 糖基化在尿苷介导的 T 细胞激活中的核心作用,拓展了代谢物调控免疫细胞功能的认知。
-
靶点鉴定: 确立 SNX17/UPP1 作为 ICB 耐药的关键生物标志物,为临床筛选 ICB 潜在响应患者提供依据。
-
治疗策略: 提出外源性尿苷补充作为低成本免疫治疗方案,尤其适用于高 SNX17 表达的 ICB 耐药肿瘤,且与 PD-1 抑制剂联合具有协同效应,为临床转化提供了可行路径。
文章小结
本研究通过多层面实验证实,SNX17 通过稳定 RUNX2 促进 UPP1 转录,加速 TME 中尿苷降解,进而抑制 CD45 N - 糖基化及 LCK-ZAP70 信号激活,导致 CD8⁺T 细胞功能耗竭及 ICB 耐药。 外源性补充尿苷可有效恢复 CD8⁺T 细胞抗肿瘤活性,在高 SNX17 肿瘤中与 PD-1 抑制剂联合使用效果更佳。 该研究不仅揭示了肿瘤代谢重塑免疫微环境的新机制,更提供了兼具特异性与经济性的免疫治疗新策略,为克服 ICB 耐药提供了重要理论与实验依据。
源井生物一直秉持 “让基因编辑更简单” 的核心理念,持续迭代产品与服务,已累计实现13000+基因编辑成功案例,拥有11000+细胞产品(含8000+KO细胞),自主研发的创新技术,基因编辑效率相比于传统方法提升10-20倍。目前源井生物已为超10000个生命科学实验室、药企和CRO公司提供优质的基因编辑服务与产品。
SNX17 作为分选连接蛋白家族成员,主要调控蛋白质内吞与回收。 如果您也想针对SNX17展开研究,源井生物可为您提供SNX17基因敲除细胞,涵盖Hela、293T等热门细胞系。如果您有个性化基因编辑的需要,欢迎咨询!
联系我们了解更多>>>参考文献
Xiao J, Li Z, Ding Y, Zhu K, Zheng Z, Zhang Y, Weng J, Wang F, Zhang Y, Zeng S, Qiu M, Zhang Z, Wang Z, Liang L. Uridine depletion impairs CD8⁺ T cell antitumor activity through N-glycosylation. Cell Metab. 2025 Dec 29:S1550-4131(25)00530-3. doi: 10.1016/j.cmet.2025.11.016. Epub ahead of print. PMID: 41468885.










