另辟蹊径的肿瘤免疫逃逸:小小乙酸,如何成为癌细胞的“隐身燃料”?


引言
一直以来,肿瘤细胞不仅疯狂生长,还会巧妙伪装自己、逃避免疫系统的追杀。除了为人熟知的葡萄糖和谷氨酰胺代谢之外,有没有其他代谢物也在悄悄“助攻”肿瘤免疫逃逸呢?2024年《自然·代谢》上一项突破性研究给出了答案——乙酸,这个日常饮食中常见的成分,竟在肿瘤免疫逃逸中扮演了关键角色。研究采用了 源井生物构建的MYC(p.K148R)以及MYC(p.K148Q)点突变的A549细胞, 模拟乙酰化和非乙酰化的c-Myc状态,并研究这些改变对肿 瘤细胞行为的影响。研究揭示了一条全新的“代谢—表观遗传—免疫”通路,将平凡的乙酸转化为癌细胞增强免疫伪装的关键信号。

研究背景
肿瘤生长迅速,常常面临营养(如葡萄糖)不足的“能量压力”。为了生存,癌细胞会寻找替代燃料。乙酸,作为一种可来自饮食(如发酵食品、加工肉类)和肠道菌群的能量前体,进入了科学家的视野。同时,肿瘤为了不被人体免疫系统(特别是CD8+ T细胞,即“杀手T细胞”)清除,会高表达PD-L1蛋白。PD-L1相当于癌细胞的“别杀我”信号,它能与T细胞上的PD-1结合,令T细胞“沉睡”。但乙酸是否以及如何参与这个过程,此前完全未知。
研究目的
研究完整描绘了 “乙酸 → 经MCT1摄入 → 转化为乙酰辅酶A → 由DLAT催化c-Myc-K148乙酰化 → 募集USP10稳定c-Myc → c-Myc转录激活PD-L等靶基因” 的全新通路,并指出PD-L1表达上调和活化CD8+ T细胞浸润减少促进了肿瘤细胞的免疫逃逸。
研究方法
研究采用了多组学技术和严谨的体内外模型进行系统性验证:
- 临床样本分析: 通过同位素标记和代谢流质谱对人非小细胞肺癌组织检测,确定乙酸是其中最丰富的短链脂肪酸。
- 细胞与动物模型: 在培养的肺癌细胞和小鼠肺癌模型中,使用同位素标记的乙酸追踪其代谢去向,进而发现下游通路。
- 分子机制探究: 利用基因编辑、蛋白质相互作用检测、质谱分析等技术,层层剖析乙酸-MCT1-DLAT-c-Myc-USP10之间的互作机制。
- 免疫功能评估: 体外共培养实验和肿瘤微环境分析,研究乙酸对T细胞功能的抑制。构建小鼠皮下移植瘤模型,通过膳食补充乙酸、使用MCT1抑制剂、联合抗PD-1治疗等干预,观察肿瘤生长和免疫微环境变化。
- 临床相关性分析: 通过免疫组化染色,分析患者非小细胞肺癌组织中c-Myc乙酰化水平与MCT1、PD-L1表达及CD8+ T细胞浸润的相关性。
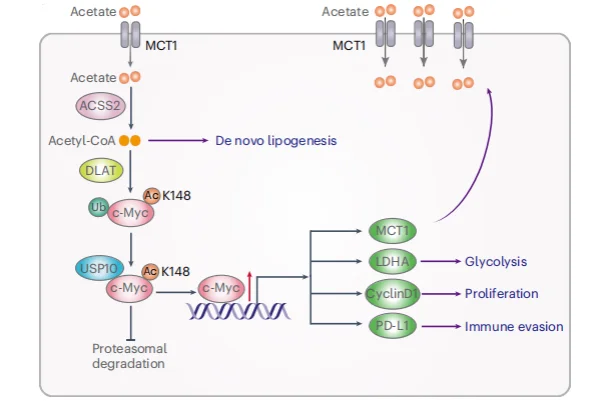
研究路线
- 乙酸摄取: 非小细胞肺癌组织中,乙酸是最丰富的短链脂肪酸。肿瘤细胞通过高表达的单羧酸转运体1(MCT1) 大量摄取乙酸。
- 乙酰化修饰: 乙酸在细胞内转化为乙酰辅酶A,由代谢酶二氢硫辛酰胺乙酰转移酶(DLAT) 催化,对c-Myc蛋白第148位赖氨酸进行乙酰化修饰。
- c-Myc稳定: 乙酰化后的c-Myc能募集去泛素化酶USP10,阻止自身被降解,从而显著提高稳定性和细胞内水平。
- 转录重编程: 小鼠模型中,膳食补充乙酸促进肿瘤生长并抑制CD8+ T细胞浸润;而阻断该通路(如抑制MCT1或USP10)可增强抗PD-1疗法的效果。
- 临床相关性: 在人类非小细胞肺癌样本中,c-Myc的乙酰化水平与MCT1、PD-L1表达正相关,与CD8+ T细胞浸润负相关,且高乙酰化水平提示患者预后较差。
主要结果
-
膳食乙酸盐以MCT1依赖性方式抵消能量应激并促进肺肿瘤生长:
同位素标记和代谢流质谱分析表明,在人类肺癌组织中,乙酸是最丰富的短链脂肪酸,肿瘤组织通过MCT1通道蛋白摄取和富集乙酸并生成乙酰辅酶A,并且这种能力远超正常组织(图1)。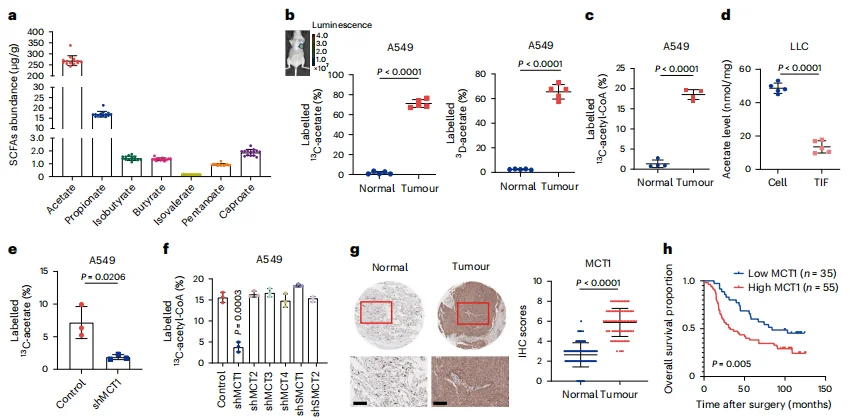
图1 肿瘤依赖MCT1来摄入富集乙酸
而在体内外模型中,通过饮食额外补充乙酸能显著促进肿瘤生长;反之,阻断MCT1通道或剥夺葡萄糖(迫使癌细胞依赖乙酸)时,补充乙酸能拯救肿瘤生长(图2k, m-n)。
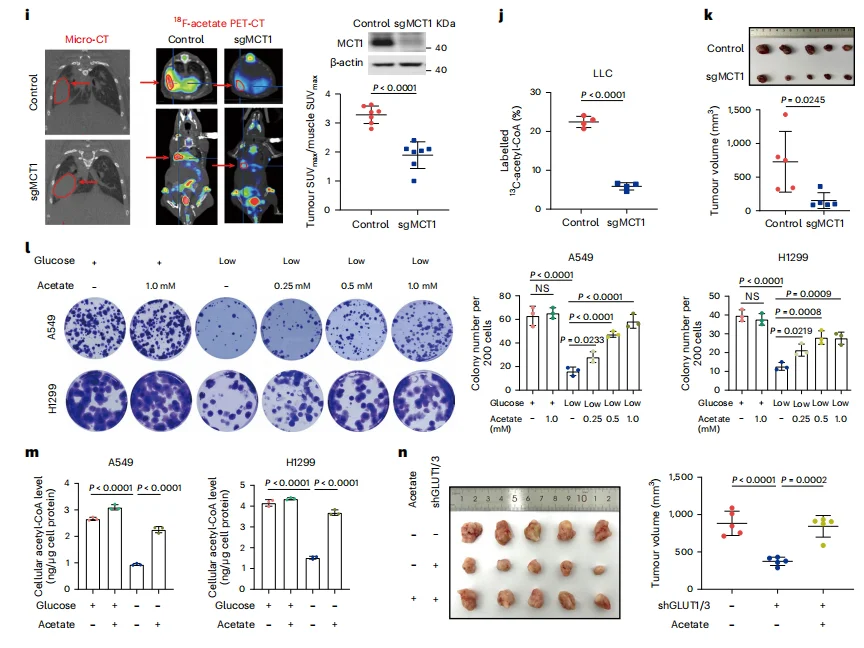
图2 膳食乙酸盐抵消能量应激并促进肺肿瘤生长
-
MCT1→ACSS2→DLAT→USP10→c-Myc轴最终稳定c-Myc转录因子:
已知乙酰辅酶A能够介导蛋白乙酰化,相应的葡萄糖剥夺条件下补充乙酸盐会随时间推移增加组蛋白乙酰化水平。质谱分析表明乙酰化显著增强的蛋白质为c-Myc,且其表达同时受ACSS2(催化乙酸盐生成乙酰辅酶A)的调控(图3 a-c)。进一步分析抗c-Myc的免疫沉淀产物发现,DLAT可乙酰化c-Myc,并减少c-Myc的多聚泛素化(图3e-j)。具体而言,c-Myc蛋白的145位赖氨酸乙酰化状态显著影响其稳定性,c-Myc p. Lys148Arg乙酰化失活突变体和c-Myc p. Lys148Gln乙酰化模拟突变体表现出相反的表型(图3k-o)。这些结果表明, DLAT 可作为真正的蛋白质乙酰转移酶在Lys148位点对c-Myc进行乙酰化修饰,从而在乙酸盐补充条件下抑制c-Myc多聚泛素化,增强c-Myc的稳定性与表达水平。
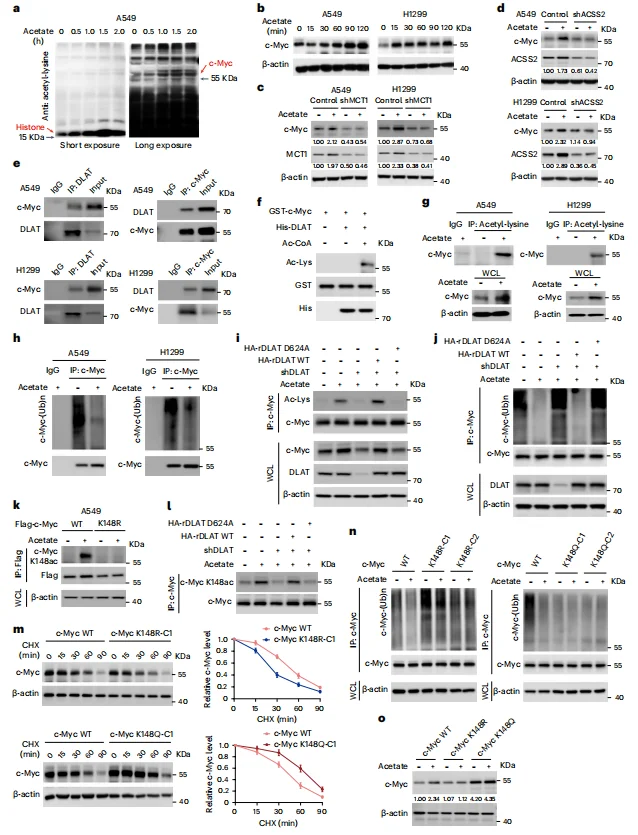
图3 DLAT 在Lys148位点乙酰化c-Myc并抑制c-Myc的多聚泛素化与降解
同时对抗c-Myc免疫沉淀物进行质谱分析和CO-IP验证,发现USP10是其结合蛋白(图4a)。且USP10缺失会降低c-Myc的基础表达及乙酸盐导致的增强表达(图4c-e),表明USP10在c-Myc去泛素化及后续蛋白酶体降解抑制中起关键作用。而在GST下拉实验中, DLAT 和乙酰辅酶A的存在使野生型c-Myc(而非c-Myc p.Lys148Arg)能够与USP10结合,且c-Myc p.Lys148Gln在无 DLAT 存在时仍能与USP10结合(图4f)。
这些结果共同表明,乙酸盐补充促进的 DLAT 依赖性c-Myc Lys148乙酰化导致USP10与c-Myc结合,从而实现其去泛素化和稳定化。
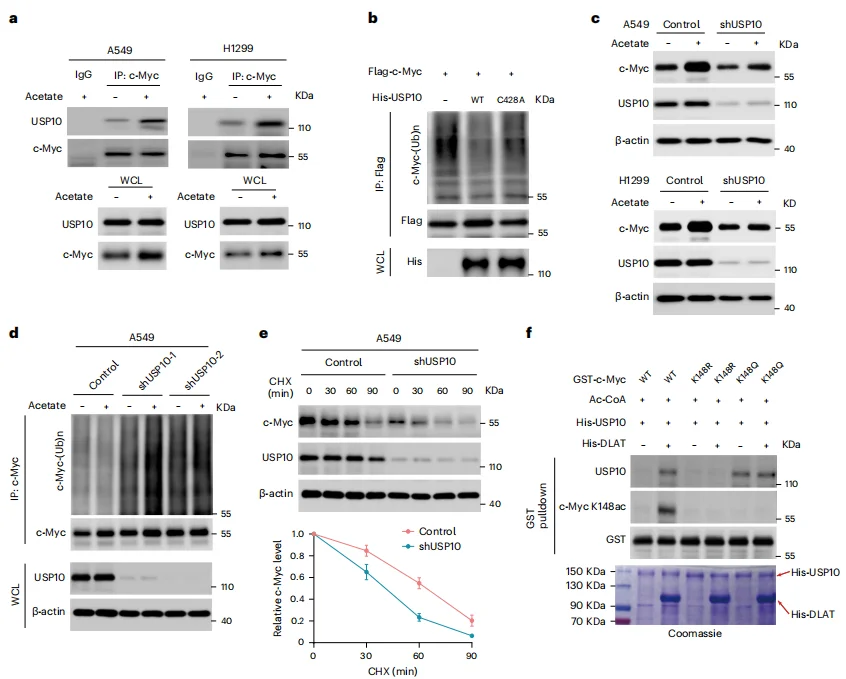
图4 c-Myc Lys148乙酰化促进USP10结合以实现c-Myc的去泛素化和稳定化
-
稳定的c-Myc促进细胞增殖和免疫逃逸
c-Myc是一种转录因子,在多种基因的表达中起关键作用。低糖条件下补充乙酸盐,可显著提升细胞中c-Myc、PD-L1、细胞周期蛋白D1、 LDHA 和MCT1的表达水平,同时增加乳酸生成和细胞增殖(图5b-c)。而在与源自OT-1小鼠的CD8+ T细胞共培养时,乙酸盐处理显著抑制了T细胞活化,减少其IL-2和INF-γ的表达(图5f)。此外,上述这些效应均可通过敲降MCT1、ACSS2、 DLAT 和USP10以及改变c-Myc Lys148乙酰化状态来阻断(图5b-d,g-i)。这些结果共同表明,乙酸盐补充通过乙酸盐-MCT1-ACSS2- DLAT -USP10-c-Myc通路,促进 NSCLC 细胞的乙酸盐摄取、糖酵解和增殖,并以PD-L1依赖的方式抑制CD8+T细胞活化。
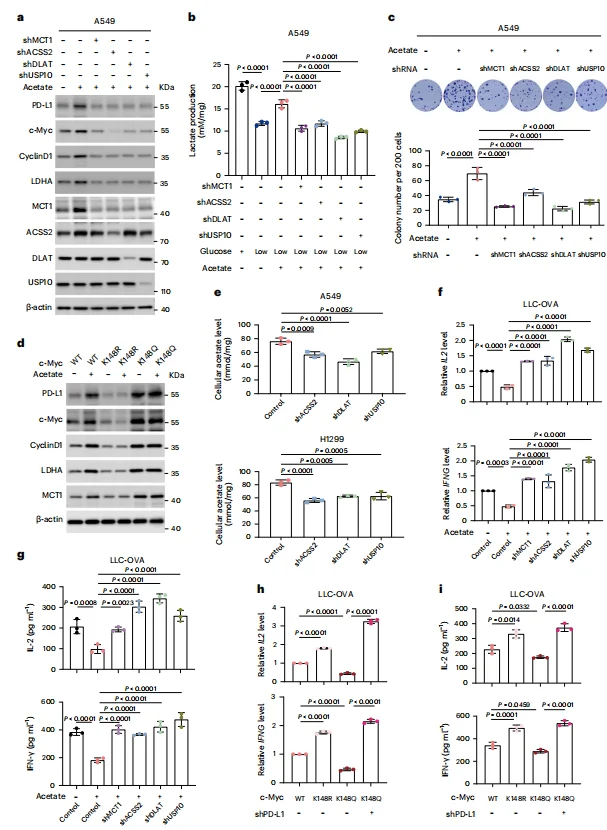
图5 补充乙酸盐可促进 NSCLC 细胞的糖酵解和增殖,并通过PD-L1依赖性途径抑制CD8+ T细胞活化
-
c-Myc Lys148乙酰化介导的c-Myc表达增强促进 NSCLC 肿瘤免疫逃逸及临床进展
对90例 NSCLC 组织及其对应的邻近正常组织进行了 IHC 分析,肿瘤组织中中c-Myc和USP10表达水平及c-Myc Lys148乙酰化水平均显著较高(图6a-d)。一致的,c-Myc Lys148乙酰化水平与MCT1、c-Myc及PD-L1表达水平呈正相关(图6e-g)。而与c-Myc Lys148乙酰化水平和MCT1表达水平CD8+ T细胞浸润程度呈负相关(图6h-i)。这些结果共同提升,c-Myc Lys148乙酰化介导的c-Myc表达增强会促进肿瘤免疫逃逸和 NSCLC 临床进展。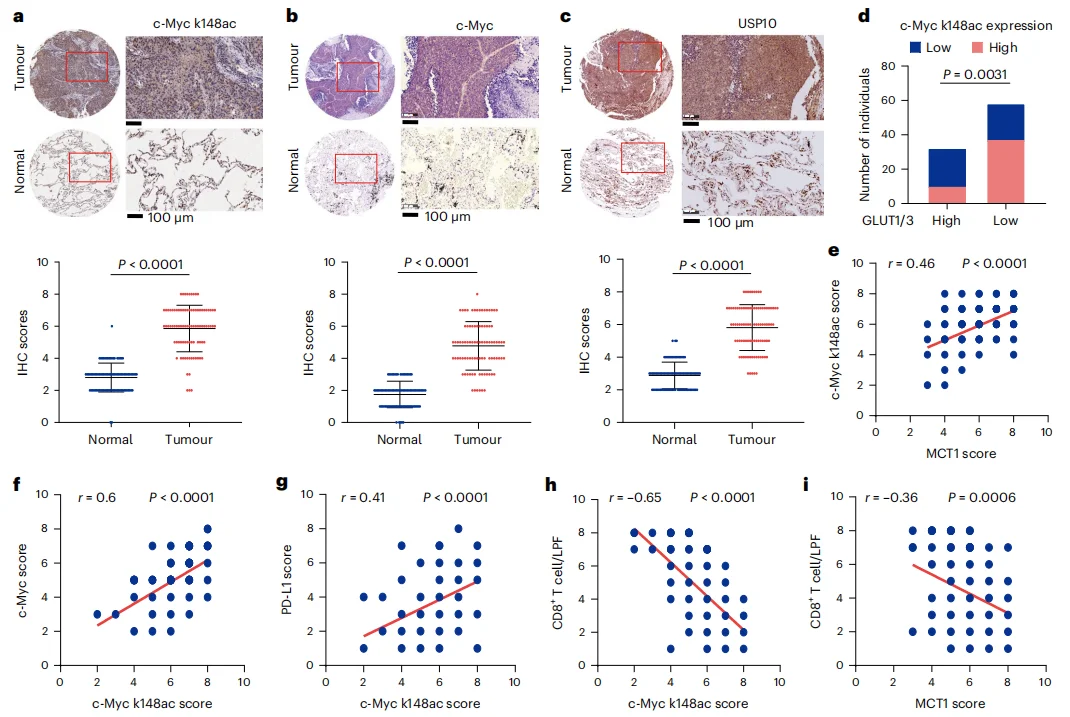
图6 c-Myc Lys148乙酰化介导的c-Myc表达增强促进 NSCLC 肿瘤免疫逃逸及临床进展
研究意义与创新点
- 连接代谢与免疫: 首次系统地揭示了常见代谢物乙酸如何通过一条清晰的分子通路,将肿瘤的代谢重编程与免疫检查点上调这两个核心特征联系起来。
- 发现新靶点: 指出了MCT1、ACSS2、DLAT、USP10等多个潜在的治疗靶点。特别是DLAT,其作为代谢酶“兼职”乙酰化修饰蛋白的功能是全新发现。
- 提出新策略: 研究提示,通过限制膳食乙酸摄入或药物阻断乙酸利用通路,可能成为一种“饿死”肿瘤并解除其免疫伪装的新策略,并能与现有免疫疗法(如PD-1抑制剂)联合使用,提高疗效。
文章小结
简单来说,这项研究讲了一个“健康分子变帮凶”的故事:原本普通的乙酸,在肺癌微环境中被癌细胞高效掠夺,并通过一条MCT1→ACSS2→DLAT→USP10→c-Myc的精密流水线,最终同时实现了 “为癌细胞充电促生长” 和 “给癌细胞披上隐形斗篷促逃逸” 两大功能。这项研究不仅深化了我们对肿瘤代谢复杂性的理解,更为肺癌的联合治疗(代谢干预+免疫治疗)提供了全新的理论依据和靶点。
源井生物提供的支持
该研究采用了源井生物构建的MYC(p.K148R)以及MYC(p.K148Q)点突变的A549细胞,助力研究揭示乙酸在肿瘤免疫逃逸中的作用。
针对
点突变细胞构建
需求,源井生物自主研发出EZ-HRex™
核心技术。该技术创新性地添加U+分子,细胞基因突变和片段敲入的HDR效率实现全面提升,转染后Cell
Pool水平的 HDR基因型占比高达
84%。
同时,我们提供 RNP 法、先导编辑器、单碱基编辑器、质粒抗性法等4
种灵活的点突变方案,覆盖超 300
种细胞类型,可精准满足不同科研场景下的突变需求。
参考文献
Wang J, Yang Y, Shao F, et al. Acetate reprogrammes tumour metabolism and promotes PD-L1 expression and immune evasion by upregulating c-Myc. Nat Metab. 2024;6(5):914-932. doi:10.1038/s42255-024-01037-4










