CRISPR文库+流式发现新靶点Vtn-C1qbp,让巨噬细胞“吃掉”癌细胞!

CRISPR文库+流式发现新靶点Vtn-C1qbp,让巨噬细胞“吃掉”癌细胞!

今天小源给大家分享一篇在Theranostics上发表的文章:Targeting tumor cell-to-macrophage communication by blocking Vtn-C1qbp interaction inhibits tumor progression via enhancing macrophage phagocytosis,这篇文章使用小鼠全基因组CRISPR 敲除文库病毒分别转导巨噬细胞和肿瘤细胞并使用流式细胞仪进行吞噬表型功能筛选,通过CRISPR筛选和后续功能实验来识别和验证阻断肿瘤细胞与巨噬细胞之间的Vtn(玻连蛋白)和C1qbp(补体C1Q结合蛋白)相互作用,增强巨噬细胞的吞噬作用,从而抑制肿瘤进展。

图. Targeting tumor cell-to-macrophage communication by blocking Vtn-C1qbp interaction inhibits tumor progression via enhancing macrophage phagocytosis
背景
癌细胞可通过过表达 “don't-eat-me” 信号的抗吞噬细胞表面蛋白逃避巨噬细胞清除,而 靶向这些“don't-eat-me”信号的单克隆抗体在多种癌症中显示出治疗潜力,但仍有其他未知的抗吞噬信号存在。为了找到存在于肿瘤细胞和巨噬细胞中的吞噬调节配体-受体对,本文采用基于体外FASC的吞噬实验,以直接吞噬能力为指标,通过流式细胞术筛选出吞噬肿瘤细胞的巨噬细胞,然后在细胞间相互作用数据库中绘制阻碍巨噬细胞吞噬的基因,从而鉴定了Vtn-C1qbp配体-受体对。这一发现为靶向肿瘤细胞与巨噬细胞之间的通讯提供了新的分子靶点,有望为癌症治疗提供新的策略。
以下是该文章采用CRISPR文库进行筛选的流程介绍
Raw264.7巨噬细胞筛选
1. 转导:用小鼠全基因组慢病毒CRISPRsgRNA库以MOI为5转导RAW264.7巨噬细胞,确保每个细胞只转导一个sgRNA。
2. 共培养与排序收集:将转导后的巨噬细胞与用GFP转导的4T1细胞共培养两小时后,对CD45⁺GFP⁺吞噬细胞(吞噬了肿瘤细胞的巨噬细胞)进行流式分选排序和收集。
3. 恢复与鉴定:通过PCR扩增从排序细胞的全基因组DNA中恢复sgRNA序列,并通过高通量测序鉴定,通过Mageck算法计算吞噬细胞与所有巨噬细胞中sgRNAs的相对富集。
4T1肿瘤细胞筛选
1. 转导:对4T1肿瘤细胞进行与巨噬细胞类似的全基因组慢病毒CRISPRsgRNA库转导操作。
2. 共培养与排序收集:将转导后的4T1细胞与巨噬细胞共培养,之后对相关细胞进行流式分选排序和收集。
3. 恢复与鉴定:同样通过PCR扩增恢复sgRNA序列并测序鉴定,计算sgRNAs的相对富集。
实验结果
1.巨噬细胞和肿瘤细胞中的全基因组CRISPR筛选鉴定了吞噬作用的调节因子
为了系统地寻找调节巨噬细胞吞噬肿瘤细胞的配体-受体相互作用,用小鼠全基因组慢病毒CRISPRsgRNA文库(lentiCRISPRv2-Brie)分别转导巨噬细胞和肿瘤细胞,以进行功能丧失筛选。选择了一种小鼠巨噬细胞系Raw264.7,它具有与正常巨噬细胞相似的特性,具有吞噬活性和抗肿瘤活性。此外,在临床试验中,三阴性乳腺癌(TNBC)细胞可以通过CD47非依赖性机制逃避巨噬细胞的吞噬消除,因此选择4T1细胞作为筛选的肿瘤细胞模型。为了使巨噬细胞的吞噬作用可视化,用GFP(绿色荧光蛋白)转导4T1细胞,使得可以通过荧光激活细胞分选仪(FACS)检测巨噬细胞对肿瘤细胞的吞噬作用。
用lentiCRISPRv2-Brie文库病毒以0.5的感染复数(MOI)转导Raw264.7,以确保每个细胞仅转导一种sgRNA。将SgRNA转染的Raw264.7细胞与4T1细胞共培养(1:2)用于体外吞噬测定。共培养2小时后,分选并收集CD45+GFP+吞噬细胞。通过PCR扩增回收分选细胞基因组DNA中的sgRNA序列片段,并通过高通量测序鉴定。通过MAGeCK(全基因组CRISPR-Cas9敲除的基于模型的分析)算法计算吞噬巨噬细胞与所有巨噬细胞中sgRNA的相对富集。类似地,对4T1细胞进行相同的筛选过程以鉴定调节癌细胞中巨噬细胞吞噬作用的基因。通过使用log2(倍数变化)>0.5和RRA评分<0.25的标准,鉴定了660个潜在的吞噬抑制基因,在巨噬细胞中鉴定的吞噬抑制基因显示出与吞噬相关的途径的强烈富集,例如代谢、肌动蛋白细胞骨架的调节、内吞作用和溶酶体途径。
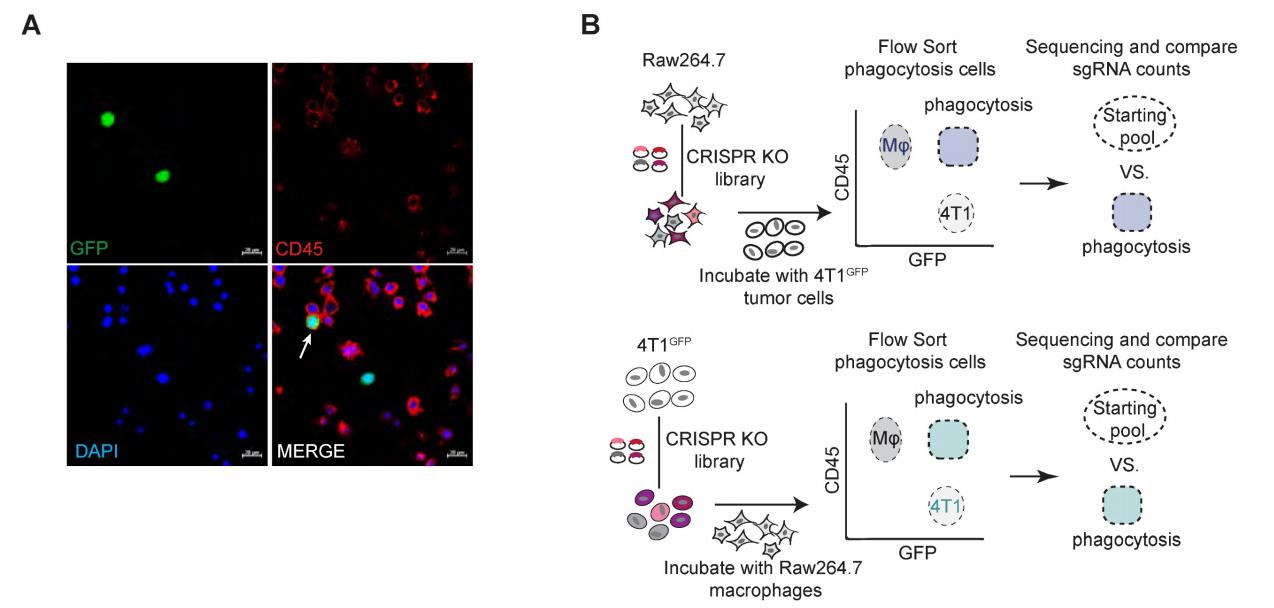
图1 全基因组CRISPR筛选吞噬作用的调节因子
2.确定Vtn-C1qbp配体-受体对
从巨噬细胞中识别出的660个命中基因中有169个编码细胞表面蛋白质,在肿瘤细胞的1138个命中基因中,关注在TCGA数据库中乳腺癌患者乳腺组织与正常组织相比表达增加的589个基因作为配体候选者。将巨噬细胞和肿瘤细胞中的候选基因映射到多伦多大学Bader实验室的细胞-细胞相互作用数据库,通过流式细胞术和RNA测序分析等进一步缩小候选相互作用范围,最终确定Vtn-C1qbp为肿瘤细胞吞噬巨噬细胞的调控因子。
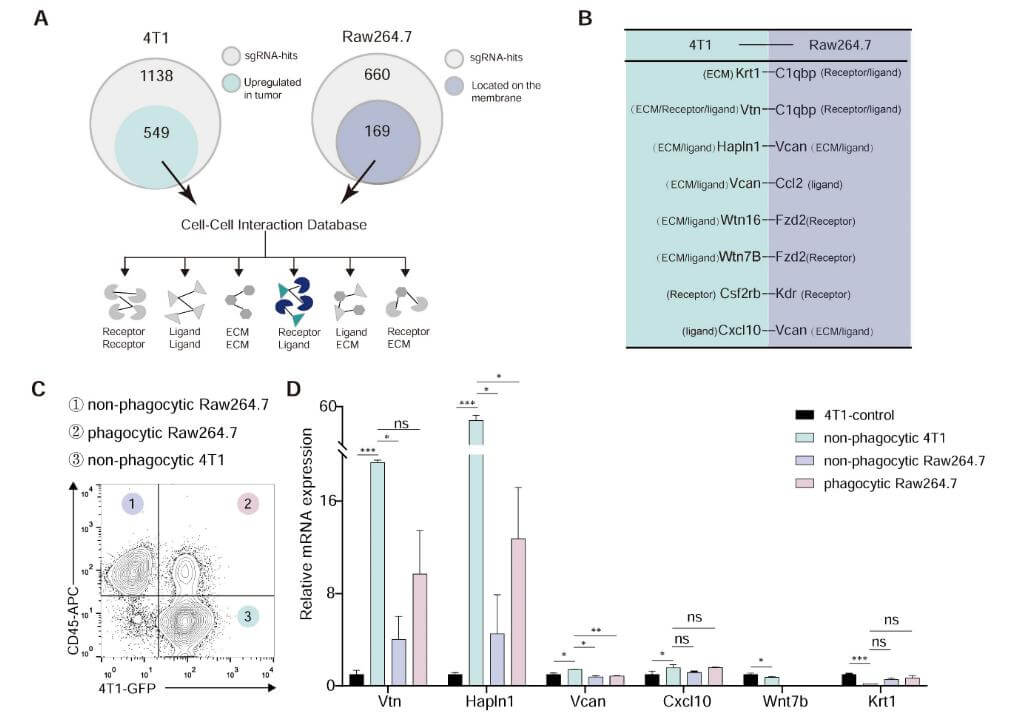
图2 Vtn-C1 qbp配体-受体对作为吞噬作用的假定修饰剂
3.Vtn-C1qbp 相互作用的验证
通过多种实验验证了Vtn与C1qbp的相互作用。FACS分析显示膜结合形式的C1qbp主要存在于巨噬细胞中,RAW264.7和4T1细胞直接共培养增加了C1qbp⁺和Vtn⁺巨噬细胞的比例。在RAW264.7细胞中进行的IP联合westernblotting分析表明Vtn与C1qbp共免疫沉淀,且Vtn主要与C1qbp的αA结构域相互作用。
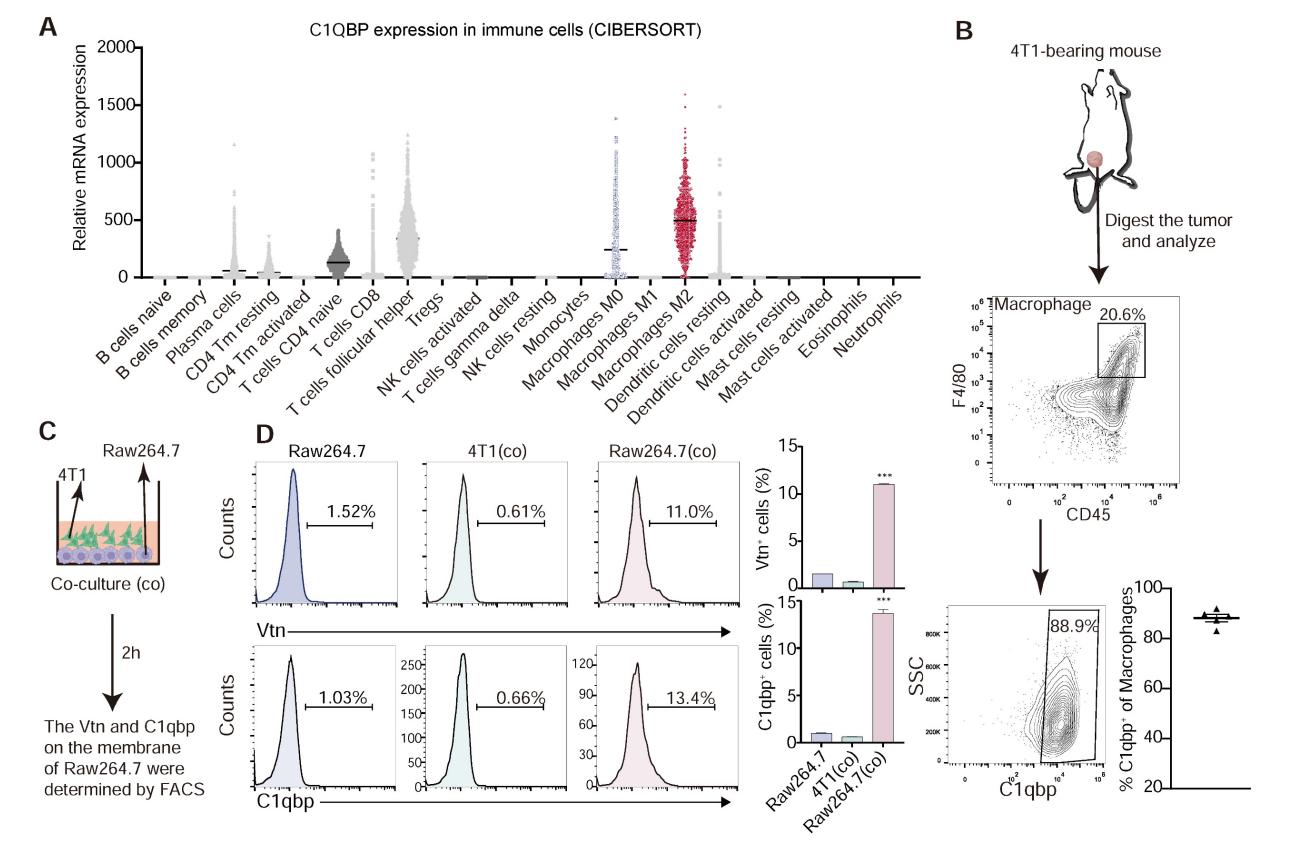
图3 Vtn与巨噬细胞质膜上的C1qbp结合
4.Vtn-C1qbp 轴对巨噬细胞吞噬作用的影响
敲低4T1细胞中的Vtn可增强巨噬细胞的吞噬作用,在体内实验中,Vtn敲除肿瘤通过浸润TAM表现出体内吞噬作用水平增加。进一步研究发现Vtn-C1qbp介导巨噬细胞中CD16依赖性SHP1募集,通过IP偶联质谱分析鉴定出C1qbp的296种特异性结合蛋白,KEGG通路富集分析显示它们主要富集在Fcγ受体介导的吞噬作用和吞噬作用相关的内吞作用途径中。
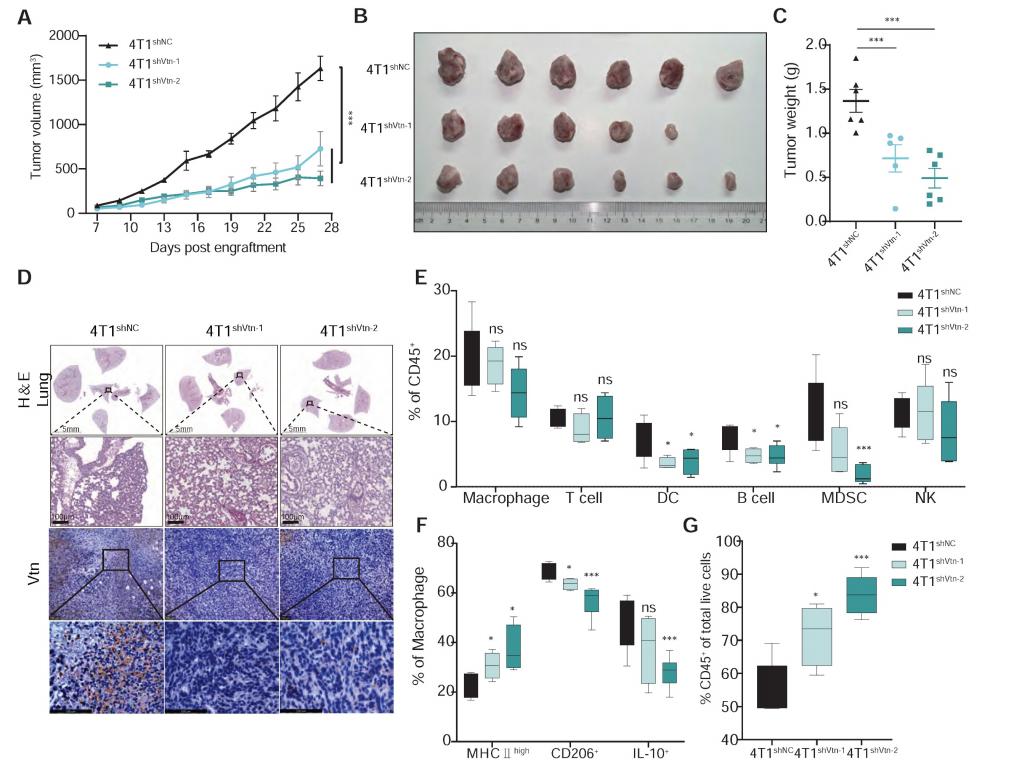
图4 Vtn-C1 qbp使巨噬细胞向M2样表型分化
结论
本研究揭示了Vtn与C1qbp的相互作用通过抑制巨噬细胞的吞噬能力促进肿瘤生长。研究表明,Vtn-C1qbp轴通过促进FcγRIIIA/CD16介导的Shp1募集,降低Syk磷酸化,从而抑制巨噬细胞的吞噬作用和促进其向M2样表型极化,从而促进肿瘤生长。此外,研究还发现,敲除Vtn和抗CD47抗体相结合使用可有效增强巨噬细胞的吞噬和浸润能力,从而减少体内肿瘤的生长。这一发现为三阴性乳腺癌的治疗提供了新的分子靶点,并可能与现有的免疫治疗策略产生协同效应。
小源小结
本研究通过文库筛选获得靶向Vtn-C1qbp的抑制剂,利用流式细胞术证实其可显著增强巨噬细胞对肿瘤细胞的吞噬活性,最终在体内外模型中逆转免疫逃逸并抑制肿瘤进展。其中流式细胞分选在文库筛选过程中的优势有以下几种
1. 高通量分析与分选:流式分选技术能够快速分析和分选成千上万的细胞,速度高达数万个细胞每秒 。
2. 多参数检测:它可以同时对单个细胞的多个参数进行测量,如细胞密度、大小、内部复杂度以及其他荧光信号 。
3. 高纯度和高回收率:流式分选技术能够以高纯度和高通量筛选目标细胞,硬件中样本细胞丢弃的比例低于5%,保证样本中目标细胞的高回收率 。
4. 适用性广泛:适用于多种细胞类型和生物样品的分析,包括悬浮细胞和经过适当处理的粘附细胞 。
5. 灵活性:可以进行正选和负选,以及多路分选,适应不同的实验需求 。
源井可提供CRISPR文库+流式分选服务,低至2.4w,快至8周筛到靶点!
参考文献:
Zhang C, Liu Y, Jiang J, Chen C, Duan Z, Su H, Wang S, Tian B, Shi Y, Xiang R, Luo Y. Targeting tumor cell-to-macrophage communication by blocking Vtn-C1qbp interaction inhibits tumor progression via enhancing macrophage phagocytosis. Theranostics. 2024 Apr 22;14(7):2757-2776. doi: 10.7150/thno.94537. PMID: 38773982; PMCID: PMC11103506.










