如何利用CRISPR技术研究蛋白激酶


如何利用CRISPR技术研究蛋白激酶

蛋白激酶(Protein kinases)及其相对应存在的蛋白磷酸酶对许多科学家来说是至关重要的。能编码成蛋白激酶的占人类基因组大约2%的部分被称为“人类激酶组”,它由518种蛋白激酶及其变体组成。蛋白激酶是细胞功能的关键调节剂。它们调节真核细胞中大部分的信号转导,并协调各种细胞活动的活性,包括代谢、转录、细胞周期进程、细胞运动、分化和凋亡。蛋白激酶通过将磷酸基团添加到其底物中来修正蛋白质活性,指导各种蛋白质的活性,定位和整体功能。
蛋白激酶的突变和失调在人类疾病,特别是癌症中有着因果作用。他们参与细胞生物学的多个方面,开放了开发用于治疗用途的激动剂和拮抗剂的可能性。人们对开发口服用活性蛋白激酶抑制剂的兴趣日益增长,而这促成了几种临床使用的抑制剂的使用批准。
蛋白激酶是最大的和被研究最多的基因家族之一。通过在发育,转录,免疫反应,代谢,细胞凋亡和分化过程中调节信号转导,蛋白质磷酸化在真核生物的细胞间通讯中起着重要的作用。激酶的异常调节在许多疾病中有着因果作用,而通过研究这些蛋白质及其功能将有助于研发和发展新疗法。激酶组可以精准研究激酶肿瘤依赖性表型,因此,针对激酶组的研究有开发潜在的治疗靶标的潜力。
人类蛋白激酶组是复杂细胞网络中协调功能性细胞活动的最大蛋白家族之一。当激酶组受到干扰时,可以引起各种癌症。基因,结构和生化数据的丰富性和多样性是靶向和个性化药物对抗蛋白激酶突变谱的复杂机制的基础。迄今为止,蛋白激酶已被验证并被广泛接受作为药物研发的目标,超过40种相关药物已获得FDA的批准并在市场上销售。而大多数化合物都涉及到酪氨酸激酶,其主要治疗应用是癌症和炎症。结合系统生物学方法的发展,基因组学和蛋白质组学技术正在快速识别和描述新的耐药机制,以了解个性化激酶药物的基本原理设计。
应用:
1. 关系网络:将激酶组作为研究激酶或“激酶组学”的网络。
2. 疾病发展:疾病发展中的激酶研究(例如癌症研究激酶,心血管疾病研究激酶,神经系统研究激酶,即阿尔茨海默病研究激酶、帕金森病研究激酶、多发性硬化激酶等,代谢紊乱研究和呼吸研究)。
3. 药物研发:确认激酶底物,激酶药物反应,药物研发,突变激酶和下游效应的研究,及疾病机制的研究。通过揭示靶向激酶基因的稳健性与靶向激酶药物的结合特异性之间的复杂关系进行药物设计,并开发合理定制和个性化的药物治疗的新策略。
4. 疾病研究模型:激酶疾病模型(癌症,心血管疾病,阿尔茨海默病,研究激酶,帕金森病,多发性硬化症,代谢和呼吸等)。
案例分析:
通过CRISPR-Cas9介导敲除HTR5A发现,5-羟色胺5A受体是开发抗癌药物的潜在目标
乳腺肿瘤起始细胞(Breast tumor-initiating cells, BTIC)是启动和维持肿瘤生长并驱使疾病复发的干细胞样细胞。确定靶向BTIC的疗法一直受到阻碍,主要是因为其在肿瘤中的稀缺性。而一些小分子就可以影响到BTIC的存活。在这项研究中,研究人员证明人乳腺肿瘤细胞暴露在几种结构不相关的5-HT5A选择性拮抗剂中可以降低BTIC的形成率,并且由CRISPR-Cas9介导敲除HTR5A也表现出同样的效果。他们使用磷酸化蛋白质组学方法来确定人乳腺肿瘤细胞在化合物SB-699551的暴露中,破坏了通过Gαi/o a偶联途径和PI3K/AKT/mTOR轴的信号传导,而这与5-HT5A的拮抗作用一致。他们表明SB-699551降低了人乳腺肿瘤异种移植物的生长速度并与多西紫杉醇(docetaxel)协同作用化疗缩小异种移植物。他们共同提供遗传学,药理学和磷酸化蛋白质组学的证据,证明5-HT5A可能是SB-699551的靶标,选择性5-HT5A拮抗剂可能会发展成一类新型抗癌药物,且可与细胞毒性疗法相结合,用于缩小已建立的乳腺肿瘤异种移植物。
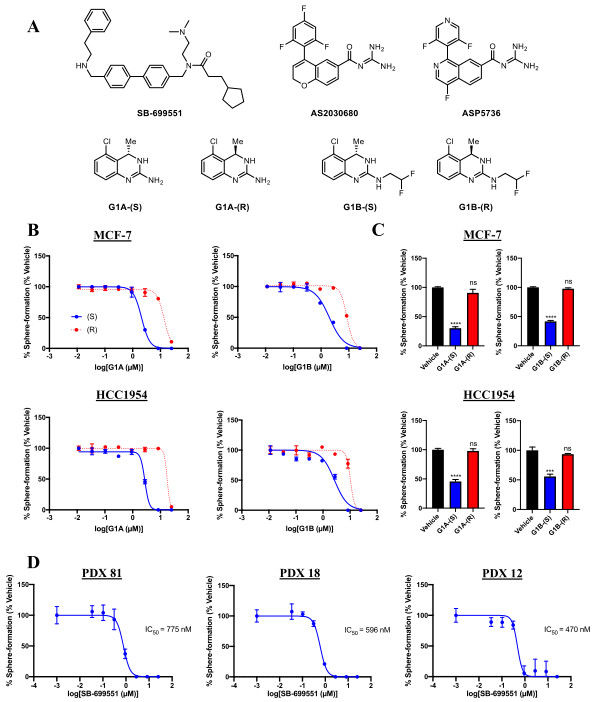
图1: 5-HT5A的选择性拮抗剂抑制人乳腺肿瘤细胞形成肿瘤球
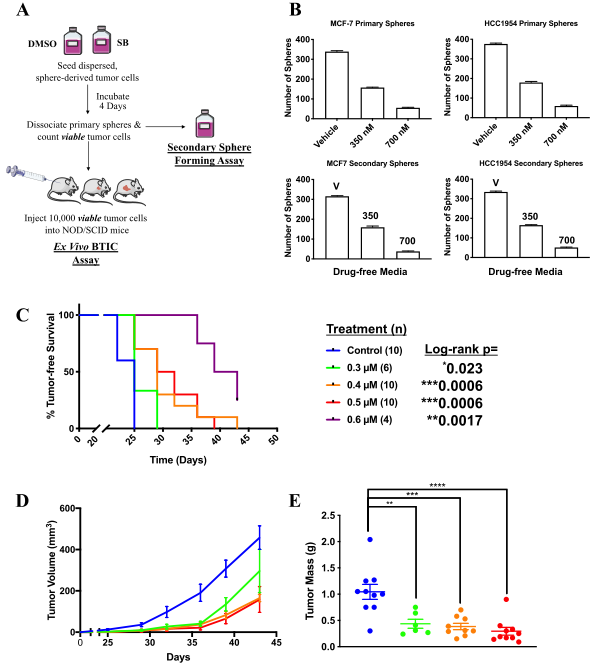
图2: SB-699551通过不可逆机制影响肿瘤球形成并靶向BTIC
研究人员使用结构上不相关的5-HT5A选择性拮抗剂,可降低乳腺癌细胞系和源自人类患者肿瘤的肿瘤球起始细胞的形成率(图1)。
研究人员观察到SB-699551通过不可逆机制抑制肿瘤球形成,且BTIC形成率本身受SB-699551暴露的影响,我们使用离体试验评估了其影响肿瘤起始的能力。他们发现异种移植物的形成在以剂量依赖性方式暴露于SB-699551的肿瘤细胞移植群组中有着显着延迟,并且由SB-699551处理的肿瘤细胞产生的异种移植物表现出降低的生长速率和质量(图2)。
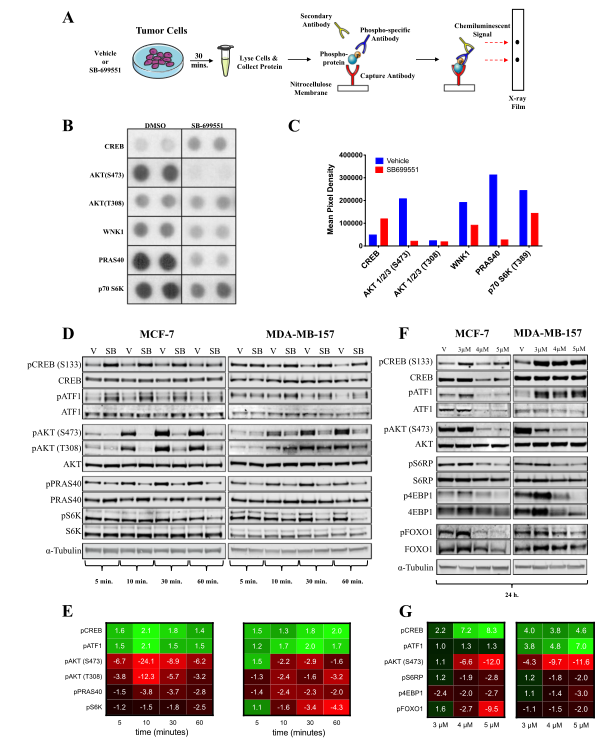
图3:通过经典Gαi/o偶联和通过PI3K/AKT/mTOR途径的SB-699551信号
为了确定SB-699551对BTIC存活的影响,研究人员使用SB-699551来处理细胞,并确定了用该化合物处理后可能会影响乳腺肿瘤细胞株中的信号通路。他们使用了PPA,PPA用一种夹心式ELISA的磷酸特异性抗体来测量43种细胞内蛋白质的磷酸化状态。图3b和c显示了丰度受SB-699551处理影响最大的是磷蛋白。有趣的是,之前观察到的pAKT、pCREB和pATF1的磷酸化降低在SB-699551处理24小时后保持不变(图3f-g)。
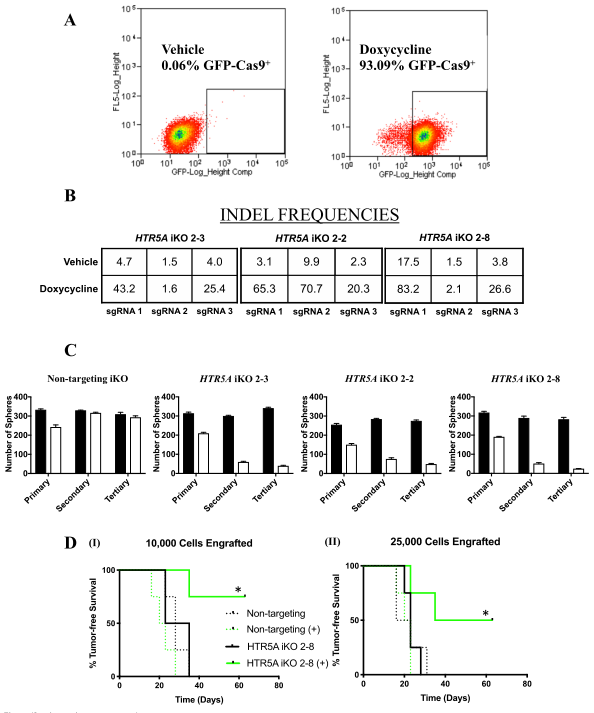
图4:HTR5A的诱导性敲除影响肿瘤球形成并靶向BTIC
为了研究HTR5A表型的遗传损失及其在功能测定中的作用,我们使用CRISPR-Cas9基因编辑技术有条件地突变MCF-7乳腺肿瘤细胞中的HTR5A。研究人员用dox诱导的、Cas9介导在HTR5A中(诱导性敲除;iKO)进行插入/缺失(INDELS)来生成MCF-7细胞系(2-2,2-3,2-8),这是通过基因组DNA的下一代测序(图4b)所建立的。为了确保BTIC频率受到5-HT5A活性丧失的影响,他们用MCF-7nt iKO和HTR5A iKO 2-8细胞系进行离体测定。
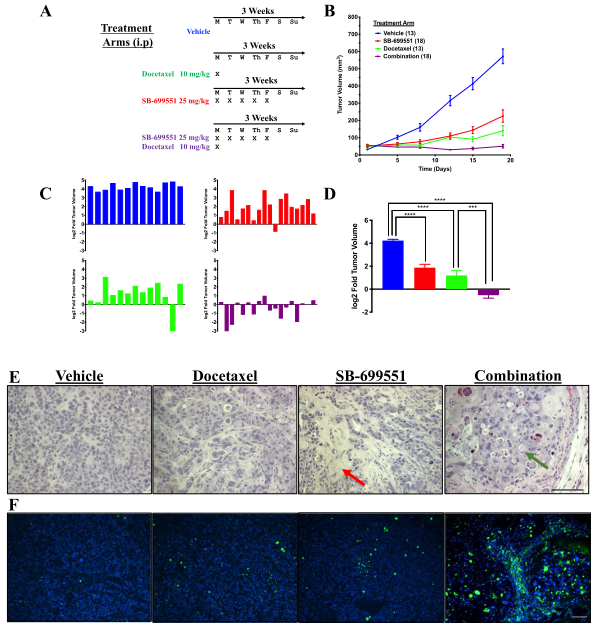
图5:SB-699551的处理抑制体内人乳腺肿瘤异种移植物的生长
当单独施用SB-699551时,SB-699551降低NOD/SCID小鼠中人乳腺肿瘤异种移植物的生长速率并且与多西紫杉醇组合收缩异种移植物。组织学检查和TUNEL测定显示用两种药剂的组合处理的小鼠的异种移植物中肿瘤细胞的凋亡频率增加。每种化合物对肿瘤生长的影响分别与SB-699551和靶向BTIC的多西紫杉醇及其非致瘤的后代一致(图5)。
总而言之,SB-699551通过降低其向下游效应子发信号的能力来降低了5-HT5A的活性,而这种效应器在乳腺癌和其他癌症中已知是失调的。因此,通过CRISPR/Cas9技术敲除5-HT5A发现,这个基因是抗癌药物开发的合适分子靶标。
源井生物开发的CRISPR-U™优化了真核细胞和动物基因编辑载体和过程。效率和准确度比传统方法高10倍。立即联系我们了解与您研究相关的基因编辑服务!
Reference::
Gwynne, William D., et al. "Antagonists of the serotonin receptor 5A target human breast tumor initiating cells." BMC cancer 20.1 (2020): 1-17.










