用过表达细胞研究结直肠癌的经典套路都在这里了!


用过表达细胞研究结直肠癌的经典套路都在这里了!
结直肠癌(Colorectal cancer,CRC)是世界上第四大致死癌症,每年伴随着90万人的死亡。老龄化、高收入国家的饮食习惯、肥胖、缺乏体育锻炼、吸烟等不利因素都会增加CRC的患病风险(图1)。CRC的发生通常是由息肉引起的,并在大约10-15年的时间内爆发为癌症。目前,大多数CRC被认为起源于干细胞或类干细胞,而癌干细胞是基因和表观遗传学改变的逐渐积累使抑癌因子失活并激活致癌因子的结果。癌干细胞位于结肠隐窝的底部,对肿瘤的发生和维持至关重要。目前对于CRC的治疗包括结合内窥镜的外科局部切除、术前减期放疗和全身系统治疗、局部区域性和转移性疾病的广泛手术、转移性疾病的局部消融治疗、姑息性化疗、靶向治疗和免疫治疗。尽管这些治疗方案使晚期疾病的总生存率翻了一倍,但由于该疾病多数在晚期才出现症状,因此研究控制这些癌干细胞生长的调节机制,实施预防性筛查计划,对提高早期发现率,降低CRC的发病率和死亡率具有重要意义。[1]
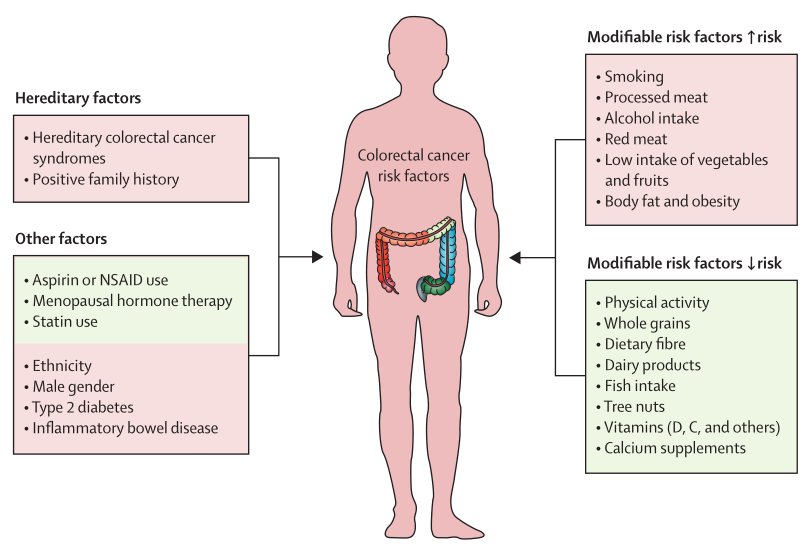
图1 结直肠癌(CRC)可变和不可变的风险因素清单
CRC的发病机制概述
总体而言,CRC有两种不同的主要前体病变途径:70 - 90%的结直肠癌是由传统的腺瘤癌途径(也称为染色体不稳定序列,图2A所示)引起的,另外的10-20%的结直肠癌则是由另一种锯齿状瘤变途径引起的(图2B所示)。这两个途径按一个相对顺序排列,代表了不同多个遗传和表观遗传事件。染色体不稳定表型通常发生在APC突变引发的基因组事件之后,随后是RAS激活或TP53功能丧失。相反,锯齿状瘤变途径与RAS和RAF突变以及以CpG岛甲基化表型为特征的表观遗传不稳定性有关,从而导致微卫星稳定性和微卫星不稳定性的癌症。进一步的全基因组研究也发现了基于突变(如聚合酶-ε或POLE突变或错配修复缺陷[dMMR]的存在)导致高突变表型的新标记物和表型亚型。
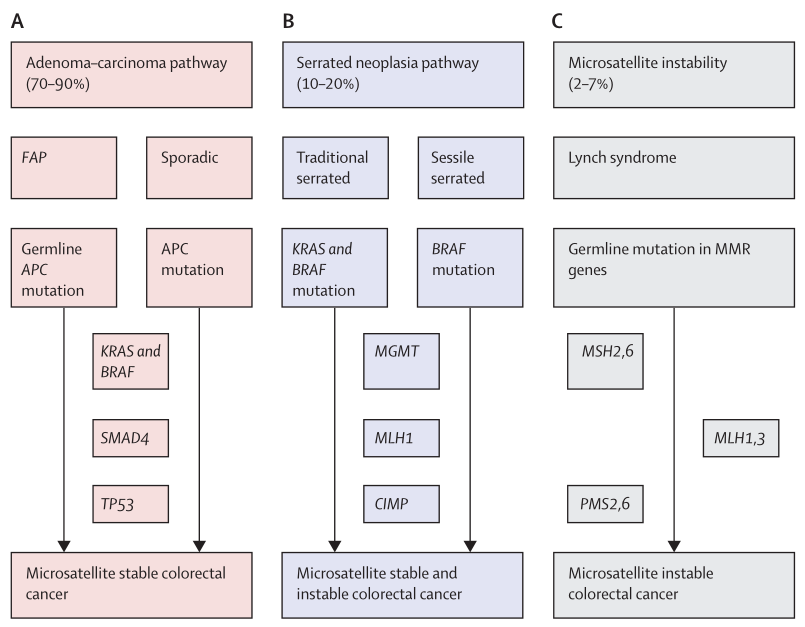
图2 结直肠癌(CRC)病变途径
与左侧(远端)结肠癌和直肠癌相比,右侧(近端)结肠癌的分子特征有所不同(图3)。除了分子差异,左侧和右侧结直肠癌之间还存在胚胎学、生物学和解剖学差异。侧偏有着关键作用,尤其是在转移环境中,并且逐渐地被认为是抗EGFR药物反应的预测标志物。
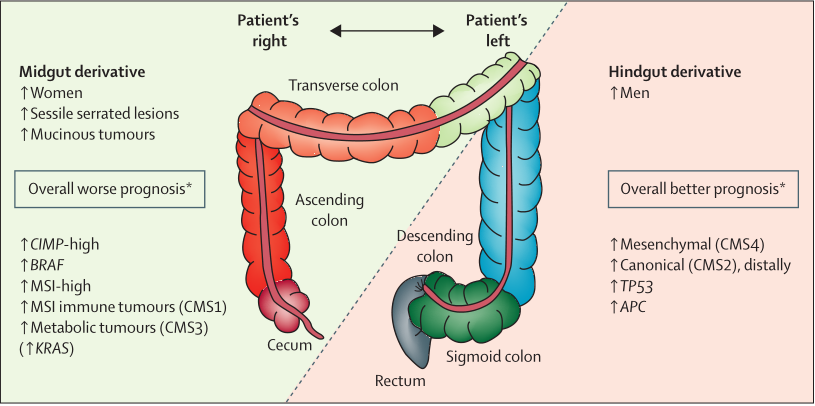
图3 左边与右边结直肠的差异
案例1:非编码RNA过表达模型在CRC中的研究
基于人CRC细胞系(SW480、HCT116、HCT15、SW620等),通过对具有调节作用的miRNA和lncRNA进行过表达研究,进一步认识了CRC的调节机制。例如,miR-30b、miR-224、miR-17-5p、miR-214、miR-181b、miR-590-5p和miR-191已被鉴定为潜在的CRC标记物。其中miR-452作为miR-224/miR-191的家族成员,南方医科大学丁彦青教授团队通过RT-PCR、体内和体外过表达/敲除、生信分析和细胞荧光素酶的功能研究,表明异常高表达的miR-452通过靶定GSK3β的3’-UTR,在CRC细胞内或细胞外会显著抑制GSK3β的表达,从而导致β-catenin逃逸,并迁移到Wnt通路中下游T细胞因子/淋巴增强因子(TCF/LEF)的转录因子家族基因的细胞核结合位点上,最终增强CRC的扩散和入侵(图4)。有研究表明β-catenin的积累和核定位是Wnt/β-catenin信号通路激活的标志,而被异常激活的Wnt/β-catenin信号通路是CRC的肿瘤发生和进展中的重要因素,由此可推测miR-452可作为另一个潜在的预测CRC及CRC有效治疗目标的标记物。[2]
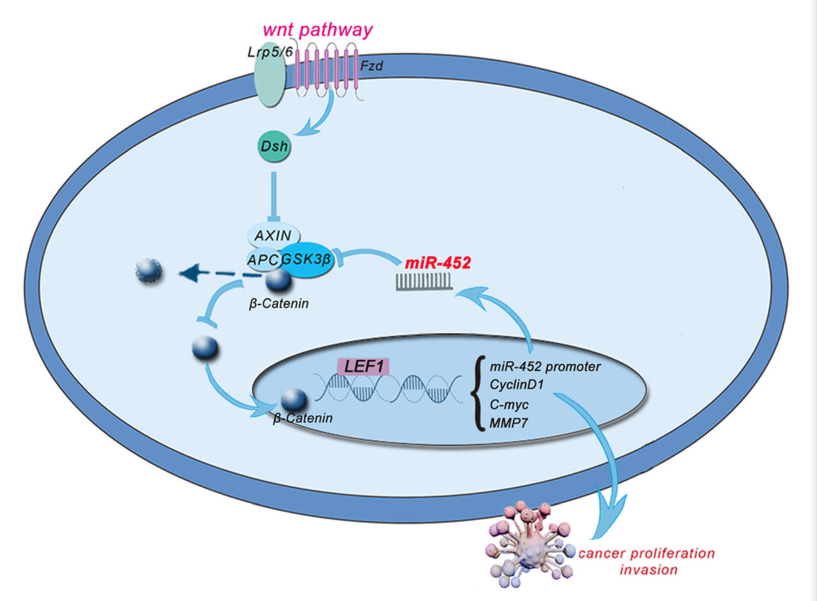
图4 miR-452通过调节GSK3β-TCF4/LEF1的正反馈循环来促进CRC的生长和扩散
除此以外,首都医科大学的王婧团队利用类似的过表达方法,在SW620细胞中过表达了长链非编码RNA(lncRNA MVIH),结果表明lncRNA MVIH具有促进结直肠癌SW620细胞增殖、侵袭和成瘤的作用,而lncRNA MVIH的具体调节机制有待进一步探索[3]。
上述的案例中都选择构建过表达细胞模型来增强结直肠癌细胞的相关表型,从而进一步确认被调控基因对结直肠癌发生与扩散的促进作用,最后预测潜在的药物或治疗靶点。这一研究思路在其他肿瘤癌症治疗研究中也十分常见,过表达细胞模型作为研究基因调控机制的常用工具,稳定的细胞表型有助于进行重复实验与数据验证,因此源井生物领先国内行业标准,提供“单克隆级别”的稳转株服务,交付能挑单克隆的稳转细胞株,现低至7980元,还有半价挑单克隆的超值福利,快点击查看优惠详情>>
案例2:Nkx2.5过表达在CRC中的研究
CRC的形成是一个多步骤过程,异常甲基化的肿瘤抑制基因沉默,以及激活癌基因的突变或染色体的缺失等遗传和表观遗传的改变的积累是引起CRC的直接因素。有研究报道CpG岛甲基化的同源框转录因子NK2同源框5(Nkx2.5,也被称为CSX)与细胞周期相关通路相互作用,在CRC中发挥抑癌作用。华中科技大学同济医学院附属协和医院专家团队通过构建Nkx2.5过表达载体,并通过慢病毒包装,获得结直肠癌细胞HCT116和SW480稳转株,结合RT-PCR、蛋白质印迹分析、细胞增殖、迁移、凋亡等实验,发现由于p53的突变状态不同,Nkx2.5过表达在不同CRC细胞株中的表现也不同。Nkx2.5可以与p53相互作用激活p21WAF1/CIP1的转录,这种共激活效应取决于p53的突变状态。由此推测,Nkx2.5通过激活p53介导的p21WAF1/CIP1的表达,在CRC细胞中发挥了条件抑癌基因的作用。[4]
参考文献
[1]Dekker, E., et al., Colorectal cancer. Lancet, 2019. 394(10207): p. 1467-1480.
[2]Li, T., et al., MiR-452 promotes an aggressive colorectal cancer phenotype by regulating a Wnt/beta-catenin positive feedback loop. J Exp Clin Cancer Res, 2018. 37(1): p. 238.
[3]马妮娜等, lncRNA MVIH异常高表达对结直肠癌细胞的影响. 中国医师杂志, 2021. 23(11): 第1655-1659页.
[4]Li, H., et al., Nkx2.5 Functions as a Conditional Tumor Suppressor Gene in Colorectal Cancer Cells via Acting as a Transcriptional Coactivator in p53-Mediated p21 Expression. Front Oncol, 2021. 11: p. 648045.
构建过表达细胞在结直肠癌研究中已是十分常见的研究手段,但对于SW480、NCI-H716、NCI-H716等转染效率较低的细胞来说,稳转株构建还是有一定的难度,因此源井专门针对结直肠癌的系列细胞进行转染条件的摸索与稳转株构建流程的优化,并从载体构建、病毒包装到稳转株构建各环节都提供优质的服务,了解更多详情欢迎咨询我们!










