干货|快速掌握MCF7细胞培养和基因编辑Tips!

技术专题

细胞培养干货
Expert Insights - Cell Culture
干货|快速掌握MCF7细胞培养和基因编辑Tips!
浏览量: 824
发布日期: 2025年11月03日
干货|快速掌握MCF7细胞培养和基因编辑Tips!

MCF7细胞是从转移性乳腺癌患者的胸腔积液中分离建立的,具有雌激素受体(ER)阳性和孕激素受体(PR)阳性的分子特征。常被用作ER阳性乳腺癌细胞模型。
然而,与其他乳腺癌细胞系相比,MCF7细胞具有生长缓慢,复苏或传代后贴壁缓慢等特性,如果培养不好可能会影响基因编辑或后续实验。今天,小源和大家一起来了解如何培养好MCF7细胞,并掌握其基因编辑的小Tips吧!
基本信息
| 细胞名称 | MCF7(人乳腺癌细胞) |
| 细胞形态 | 上皮样,贴壁细胞 |
| 细胞培养条件 | 87%MEM+10%FBS1%Glutamax+1%SodiumPyruvate+1%NEAA |
| 气相:空气,95%;二氧化碳,5% | |
| 温度:37℃ | |
| 换液频次 | 2-3天/次 |
| 传代比例 | 1:2-1:3 |
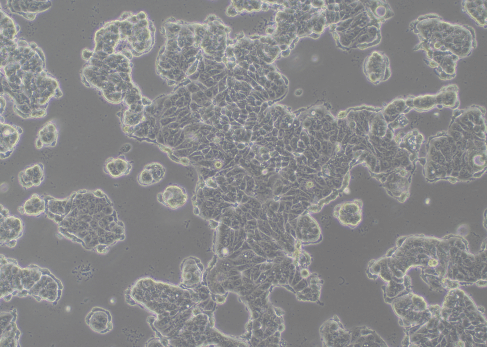
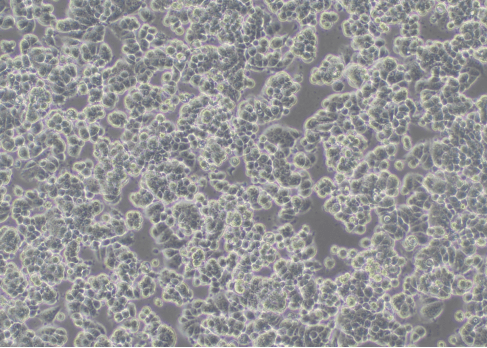
图1 细胞生长正常(100×)
以松散的三维团簇的形式出现,前期呈岛状生长,随着时间的推移,细胞会逐步变成扁平单层细胞,通常呈现为多边形或三角形等规则形状。
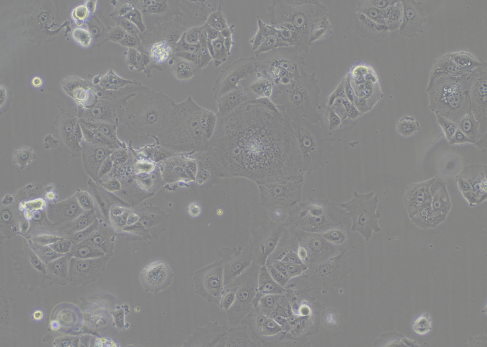
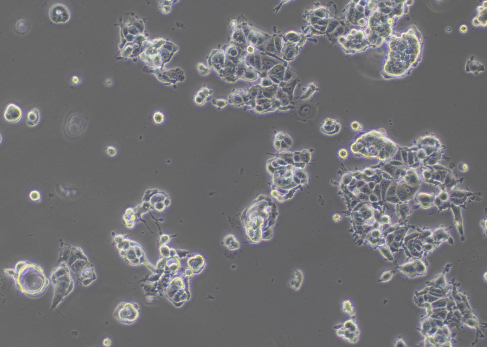
图2 细胞生长状态差(100×)
细胞形态会发生改变,细胞坍塌不立体,细胞出现老化。
MCF7细胞培养
细胞复苏
- 准备:取7mL完全培养基于离心管中备用
- 解冻:将细胞从干冰里取出,用镊子夹住盖子放入 37℃水浴中快速晃动(注意:水不能没过盖子),使其在1分钟左右完全融化,直至冰块融化至绿豆大小,停止水浴
- 离心:将解冻后的细胞悬液转移至离心管中,1100rpm条件下离心4分钟,弃去上清液
- 重悬与接种:用完全培养基重悬细胞,接种于合适大小的培养瓶中
- 培养:将培养皿或培养瓶置于37℃培养箱中培养,24小时后观察细胞状态及贴壁情况
细胞传代(以T25瓶为例)
- 当细胞汇合度达到80-90%时可进行传代,传代时在超净台内弃去培养瓶里的培养液,加入5mLPBS洗涤细胞1-2次
- 加入1mL胰酶,轻轻晃动瓶子并使胰酶完全浸过细胞,将培养瓶放入培养箱孵育 1-2分钟,待在显微镜下观察到大部分细胞变圆变亮,轻轻晃动培养瓶两侧有大部分细胞脱落时,立即终止消化
- 加入2倍胰酶体积即2mL完全培养基终止消化,然后转移至15mL离心管中
- 1100 rpm 室温离心 4 分钟,离心结束,弃去上清,加入完全培养基重悬细胞
- 细胞按照1:2-1:3比例传代,传代第二天观察细胞状态
细胞冻存
- 收集细胞:按照细胞传代的过程收集消化好的细胞到离心管中
- 离心:1100rpm条件下离心4分钟,去掉上清
- 重悬与冻存:用细胞冻存液重悬细胞,按每1mL冻存液含1×10^6个细胞/mL分配到冻存管中,标注好名称、代数、日期等信息
- 降温与储存:将冻存管置于程序降温盒中,-80℃冰箱中过夜后转入液氮罐内保存
细胞培养Tips
- MCF7细胞复苏或者传代后贴壁比较慢,建议48-72小时再观察并进行后续实验
- 消化时要控制好时间,尽量把细胞消化为单个细胞,但要避免过度消化导致细胞损伤
- 接种密度不宜过低,建议每次传代比例为1:2-1:3
- 传代或复苏后可能存在漂浮的活细胞,换液时可离心收集起来继续培养
- 若细胞一直增殖较慢,可提高血清浓度进行培养
- 培养时背景中可能有黑点,为细胞代谢产物和细胞碎片,不影响细胞生长。若黑点较多可以在换液时用预热的PBS轻轻润洗
细胞状态差如何调整
- 培养基和血清:确保使用正确的基础培养基和加入适量血清,血清浓度可根据细胞状态适当调整
- 细胞培养环境:确认培养温度、湿度、气相条件是否正常
- 避免使用过期或长时间存放的培养基,新鲜配制的完全培养基建议在两周内使用完毕
- 细胞传代操作:细胞传代时,注意消化时间和胰酶浓度,避免因消化时间过长或过短导致的细胞损伤
细胞老化如何调整
- 确认培养条件以及培养环境是否正确
- 避免胰酶消化过度:合适的胰酶浓度和消化时间,避免用力吹打,造成细胞损伤
- 增加血清浓度/选择高质量胎牛血清
- 调整细胞密度:细胞密度过高会导致营养不足和代谢废物积累,从而加速细胞老化,应将细胞密度控制在适宜范围内
- 添加生长因子,可以促进细胞增殖和分化,有助于改善细胞老化状态
- 换低代次细胞
- 通过挑选单克隆等方法,从老化的细胞群体中筛选出具有生长优势的单克隆细胞,进行纯化培养
基因编辑Tips
MCF7细胞转染时注意事项
- 确保细胞状态良好,细胞处于对数生长期,此时细胞活性高,分裂旺盛,有利于转染效率的提升,细胞密度一般在70-90%之间
- 注意细胞消化时间,避免过度消化,对细胞造成伤害
- 实验过程中细胞要吹打成单细胞,避免细胞聚团
- 细胞进行实验时活率≥80%
电转法
1.实验时控制好电转细胞量,电转后接种到合适的培养板里
2.要保证电转后细胞贴壁率≥70%
3.转染时需控制好实验时间,电转全程不宜过长
慢病毒法
1.实验时要控制好感染前的细胞汇合度30-40%之间,不可过高
2.选用病毒法进行正式实验前可进行预实验找到最合适的MOI;感染前添加助染剂Polybrene
3.对于转染试剂使用前需要充分混匀保证其均匀性
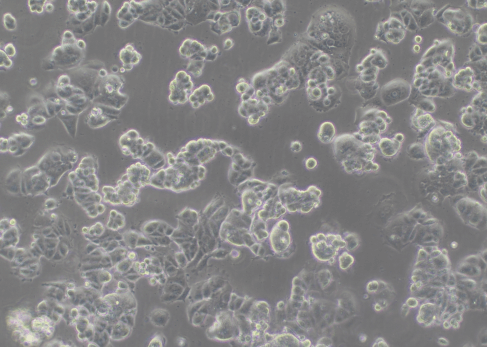
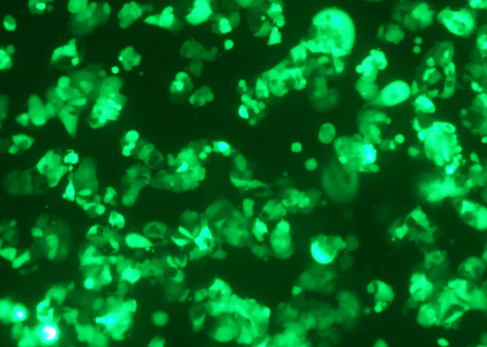
图3 慢病毒感染MCF7(100×)
MCF7铺单克隆实验注意事项
- 确保铺克隆实验前细胞状态正常,老化细胞少,建议控制细胞汇合度在70%左右
- 铺克隆时细胞活率≥85%
- 可先进行预实验找到合适的铺克隆梯度,避免单克隆占比太低
- 细胞接种96孔板时需确保细胞分布均匀
- 稀释细胞计数后结果最好落在1*10^6-2*10^6之间

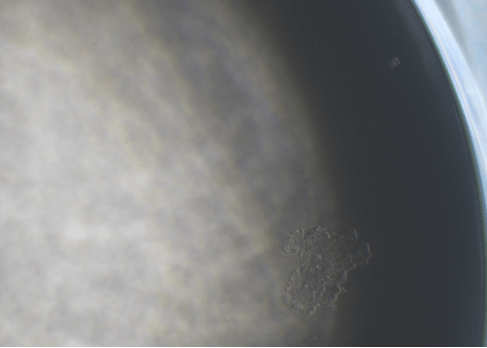
图4 MCF7单克隆(40×)
相关服务推荐
基因敲除细胞系
基于CRISPR-U™专利技术,源井生物根据不同细胞特点选择适宜的转染方法(电转法或病毒法),将gRNA和Cas9转入细胞中,然后进行单克隆筛选,通过靶位点扩增及测序验证筛选出成功敲除的阳性克隆,最终交付纯合子细胞株与相关数据报告。










